Такой статической моделью был атом Кельвина — Томсона. И эта модель была общепринятой по причинам, указанным Вином.
В конце концов оказалось, что новые опытные факты опровергают модель Томсона и, наоборот, свидетельствуют в пользу планетарной модели, факты эти были открыты Резерфордом.
24 мая 1907 г. в Манчестере Резерфорд развернул огромную, привлекая молодых ученых из разных стран мира. Одним из его деятельных сотрудников был немецкий физик Ганс Гейгер, создатель первого счетчика элементарных частиц — счетчика Гейгера. В Манчестере с Резерфордом работали Э. Марсден, К. Фаянс, Г. Мозли, Г. Хевеши и другие физики и химики.
В Манчестер в 1912 г. приехал Нильс Бор.
В этой атмосфере коллективного научного творчества родились крупные научные достижения Резерфорда, из которых в первую очередь следует отметить разгадку природы а-частиц и открытие ядерного строение атома.
Сюда же следует присоединить знаменитые статьи Бора по квантовой теории планетарного атома. В Манчестере было положено начало квантовой и ядерной физике.
Открытие атомного ядра
Уподобление атома планетной системе делалось еще в самом начале XX в. Но эту модель было трудно совместить с законами электродинамики, и она была оставлена, уступив место модели Томсона. Однако в 1904 г. начались исследования, приведшие к утверждению планетарной модели.
Одна из тем, выдвинутая Резерфордом в Манчестере,—рассеяние а-частиц. Она была поручена Гейгеру и Марсдену.
Метод, применявшийся для исследования, заключался в следующем: а-частицы, испускаемые источником, диафрагмировались щелью попадали на экран из сернистого цинка. на котором получалось изображение щели в виде узкой полоски. Затем между щелью и экраном помещали тонкую металлическую пластинку, изображение щели размывалось, что указывало на рассеяние а-частиц веществом пластинки. Исследуя угол рассеяния, Гейгер установил, что наиболее вероятный угол рассеяния пропорционален атомному весу и обратно пропорционален кубу скорости частицы.
Но наиболее поразительным оказался факт, открытый Гейгером и Марсденом в 1909 г., — существование больших углов рассеяния. Некоторая, очень небольшая часть а-частиц (примерно 1/8000) рассеивается на угол, больший прямого, отбрасываясь, таким образом обратно к источнику. Тонкая пластине отбрасывала частицы, летящие с большой скоростью. Как раз в том же, 1909 году Резерфорд и Ройдс неопровержимо доказали, что а-частицы являются дважды ионизированными атомами гелия. Для таких тяжелых быстро движущихся частиц рассеивание на углы большие прямого, казалось весьма невероятным. Резерфорд говорил, что это так же невероятно, как если бы пуля отскакивала от листа папиросной бумаги.
Одно из возможных объяснений аномального рассеяния состояло в том что оно складывается из многих небольших углов отклонений, вызванные атомами рассеивающего вещества.
Исходя из модели Томсона, Резерфорд подсчитал, что это не может давать больших отклонений даже при многих столкновениях с частицей. И здесь Резерфорд обратился к планетарной модели.
Когда а-частица проходит мимо заряженного ядра, то под воздействием кулоновской силы, пропорциональной заряду ядра и заряду а-частицы и обратно пропорциональной квадрату расстояния между ними, она движется по гиперболе, удаляясь по ее ветви после прохождения мимо ядра. Ее прямолинейный путь, таким образом, искривляется, и она отклоняется на угол рассеяния ф.
1 марта 1911 г. Резерфорд сделал в философском обществе в Манчестере доклад «Рассеяние а- и b-лучей и строение атома». В докладе он говорил: «Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окруженного однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома а- и b-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала».
Резерфорд рассчитал вероятность такого отклонения и показал, что она пропорциональна числу атомов п в единице рассеивающего материала, толщине рассеивающей пластинки и величине b2 , выражаемой следующей формулой:
![]()
где Ne — заряд в центре атома, Е—заряд отклоняемой частицы, т—ее масса, и—ее скорость. Кроме того, эта вероятность зависит от угла рассеяния ф, так что число рассеянных частиц на единицу площади пропорционально cosec4 (Ф/2).
Важным следствием теории Резерфорда было указание на заряд атомного центра, который Резерфорд положил равным ± Ne. Заряд оказался пропорциональным атомному весу.
В 1913 г. Гейгер и Марсден предприняли новую экспериментальную проверку формулы Резерфорда, подсчитывая рассеяние частиц по производимым ими сцинтилляционным вспышкам. Из этих исследований и возникло представление о ядре как устойчивой части атома, несущей в себе почти всю массу атома и обладающей положительным зарядом. При этом число элементарных зарядов оказалось пропорциональным атомному весу.
В 1913 г. Ван ден Брук показал, что заряд ядра совпадает с номером элемента в таблице Менделеева. В том же1913 г. Ф. Содди и К. Фаянс пришли закону смещения Содди—Фаянса, ее гласно которому при а-распаде радиоактивный продукт смещается в менделеевской таблице на два номера выше а при b-распаде—на номер ниже. К этому же времени Содди пришел представлению об изотопах как разновидностях одного и того же элемент ядра атомов которых имеют одинаковый заряд, но разные массы.
В богатом событиям 1913 г. были опубликованы три знаменитые статьи Бора «О строении атомов и молекул», открывшие путь к атомной квантовой механике.
Томас Рис Вильсон (1869-1959) изобрел замечательный прибор, известный ныне под названием «камера Вильсона». Этот прибор позволяет видеть заряженную частицу по оставляемому ею туманному следу.
Позднее ученик и сотрудник Резерфорда Блэккет (1897—1974) получил вильсоновскую фотографию расщепления ядра азота а-частицей, первой ядерной реакции, открытой Резерфордом.
В этом же году Бор, имевший возможность поработать с автором первой модели атома, а затем с автором планетарной модели, на основе последней создает свою теорию атома Резерфорда-Бора.
Знаменитая статья Бора, в которой были заключены основы этой теории, начиналась с указания на модели Резерфорда и Томсона и обсуждения их особенностей и различий.
Резерфорд сразу понял революционный характер идей Бора и высказал критические замечания по самым фундаментальным пунктам теории Бора. После длительных дискуссий статья Бора и две его последующие статьи были опубликованы. Однако окончательный ответ на возражения Резерфорда был дан только созданием квантовой механики.
В 1915 г. Бор опубликовал работы «О сериальном спектре водорода и строении атома» и «Спектр водорода и гелия», «О квантовой теории излучения в структуре атома». Он развил исследования, выполненные им в Манчестере в августе 1912 г., и опубликовал их под названием «Теория торможения заряженных частиц при их прохождении через вещество».
В декабре 1915 и январе 1916 г. Арнольд Зоммерфельд (1868—1951) развил теорию Бора, рассмотрев движение электрона по эллиптическим орбитам и обобщив правила квантования Бора. Зоммерфельд дал также теорию тонкой структуры спектральных линий, введя релятивистское изменение массы со скоростью. В его расчеты вошла безразмерная универсальная постоянная тонкой структуры:
![]()
Теория атома после открытия Зоммерфельда стала называться теорией Бора — Зоммерфельда.
Продолжая развивать свои идеи, Бор сформулировал принцип соответствия (1918), означавший шаг вперед в ответе на вопросы, поставленные Резерфордом.
В 1922 г. Бор получил Нобелевскую премию по физике. В нобелевском докладе он развернул картину с стояния атомной теории к этому времени. Одним из наиболее существенных успехов теории было нахождения. ключа к периодической системе элементов, которая объяснялась наличие электронных оболочек, окружающих ядра атомов.
В 1925 г. работой Гейзенберга началось создание квантовой механики. В том же году Уленбек и Гаудсмит, работавшие у Эренфеста, открыли спин электрона, а Паули открыл принцип, носящий ныне его имя. После открытия Гейзенбергом в 1927 г. принципа неопределенности Бор выдвинул в качестве основной теоретической идеи квантовой теории принцип дополнительности.
В 1936 г. Бор выступил со статьей «Захват нейтрона и строение ядра», в которой предложил капельную модель ядра и механизм захвата нейтрона ядром. Ядерной физике была посвящена также работа 1937 г. «О превращении атомных ядер, вызванных столкновением с материальными частицами».
В конце 1938—начале 1939 г. было открыто деление урана.
Atom бора
Бор, как и Томсон до него, ищет такое расположение электронов в атоме, которое объяснило бы его физические и химические свойства. Бор уже знает о модели Резерфорда и берет ее за основу. Ему известно также, что заряд ядра и число электронов в нем, равное числу единиц заряда, определяется местом элемента в периодической системе элементов Менделеева. Таким образом, это важный шаг в понимании физико-химических свойств элемента. Но остаются непонятными две вещи: необычайная устойчивость атомов, несовместимая с представлением о движении электронов по замкнутым орбитам, и происхождение их спектров, состоящих из вполне определенных линий. Такая определенность спектра, его ярко выраженная химическая индивидуальность, очевидно, как-то связана со структурой атома.
Устойчивость атома в целом противоречит законам электродинамики, согласно которым электроны, совершая периодические движения, должны непрерывно излучать энергию и, теряя ее, «падать» на ядро. К тому же и характер движения электрона, объясняемый законами электродинамики, не может приводить к таким характерным линейчатым спектрам, которые наблюдаются на самом деле.
Линии спектра группируются в серии, они сгущаются в коротковолновом «хвосте» серии, частоты линий соответствующих серий подчинены странным арифметическим законам.
Так, Иоганн Бальмер в 1885 г. нашел, что четыре линии водорода На, Нb, Нg, Hs имеют длины волн, которые могут быть выведены из одной формулы:
![]()
Позже было найдено еще два десятка линий в ультрафиолетовой части, и их длины волн также укладывались в формулу Бальмера.
Иоганн Ридберг в 1889-1900 гг. нашел, что и линии спектров щелочных металлов могут быть распределены по сериям. Частоты линий каждой серии могут быть представлены в виде разности двух членов—термов. Так, для главной серии
![]()
где R — некоторое постоянное число, получившее название постоянной Ридберга, s и р — дробные поправки, меняющиеся от серии к серии.
«Основным результатом тщательного анализа видимой серии линейчатых спектров и их взаимоотношений, — писал Бор,—было установление того факта, что частота v каждой линии спектра данного элемента может быть представлена с необыкновенной точностью формулой v =T’—T”, где T' и T" — какие-то два члена из множества спектральных термов T, характеризующих элемент».
Бору удалось найти объяснение этого основного закона спектроскопии и вычислить постоянную Ридберга из таких фундаментальных величин, как заряд и масса электрона, скорость света и постоянная Планка. Но для этого ему пришлось ввести в физику атома представления о стационарных состояниях атомов, находясь в которых электрон не излучает, хотя и совершает периодическое движение по круговой орбите.
Для таких состояний момент импульса равен кратному от h/2p. При переходе с одной орбиты на другую электрон излучает и поглощает энергию, равную кванту. В заключительных замечаниях к трем своим статьям «О строении атомов и молекул» Бор формулирует свои основные гипотезы следующим образом:
«I. Испускание (или поглощение) энергии происходит не непрерывно, как это принимается в обычной электродинамике, а только при переходе системы из одного «стационарного» состояния в другое.
2. Динамическое равновесие системы в стационарных состояниях определяется обычными законами механики, тогда как для перехода системы между различными стационарными состояниями эти законы не действительны.
3. Испускаемое при переходе системы из одного стационарного состояния в другое излучение монохроматично, и соотношение между его частотой v и общим количеством излученной энергии Е дается равенством E = hv , где h — постоянная Планка.
4. Различные стационарные состояния простой системы, состоящей из вращающегося вокруг положительного ядра электрона, определяются из условия, что отношение между общей энергией, испущенной при образовании данной конфигурации, и числом оборотов электрона является целым кратным h/2p. Предположение о том, что орбита электрона круговая, равнозначно требованию, что момент им пульса вращающегося вокруг ядра электрона был бы целым кратным h/2p.
5. «Основное» состояние любой атомной системы, т. е. состояние, при котором излученная энергия максимальна, определяется из условия, чтобы момент импульса каждого электрона относительно центра его орбиты равнялся h/2p».
Далее Бор пишет: «Было показано, что при этих предположениях с помощью модели атома Резерфорда можно объяснить законы Бальмера и Ридберга, связывающие частоты различных линий в линейчатом спектре».
Именно Бор получил для спектра водорода формулу:
![]()
где t — целые числа.
«Мы видим,—пишет Бор,—что это соотношение объясняет закономерность, связывающую линии спектра водорода. Если взять t2 = 2 и варьировать t1 , то получим обычную серию Бальмера. Если взять t2 =3, получим в инфракрасной области серию, которую наблюдал Пашен и еще ранее предсказал Ритц. При t2 =1и t2 =4,5,... получим в крайней ультрафиолетовой и соответственной крайней инфракрасной областях серии, которые еще не наблюдались, но существование которых можно предположить ».
Действительно, серия в ультрафиолетовой области, соответствующая t2 = 1, была найдена Лайманом в 1916 г., серия в инфракрасной области, соответствующая t2 =4 была найдена Брэкетом в 1922 г., и серия t2 =5 была найдена Пфундом в 1924 г.
Используя известные в то время значения е, т, h , Бор вычислил значение постоянной в спектральной' формуле:
![]()
тогда как экспериментальное значение равно 3,290*1015 . «Соответствие между теоретическим и наблюдаемым значениями лежит в пределах ошибок измерений постоянных, входящих в теоретическую формулу», — писал Бор.
После опубликования статей Бора Фаулер обнаружил новые линии при разряде в трубке, заполненной водородом и гелием, которые, по его мнению, не укладываются в серию Бора. Бор уточнил теорию, введя движение ядра и электрона около общего центра массы. Тогда:
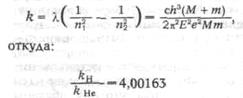
в точном соответствии с экспериментом.
В последующих работах Бор непрерывно уточнял основы своей теории. Она была дополнена принципом соответствия (1918), позволяющим делать определенные выводы об интенсивности и поляризации спектральных линий.
Сам Бор неоднократно занимался вопросом о влиянии магнитных и электрических полей на спектры атомов. Он же впервые включил в квантовую теорию атома и рассмотрение рентгеновских спектров, считая, что «характеристическое рентгеновское излучение испускается при возвращении системы в нормальное состояние, если каким-либо воздействием, например катодными лучами, были предварительно удалены электроны внутренних колец» (1913).
Генри Мозли в 1913—1914 гг. открыл закон смещения длин волн характеристических лучей, принадлежащих к одной и той же серии, при переходе от элемента к элементу. Частота рентгеновских лучей, определяющая их «жесткость», возрастает с возрастанием порядкового номера элемента.
Первое теоретическое истолкование рентгеновских спектров на основе идей Бора состоит в том, что они обязаны переходам электронов на вакантные места во внутренних оболочках. Оно было дано Зоммерфельдом в его фундаментальной работе 1916 г. В том же 1916 г. П. Дебай и П. Шеррер разработали новую методику рентгеновского анализа кристаллов в порошке, получившую широкое распространение в рентгеноструктурном анализе.
Идеи Бора получили экспериментальное подтверждение в опытах Джеймса Франка (1882—1964) и Густава Герца, которые начиная с 1913 г. изучали соударения электронов с атомами паров и газов. Оказалось, что электрон может сталкиваться с атомами газов упруго и неупруго. При упругом ударе электрон отскакивает от тяжелого атома (например, ртути), не теряя энергии, при неупругом ударе его энергия теряется и передается атому, который при этом либо возбуждается, либо ионизируется. Порции энергии, затрачиваемые на возбуждение атома, вполне определенные: так, электрон при столкновении с атомами ртути теряет энергию 4,9 эВ, что соответствует энергии кванта ультрафиолетового света длиной волны 2537 А.
Квантовый характер поглощения энергии атомом был продемонстрирован в опытах Франка, Герца и других физиков с поразительной наглядностью. За эти исследования, которые продолжались ряд лет, в 1925 г. Франк и Герц были удостоены Нобелевской премии.
Квантовый характер излучения и поглощения энергии атомом лег в основу теоретического исследования о световых квантах, выполненного Эйнштейном в 1916—1917 гг. В этом исследовании Эйнштейн вывел формулу Планка, исходя из представления о направленном излучении. Атом излучает и поглощает энергию квантами. Выстреливая квант в определенном направлении, атом сообщает ему не только энергию hv
,
но и импульс ![]() .
.
При излучении молекула газа переходит из энергетического состояния Zm
c энергией em
в состояние Zn
с энергией en
излучая энергию em
- en
. Поглощая такую же энергию, молекула переходит из состояния Zn
в состояние Zm
. Молекула может перейти из состояния Zm
в состояние Zn
самопроизвольно, спонтанно. Вероятность такого перехода за время dt
пропорциональна этому промежутку времени
29-04-2015, 02:12
