Сравнительная оценка физико-химических методов контроля качества метронидазола
Е. Ф. Сафонова, А. И. Сливкин, Д. С. Вязова, В. Ф. Дзюба Воронежский государственный университет
Появление на фармацевтическом рынке нашей страны новых лекарственных форм, содержащих в качестве основного действующего вещества метронидазол, требует совершенствования методов контроля его качества. В данной работе проведена сравнительная оценка физико-химических методов определения метронидазола и предложена оптимальная методика установления подлинности, доброкачественности и количественного содержания метронидазола в лекарственной форме — таблетке.
ВВЕДЕНИЕ Более 30 лет назад в медицинскую практику были введены эффективные средства борьбы с трихомонозом, получаемые на основе 5-нитроимидазола. К ним относятся такие противопаразитарные агенты (трихомонациды), как метронидазол.
Метронидазол — современный высокоактивный препарат, обладающий широким спектром действия в отношении простейших (трихомонад, лямблий, дизентерийных амеб, балантидий, лейшманий), а также споро- и неспорообразующих облигатных анаэробных бактерий. В том числе, метронидазол эффективен и в отношении Helicobacter pylori.
В настоящее время появление на фармацевтическом рынке новых лекарственных форм, содержащих в качестве основного действующего вещества метронидазол, требует совершенствования методов его контроля качества и стандартизации.
Цель работы — проведение сравнительной оценки физико-химических методов по контролю качества и выбор оптимальных методик для установления подлинности, доброкачественности и количественного содержания метронидазола на примере лекарственной формы — таблетки.
МЕТОДИКА ЭКСПЕРИМЕНТА Анализ публикаций за последние 10 лет и нормативной документации показал, что в настоящее время единой, унифицированной и обоснованной с научной точки зрения методики по контролю качества не существует. Так, Европейская фармакопея [1] рекомендует проводить идентификацию метронидазола методом ИКС, однако самого ИК-спектра и характеристических полос поглощения препарата в ИК-области в отечественной и зарубежной литературе найти не представилось возможным.
Большинство отечественных и зарубежных нормативных документов на таблетки метронидазола для количественного определения рекомендуют метод УФ-спектрофотометрии, однако данные по max и min поглощения метронидазолом весьма противоречивы и не обоснованы с научной точки зрения. Так, в работе [1] рекомендуется проводить фотометрирование 0, 001%-ного спиртового раствора метронидазола при 312 нм. Европейская фармакопея, ФС, ФСП [1, 6, 7] на метронидазол рекомендуют количественно определять его в таблетках при максимуме поглощения 317 нм, в лекарственной форме — "гель" количественное определение проводится при длине волны 312 нм [3], а в лекарственной форме — вагинальная мазь при длине волны 320 нм [4] (растворитель — спирт этиловый 95% и вода в соотношении 1:1).
Наличие в молекуле метронидазола функциональных групп, таких как нитрогруппа, а также двойные и сопряженные двойные связи, обуславливает возможность его определения спектральными методами, в частности, УФ- и ИК-спектрофотометрией.
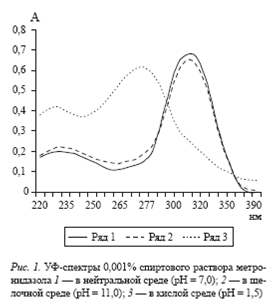
Обзорные спектры метронидазола в ультрафиолетовой области снимали на спектрофотометре СФ-26. УФ-спектр стандартного 0, 001% раствора метронидазола в этаноле, представлен на рис. 1.
Установлено, что максимум поглощения спиртового раствора метронидазола составляет 317 нм.
Известно, что величина рН может влиять на максимум поглощения и вызывать смещение его в сторону больших или меньших длин волн. В связи с этим было проведено изучение влияния рН на спектральные характеристики спиртовых растворов метронидазола. Для этого спиртовой раствор метронидазола подкисляли 2 М раствором хлороводородной кислоты и подщелачивали 2 М раствором гидрооксида натрия. УФ-спектры спиртовых растворов метронидазола при различных значениях рН показаны на рисунке 1. В кислой среде найдены два максимума поглощения при 230 и 277 нм и минимум поглощения при 244 ± 2 нм. УФ-спектры спиртового раствора метронидазола в щелочной среде имеют также два максимума поглощения при 230 и 317 нм и минимум поглощения при 265 нм.
Известно, что сдвиг полосы поглощения в длинноволновую область (вплоть до видимой) особенно значителен, если хромофорные группы находятся в сопряжении друг с другом. В молекуле метронидазола такой факт имеет место, так как группы –N=O и >С=N– находятся в сопряжении друг с другом.
Таким образом, наличие интенсивного максимума поглощения метронидазола в нейтральной среде (рН ≈ 7, 0) и щелочной среде в длинноволновой области (λmax = 317 нм) обусловлено функциональной группой –NO2 и сопряжением хромофорных групп –N=O и >С=N-.
В кислой среде наиболее интенсивный максимум поглощения метронидазола смещается в коротковолновую область. В этом случае происходит гипсохромный сдвиг (λmax = 277 нм), обусловленный переносом заряда при взаимодействии донора (атома азота) и акцептора (иона Н+) электронов. Таким образом, в кислой среде образуется катион метронидазола, который и вызывает такой эффект.Смещения менее интенсивного максимума поглощения при 230 нм не наблюдается ни в кислой, ни в щелочной среде. Поэтому при идентификации и количественном определении метронидазола необходимо строго следить за величиной рН.
Почти все современные фармакопеи рекомендуют проводить испытание на подлинность методом ИКС, сравнивая спектр испытуемого ЛП со спектром стандартного образца. Нами был снят ИК-спектр субстанции метронидазола в виде прессованных таблеток с калия бромидом.
Отнесение полос поглощения позволило установить характеристические максимумы, соответствующие основным функциональным группировкам и структурным фрагментам метронидазола.
Так, сильное поглощение при 1370 см–1 и в области 1600—1500 см–1 свидетельствует о наличии нитрогруппы. Известно, что полоса поглощения при 3600—3700 см–1 указывает на присутствие в соединении одной или нескольких гидроксильных групп. Поскольку эти группы весьма склонны к образованию водородных связей, то это вызывает смещение полос поглощения в сторону более низких частот (3500—3300 см–1).
Значение и характер волновых чисел при 770—750 см–1; 870—750 см–1 и 900—860 см–1 свидетельствуют о количестве и природе заместителей в 1, 2 и 5 положениях имидазольного цикла: ─NO2;
─СН3 и НО─С2Н4─.
В ИК-спектре метронидазола в кислой среде появляется максимум поглощения при 1610 см–1, который соответствует колебаниям протонированной третичной аминогруппы в положении 3
(=N+─H ), что подтверждает данные УФ-спектрофотометрии. В ИК-спектре метронидазола, полученного перекристаллизацией из щелочного раствора, этот максимум отсутствует.
Смещение максимумов поглощения при 1480 см–1 до 1487 см–1 в щелочной среде, которое соответствует колебаниям ─NO2 групп, указывает на образование аци-нитросоли.
Отсутствие характеристических полос поглощения в интервале 1600—2500 см–1 позволяет рекомендовать для установления подлинности методом ИКС две области: от 1600 до 400 см–1 и от 4000 до 2500 см–1.
Следующим этапом нашей работы было определение метронидазола методом хроматографии в тонком слое сорбента. Данный метод рекомендован практически всеми фармакопеями для установления наличия посторонних примесей в лекарственных формах, содержащих меторонидазол. Однако, идентификация веществ в этом случае осуществляется в УФ-свете, что создает определенные трудности в оценке качества лекарственных препаратов вследствие низкой селективности и специфичности.
Поэтому нами было проведено усовершенствование методик ТСХ.
Во-первых, было проведено изучение и сравнение элюирующих систем, наиболее часто применяемых в ТСХ-анализе. Использовались системы, имеющие среднюю величину полярности ≈4, 5.
Во-вторых, в качестве растворителя для приготовления исследуемых и эталонных растворов использовали смесь веществ хлороформ — уксусная кислота (1:1) вместо смеси хлороформ — спирт метиловый (1:1). Это позволило исключить использование высоко токсичного метилового спирта.
Таким образом, оптимальными для анализа метронидазола в тонком слое сорбента, на наш взгляд, следует считать следующие условия хроматографирования:
1. При использовании УФ-детектирования: Растворитель: смесь хлороформ — уксусная кислота (1:1);
Сорбент: "Силуфол UV-254";
Элюент: хлороформ — ДМФА (8:2);
Объем наносимой пробы: 10 мкл;
Время хроматографирования: 35 мин;
Время насыщения камеры объемом 2 л: не менее 60 мин.
2. При использовании в качестве реагента-обнаружителя диазореактива:
Растворитель: смесь хлороформ — уксусная кислота (1:1);
Сорбент: "Сорбфил";
Элюент: этанол — уксусная кислота (8:2);
Объем наносимой пробы: 10 мкл;
Время хроматографирования: 35 мин;
Время насыщения камеры объемом 2 л: не менее 60 мин;
Детектирование: конц. HC l, 5% NaNO2, щелочной раствор β-нафтола.
Лучшее разделение и качество хроматографических зон было достигнуто в системе этанол — уксусная кислота (8:2) при детектировании с помощью реакции образования азокрасителя (HC l, NaNO2, β-нафтол), так как в этом случае хроматографическая зона имеет четкие контуры и позволяет рассчитать основную идентификационную характеристику Rf = 0, 76.
Хорошее разделение было также достигнуто в системе хлороформ — ДМФА (8:2) при детектировании с помощью УФ-излучения при 254 нм. Установлено, что при хроматографировании в системах хлороформ — уксусная кислота (8:2) и этанол — уксусная кислота (8:2) с детектированием в ультрафиолетовом свете (254 нм) величины Rf хроматографических зон субстанции и таблеток не совпадают (Rf субстанции = 0, 65, Rf таблеток = 0, 75). Зоны в данном случае являются не четкими и частично размытыми.
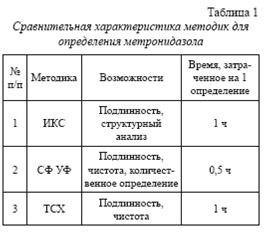
ЗАКЛ ЮЧЕНИЕ Для проведения контроля качества метронидазола было апробировано несколько методик, рекомендованных НД. Основные характеристики методик для определения метронидазола представлены в таблице 1.
На основании данных таблицы можно сделать вывод о том, что каждая из методик имеет свои преимущества и недостатки. Методика ИКС достаточно экспрессная, однако она не позволяет проводить количественное определение метронидазола. Метод ТСХ отличается простотой, экспрессностью, высокой чувствительностью, не требует больших затрат анализируемого материала. С другой стороны, возможности этого метода ограничены вследствие недоступности специализированных сканирующих устройств для проведения количественного анализа.
Из всех представленных методик, на наш взгляд, наиболее приемлемым является метод спектрофотометрии в УФ-области, поскольку он позволяет, во-первых, проводить все виды анализа, необходимые для стандартизации метронидазола и получить максимум информации. Во-вторых, этот метод является самым экспрессным, достаточно чувствительным и его проведение возможно в каждой аккредитованной лаборатории.
Список литературы
1. European Pharmacopoeia, 1997.
2. Беликов В.Г. Фармацевтическая химия / В.Г. Беликов.— 3-е изд., перераб. и доп. — Пятигорск: Пятигорская гос. фармацевт. акад., 2003.— 713 с.
3. Захарова Г.В. Изучение геля метронидазола / Г.В. Захарова, К.В. Алексеев, С.Н. Суслина // Фармация. — 2004.— № 4.— С.34—36.
4. Мурза Я.В. Разработка и исследование вагинальных мазей с метронидазолом / Я.В.Мурза // Фармация. — 1994.— №8.— С.11—14.
5. НД 42-4459-95 на "Орвагил" (метронидазол) 250 мг таблетки "АйСиЭн Галеника" Югославия.
6. ФС 42-3444-97 на таблетки метронидазола 0, 25 г 7. ФСП 42-0055421403 на "Метронидазол" таблетки 0, 25 г. ОАО "Щелковский витаминный завод".
9-09-2015, 00:42
