КУРСОВАЯ РАБОТА
По теме:
Углеводы и их свойства . Глюкоза
Введение
СПИД, сахарный диабет, бронхиальная астма, рак – это неполный перечень заболеваний для которых так и не найдены альтернативные препараты, помогающие полностью излечить их. Задачей здравоохранения является найти лекарственные препараты для излечения этих болезней.
Фармацевтическая химия – наука, изучающая способы получения, физические и химические свойства, методы контроля качества лекарственных веществ, влияние отдельных особенностей строения молекул лекарственных веществ на характер действия их на организм, изменения, происходящие при их хранении.
Решение задач, стоящих перед фармацевтической химией поможет выявить новые свойства уже имеющихся лекарственных препаратов и открыть новые.
1. Углеводы
Углеводы - обширная группа полигидроксикарбонильных соединений, входящих в состав всех живых организмов. Особенно широко они распространены в растительном мире: 80% сухой массы растений составляют углеводы; к углеводам относят также многие производные, получаемые при химической модификации этих соединений путем окисления, восстановления или введения различных заместителей.
Углеводы участвуют в обмене веществ и энергии в организме человека и животных. Являясь основным компонентом пищи, углеводы поставляют большую часть энергии, необходимой для жизнедеятельности (более половины энергии у человека образуется за счет углеводов). Некоторые углеводы входят в состав нуклеиновых кислот, осуществляющих биосинтез белка и передачу наследственных признаков.
К углеводам относят глюкозу, фруктозу, сахар (сахарозу), крахмал, целлюлозу (клетчатку) и др. Одни из них являются основными продуктами питания, другие (целлюлоза) используются для получения бумаги, пластмасс, волокон и т.д.
Термин "углеводы" возник потому, что первые известные представители углеводы по составу отвечали формуле CmH2nOn (углерод + вода); впоследствии были обнаружены природные углеводы с другим элементным составом.
1.1 Классификация и распространение
Углеводы принято делить на моносахариды, олигосахариды и полисахариды.
К наиболее обычным и распространенным в природе моносахаридам относят D-глюкозу, D-галактозу, D-маннозу, D-фрук-тозу, D-ксилозу, L-арабинозу и D-рибозуглеводы. Из представителей других классов моносахаридов часто встречаются:
1) дезоксисахара, в молекулах которых одна или несколько групп ОН заменены атомами H (напр., L-рамноза, L-фукоза, 2-дезокси-D-рибоза);
2) аминосахара, где одна или несколько групп ОН заменены на аминогруппы (напр., 2-амино-2-дезокси-D-глюкоза, или D-глюкозамин);
3) многоатомные спирты (полиолы, альдиты), образующиеся при восстановлении карбонильной группы моносахаридов (D-сорбит из D-глюкозы, D-маннит из D-маннозы);
4) уроновые кислоты - альдозы, у которых группа CH2OH окислена в карбоксильную (напр., D-глюкуроновая кислота);
5) разветвленные сахара, содержащие нелинейную цепь углеродных атомов (апиоза, или 3-С- гидроксиметил-D-глицеро-тетроза);
6) высшие сахара с длиной цепи более шести атомов С (напр., D-седогеп-тулоза и сиаловые кислоты.
За исключением D-глюкозы и D-фруктозы свободные моносахариды встречаются в природе редко. Обычно они входят в состав разнообразных гликозидов, олиго - и полисахаридов и м. б. получены из них после кислотного гидролиза. Разработаны многочисленные методы химического синтеза редких моносахаридов исходя из более доступных.
Олигосахариды содержат в своем составе от 2 до 10-20 моносахаридных остатков, связанных гликозидными связями. Наиболее распространены дисахариды, выполняющие функцию запасных B-B: сахароза в растениях, трегалоза в насекомых и грибах, лактоза в молоке млекопитающих. Известны многочисленные гликозиды олигосахаридов, к которым относят различные физиологически активные вещества некоторые сапонины (в растениях), мн. антибиотики (в грибах и бактериях), гликолипиды.
Полисахариды - высокомолекулярные соединения линейные или разветвленные молекулы которых построены из остатков моносахаридов, связанных гликозидными связями. В состав полисахаридов могут входить также заместители неуглеводной природы. В свою очередь цепи высших олигосахаридов и полисахаридов могут присоединяться к полипептидным цепям с образованием гликопротеинов.
Особую группу составляют биополимеры, в молекулах которых остатки полиолов, гликозилполиолов, нуклеозидов или моно - и олигосахаридов соединены не гликозидными, а фосфодиэфирными связями. К этой группе относят тейхоевые кислоты бактерий, компоненты клеточных стенок некоторых дрожжей, а также нуклеиновые кислоты, в основе которых лежит поли-D-рибозофосфатная (РНК) или поли-2-дезок-си-D-рибозофосфатная (ДНК) цепь.
Физико-химические свойства. Обилие полярных функциональных групп в молекулах моносахаридов приводит к тому, что эти вещества легко растворимы в воде и не растворимы в малополярных органических растворителях. Способность к таутомерным превращениям обычно затрудняет кристаллизацию моно – и олигосахаридов, однако если такие превращения невозможны (напр., как в гликозидах и невосстанавливающих олигосахаридах типа сахарозы), то вещества кристаллизуются легко. Многие гликозиды с малополярными агликонами (сапонины) проявляют свойства ПАВ.
Полисахариды - гидрофильные полимеры, многие из них образуют высоковязкие водные растворы, а в ряде случаев прочные гели.
Некоторые полисахариды образуют высокоупорядоченные надмолекулярные структуры, препятствующие гидратации отдельных молекул; такие полисахариды (хитин, целлюлоза) не растворимы в воде.
Биологическая роль. Функции углеводов в живых организмах чрезвычайно многообразны. В растениях моносахариды являются первичными продуктами фотосинтеза и служат исходными соединениями для биосинтеза гликозидов и полисахаридов, а также др. классов B-B (аминокислот, жирных K-T, фенолов и др.). Эти превращения осуществляются ферментами, субстратами для которых служат, как правило, богатые энергией производные сахаров, главным образом нуклеозиддифосфат-сахара.
Углеводы запасаются в растениях (в виде крахмала), животных, бактериях и грибах (в виде гликогена), где служат энергетическим резервом. Источником энергии являются реакции расщепления глюкозы, образующейся из этих полисахаридов. В виде гликозидов в растениях и животных осуществляется транспорт различных метаболитов. Полисахариды и более сложные углеводсодержащие полимеры выполняют в живых организмах опорные функции. Жесткая клеточная стенка у высших растений представляет собой сложный комплекс из целлюлозы, гемицеллюлоз и пектинов. Армирующим полимером в клеточной стенке бактерий служат пептидогликаны (муреины), а в клеточной стенке грибов и наружных покровах членистоногих – хитин. В организме животных опорные функции выполняют протео-гликаны соединительные ткани. Эти вещества участвуют в обеспечении специфических физико-химических свойств таких тканей, как кости, хрящи, сухожилия, кожа. Будучи гидрофильными полианионами, эти полисахариды способствуют также поддержанию водного баланса и избирательной ионной проницаемости клеток.
Особенно ответственна роль сложных углеводы в образовании клеточных поверхностей и мембран и придании им специфических свойств. Так, гликолипиды - важнейшие компоненты мембран нервных клеток и оболочек эритроцитов, а липополисахариды - наружной оболочки грамотрицательных бактерий. Углеводы клеточной поверхности часто определяют специфичность иммунологических реакций (групповые вещества крови, бактериальные антигены) и взаимодействие клеток с вирусами. Углеводные структуры принимают участие и в других высокоспецифических явлениях клеточного взаимодействия таких, как оплодотворение, узнавание клеток при тканевой дифференциации, отторжение чужеродных тканей и т. д.
Углеводы составляют главную часть пищевого рациона человека, в связи с чем широко используются в пищевой и кондитерской промышленности (крахмал, сахароза и др.). Кроме того, в пищевой технологии применяют структурированные вещества полисахаридной природы, не имеющие сами по себе пищевой ценности,- гелеобразователи, загустители, стабилизаторы суспензий и эмульсий (альгинаты, пектины, растительные галактоманнаны и др.).
Превращения моносахаридов при спиртовом брожении лежат в основе процессов получения этанола, пивоварения, хлебопечения; др. виды брожения позволяют получать из сахаров биотехнологическими методами глицерин, молочную, лимонную, глюконовую кислоты и многие другие вещества.
Глюкозу, аскорбиновую кислоту, углеводсодержащие антибиотики, гепарин широко применяют в медицине. Целлюлоза служит основой для получения вискозного волокна, бумаги, некоторых пластмасс, BB и др. Сахарозу и растит, полисахариды рассматривают как перспективное возобновляемое сырье, способное в будущем заменить нефть.
2. Глюкоза
Бесцветные кристаллы или белый мелкокристаллический порошок без запаха, сладкого вкуса. Растворим в воде (1:15) трудно— в спирте.
Растворы стерилизуют при 100° в течение 60 минут Ели при 119—121° в течение 5—7 минут. Для стабилизации прибавляют 0,1 н. раствор соляной кислоты и натрия хлорид; рН растворов 3,0—4,0.
Для медицинских целей применяют изотонический (4,5—5%) и гипертонические (10—40%) растворы.
Изотонический раствор применяют для пополнения организма жидкостью, вместе с тем он является источником легко усвояемого организмом ценного питательного материала. При сгорании глюкозы в тканях выделяется значительное количество энергии, которая служит для осуществления функций организма.
При введении в вену гипертонических растворов повышается осмотическое давление крови, усиливается ток жидкости из тканей в кровь, повышаются процессы обмена веществ, улучшается антитоксическая функция печени, усиливается сократительная деятельность сердечной мышцы, расширяются сосуды, увеличивается диурез. Растворы глюкозы широко применяют в медицинской практике при гипогликемии, инфекционных заболеваниях, заболеваниях печени (при гепатитах, дистрофии и атрофии печени), при декомпенсации сердечной деятельности, отеке легких, при геморрагических диатезах, при токсикоинфекциях, различных интоксикациях (отравлениях наркотиками, синильной кислотой и ее солями, окисью углерода, анилином, мышьяковистым водородом, фосгеном и другими веществами) и при различных других патологических состояниях.
Растворы глюкозы широко используются при лечении шока и коллапса, являются важнейшими компонентами различных кровезамещающих и противошоковых жидкостей и применяются также для разведения сердечных средств (строфантина, эризимина и др.) при введении их в вену.
Изотонические растворы вводят под кожу (300—500 мл и более), в вену (капельно) и в клизмах (от 300—500 до 1000—2000 мл в сутки капельно). Гипертонические растворы вводят внутривенно по 20-40-50 мл на одно введение. При необходимости вводят капельным методом до 250- 300 мл в сутки. для более быстрого и полного усвоения глюкозы иногда вводят одновременно инсулин (по 4—5 ЕД под кожу). Часто глюкозу назначают одновременно с аскорбиновой кислотой. Растворы глюкозы с метиленовым синим применяют при отравлении синильной кислотой.
Формы выпуска: порошок; таблетки по 0,5 и 1 г; ампулы - по 10; 20; 25 и 50 ил 5%, 10%, 25% я 40% раствора; ампулы по 20 ял 25% раствора глюкозы с 1% раствором метиленового синего. Растворы выпускают также в герметически укупоренных флаконах.
Препарат, содержащий 40% раствор глюкозы с 5% раствором аскорбината магния, имеет название магния аскорбинат. Применяют при гипертонической болезни, сопровождающейся нарушениями мозгового кровообращения (в сочетании с гипотензивными средствами — резерпином, ганглиоблокаторами, дихлотиазидом и др.), при вегетативных неврозах, расстройствах сна и др. Вводят внутривенно (медленно) 1 раз в сутки по 10 ял; мл курс 15—20 инъекций.
2.1 Строение и изомерия
Глюкоза является альдегидоспиртом, так как атомы углерода связаны между собой сигма-связью, возможно вращение частей молекулы относительно сигма-связей. При этом альдегидная функциональная группа взаимодействует со спиртовым гидроксилом пятого углеродного атома, и образуется циклическая форма глюкозы:
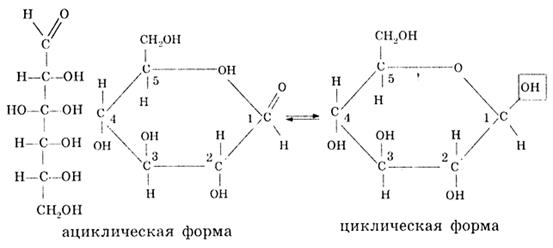
В растворе ациклическая (альдегидная) форма глюкозы находится в равновесии с циклической (полуацетальной) формой. При переходе ациклической формы в циклическую полуацетальную форму у первого углеродного атома формируется полуацетальная — гликозидная гидроксигруппа. По своим свойствам эта группа отличается от спиртовой. В циклической глюкозе, которая имеет строение кресла или лодки, полуацетальный гидроксил жестко расположен в пространстве относительно плоскости.
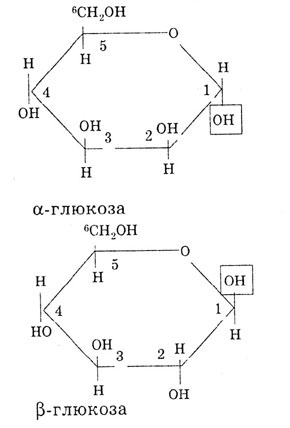
Если полуацетальный гидроксил и группа «ОН» у шестого углеродного атома находятся по разные стороны плоскости, то такой изомер называется α-глюкозой, если по одну сторону, то β-глюкозой:
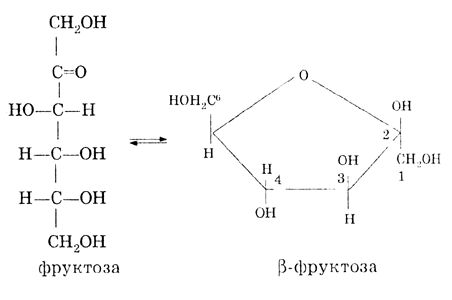
Изомером глюкозы является фруктоза. Фруктоза - это кетоноспирт. В растворе она также находится в равновесии с циклической (полуацетальной) формой:
Так как глюкоза является альдегидоспиртом, то для нее характерны свойства альдегидов и свойства многоатомных спиртов.
Реакция с аммиачным раствором серебра (образование «серебряного зеркала») Эта реакция рекомендуется для подтверждения подлинности препаратов с альдегидной группой в молекуле:
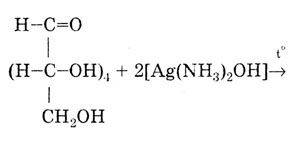
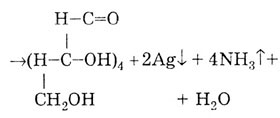
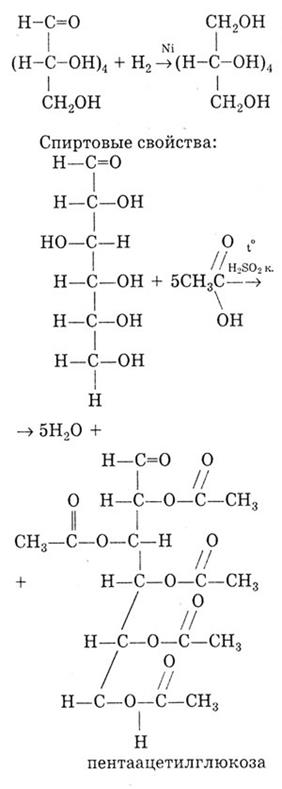
Гидрирование глюкозы, в результате которого образуется шестиатомный спирт - сорбит:
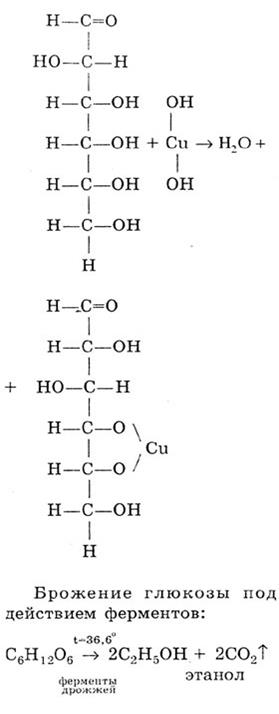
Качественная реакция, доказывающая, что глюкоза является многоатомным спиртом - происходит растворение свежеосажденного Сu(ОН)2 и образование ярко-синего раствора:
2.2 Показатели преломления и факторы показателей преломления растворов
Для окончательного подсчета концентрации растворов глюкозы, предназначенных для внутривенного введения, к сумме процента глюкозы добавляют еще 10% (учитываю влагу).
Заключение
Здоровье людей- один из основных факторов прочности государства и семьи, ускорения научно технического процесса, бесценный дар природы. Не последнюю роль в здоровье человека играет наука «Фармацевтическая химия». Изучение всех свойств лекарственных препаратов и характера действия их на организм поможет нам избавиться от многих заболеваний.
|
1. Г.А. Мелентьева, Л.А. Антонова «Фармацевтическая химия». – Москва – 1985 г.
2. В.Г. Жиряков «Органическая химия». – Москва – 1986 г.
3. В.Г. Белихов «Фармацевтическая химия». – Москва: Медпресс Инфо, 2007 г.
4. В.В. Закусов. Фармакология,2 изд., М., 1966;
5. М.Д. Машковский. Лекарственные средства, 7 изд., ч. 1, М., 1972.
8-09-2015, 19:33
