Оглавление
Оглавление............................................................................. 1
Введение................................................................................. 2
Раздел 1. Немного истории................................................. 3
1.1. Описание элемента.................................................................. 3
1.2. Открытие Йода........................................................................... 4
1.3. Интересные факты................................................................... 5
Раздел 2. Свойства Йода...................................................... 6
2.1. Физические свойства Йода...................................................... 6
2.2. Электронно-графическая формула Йода............................. 7
2.3. Химические свойства Йода..................................................... 8
2.4. Получение Йода...................................................................... 10
Раздел 3. Распространение Йода..................................... 11
3.1. Распространение в природе................................................. 11
3.2. Йод в живом организме.......................................................... 12
3.3. Йод и человек........................................................................... 13
3.4. Гормоны щитовидной железы.............................................. 14
Раздел 4. Применение Йода............................................... 16
4.1. Болезни, связанные с недостатком Йода.......................... 16
4.2. Восполнение Йода в организме........................................... 18
4.3. Йод в промышленности......................................................... 19
4.4. Йод в медицине....................................................................... 21
4.5. Препараты Йода...................................................................... 22
4.6. Йод радиоактивный................................................................ 24
4.7. Синий йод................................................................................. 25
4.8. Препараты Синего Йода........................................................ 27
Выводы................................................................................. 31
Список использованной литературы............................... 32
Введение
Йод знают все. Порезав палец, мы тянемся к склянке с Йодом, точнее с его спиртовым раствором. Но не все знают насколько важно содержание Йода в нашем организме. Йод является очень сильным антисептическим препаратом. Однако Йод служит не только для смазывания ссадин и царапин. Хотя Йода в человеческом организме всего 25 мг, он играет важную роль. Большая часть «человеческого Йода» находится в щитовидной железе: он входит в состав вещества, которое регулирует обмен веществ в организме. При недостатке Йода задерживается физическое и умственное развитие и возникает болезнь, называющаяся эндемический зоб. Это случается в высокогорных районах, где естественное содержание Йода в воздухе, воде и пище очень низкое.
Раздел 1. Немного истории.
1.1. Описание элемента.

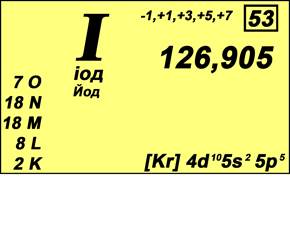 Йод – химический элемент VII группы периодической системы Менделеева. Атомный номер - 53. Относительная атомная масса 126,9045 (рис. 1). Галоген. Из имеющихся в природе галогенов – самый тяжёлый, если, конечно, не считать радиоактивный короткоживущий астат. Практически весь природный Йод состоит из атомов одного – единственного изотопа с массовым числом I
127
, его содержание в земной коре 4 * 10-5
% по массе. Радиоактивный Йод I
125
образуется в ходе естественных радиоактивных превращений. Из искусственных изотопов Йода важнейшие – Йод I
131
и Йод I
133
. их в основном используют в медицине.
Йод – химический элемент VII группы периодической системы Менделеева. Атомный номер - 53. Относительная атомная масса 126,9045 (рис. 1). Галоген. Из имеющихся в природе галогенов – самый тяжёлый, если, конечно, не считать радиоактивный короткоживущий астат. Практически весь природный Йод состоит из атомов одного – единственного изотопа с массовым числом I
127
, его содержание в земной коре 4 * 10-5
% по массе. Радиоактивный Йод I
125
образуется в ходе естественных радиоактивных превращений. Из искусственных изотопов Йода важнейшие – Йод I
131
и Йод I
133
. их в основном используют в медицине.

 I2
– галоген. Темно-серые кристаллы с металлическим блеском. Летуч. Плохо растворяется в воде, хорошо – в органических растворителях (с фиолетовым или коричневым окрашиванием раствора) или в воде с добавкой солей – Йодидов. Слабый окислитель и восстановитель. Реагирует с концентрированными серной и азотной кислотами, металлами, неметаллами, щелочами, сероводородом. Образует соединения с другими галогенами.
I2
– галоген. Темно-серые кристаллы с металлическим блеском. Летуч. Плохо растворяется в воде, хорошо – в органических растворителях (с фиолетовым или коричневым окрашиванием раствора) или в воде с добавкой солей – Йодидов. Слабый окислитель и восстановитель. Реагирует с концентрированными серной и азотной кислотами, металлами, неметаллами, щелочами, сероводородом. Образует соединения с другими галогенами.
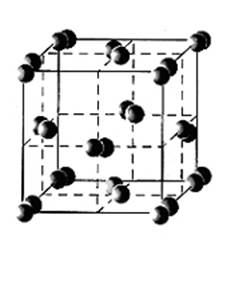
Молекула элементного Йода, как и прочих галогенов, состоит из двух атомов. Йод – единственный из галогенов – находится в твёрдом состоянии при нормальных условиях. Красивые тёмно – синие кристаллы Йода больше всего похожи на графит. Отчётливо выраженное кристаллическое строение (рис. 2), способность проводить электрический ток – все эти «металлические» свойства характерны для чистого Йода.
1.2. Открытие Йода.
Конец XVII и начало XVIII века были отмечены в Европе непрекращающимися войнами. Требовалось много пороха и, следовательно, много селитры. Производство селитры приняло невиданные масштабы, наряду с обыкновенным растительным сырьём в дело шли и морские водоросли. В них и обнаружили новый химический элемент.
Одним из французских селитроваров был химик и промышленник Бернар Куртуа (1777–1838), он был весьма наблюдательным человеком. Считается, что именно это помогло ему в 1811 г. стать первооткрывателем нового химического элемента Йода. Однажды он заметил, что медный котёл, в котором выпаривался щелок, полученный из фукуса, ламинарий и других бурых водорослей, быстро разрушается, как будто его разъедает какая – то кислота. Куртуа решил выяснить, в чём тут дело. Осадив и удалив из раствора соли натрия, он выпарил раствор, обнаружил в котле сульфид калия и чтобы разложить его, прилил к осадку концентрированной серной кислоты – и тут появился фиолетовый дым. Куртуа повторил опыт, на этот раз в реторте, и в приёмнике реторты осели блестящие чёрные пластинчатые кристаллы.
Йодид натрия из водорослей, взаимодействуя с серной кислотой, выделяет Йод I2 ; одновременно образуется сернистый газ – диоксид серы SO2 и воду:
2NaI + 2H2 SO4 = I2 + SO2 + Na2 SO4 + 2H2 O
При охлаждении пары Йода превращались в темно-серые кристаллы с ярким блеском. Куртуа писал: «В маточном растворе щелока, полученного из водорослей, содержится довольно большое количество необычного вещества. Его легко выделить: для этого достаточно прилить серную кислоту к данному раствору и нагреть смесь в реторте... Новое вещество осаждается в приемнике в виде черного порошка, который при нагревании превращается в пары великолепного фиолетового цвета».
Название новому элементу присвоил в 1813 году французский химик Жозеф-Луи Гей-Люссак (1778–1850) за фиолетовый цвет его паров («Йодос» по-гречески значит «фиолетовый»). Он же получил многие производные нового элемента – Йодоводород HI , Йодноватую кислоту HIO3 , оксид Йода(V) I2 O5 , хлорид Йода ICl и другие. Практически одновременно элементарную природу Йода доказал и английский химик Гэмфри Дэви (1778–1829).
1.3. Интересные факты.
1. содержание Йода в крови человека зависит от времени года: с сентября по январь концентрация Йода в крови снижается, с февраля начинается новый подъём, а в мае–июне Йодное зеркало достигает наивысшего уровня. Эти колебания имеют небольшую амплитуду, и их до сих пор остаются загадкой;
2. из пищевых продуктов много Йода содержат яйца, молоко, рыба; очень много Йода в морской капусте, которая поступает в продаже в виде консервов, драже и других продуктов;
3. первый в России Йодный завод был построен в 1915 г. В Екатеринославле (ныне Днепропетровск); получали Йод из золы черноморской водоросли филлофоры; за годы первой мировой войны на этом заводе было добыто 200 кг Йода;
4. если грозовое облако «засеять» Йодистым серебром или Йодистым свинцом, то вместо града в облаке образуется снежная крупа: засеянное такими солями облако проливает дождём и не вредит полям.
Раздел 2. Свойства Йода.
2.1. Физические свойства Йода.
Плотность Йода 4,94 г/см3, tпл 113,5 °С, tкип 184,35 °С. Молекула жидкого и газообразного Йода состоит из двух атомов (I2 ). Заметная диссоциация I2 2I наблюдается выше 700 °С, а также при действии света. Уже при обычной температуре Йод испаряется, образуя резко пахнущий фиолетовый пар. При слабом нагревании Йод возгоняется, оседая в виде блестящих тонких пластинок; этот процесс служит для очистки Йода в лабораториях и в промышленности. Йод плохо растворим в воде (0,33 г/л при 25 °С), хорошо - в сероуглероде и органических растворителях (бензоле, спирте), а также в водных растворах Йодидов.
2.2. Электронно-графическая формула Йода.
Конфигурация внешних электронов атома Йода 5s2 5p5. В соответствии с этим проявляет в соединениях переменную валентность (степень окисления): -1 (в HI , KI ) (рис. 3); +1 (в HIO , KIO ) (рис. 3); +3 (в IСl3 ) (рис. 4); +5 (в НIO3 , КIO3 ) (рис. 5); и +7 (в HIO4 , KIO4 ) (рис. 6).
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
 |
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
 |
||
 |
||
![]()
![]()
![]()
![]()
![]()
![]()
|
|
|
 |
|||
 |
|||
![]()
![]()
![]()
![]()
![]()
|
|
|
 |
 |
2.3. Химические свойства Йода.
Химически Йод довольно активен, хотя и в меньшей степени, чем хлор и бром. С металлами Йод при легком нагревании энергично взаимодействует, образуя Йодиды.
Hg + I2 = HgI2
С водородом Йод реагирует только при нагревании и не полностью, образуя йодистый водород.
I2 + H2 = 2НI
Элементный Йод - окислитель, менее сильный, чем хлор и бром. Сероводород H2 S , тиосульфат натрия Na2 S2 O3 и другие восстановители восстанавливают его до I - .
I2 + H2 S = S + 2НI
Хлор и другие сильные окислители в водных растворах переводят его в IO3 - .
При растворении в воде Йода частично реагирует с ней;
I 2 + H 2 O = HI + HIO
В горячих водных растворах щелочей образуются Йодид и Йодат.
I2 + 2KOH = KI + KIO + H2 O
3KIO = 2KI + KIO3
При нагревании йод взаимодействует с фосфором:
3I2 + 2 P = 2 PI 3
А йодид фосфора в свою очередь взаимодействует с водой:
2PI3 + H2 O = 3HI + H2 (PHO3 )
При взаимодействии H 2 SO 4 и KI образуется продукт, окрашенный темно-бурый цвет, и сульфатная кислота восстанавливается до H 2 S
8KI + 9H2 SO4 = 4I2 + 8KHSO4 + SO2 + H2 O
Йод легко реагирует с алюминием, причем катализатором в этой реакции является вода:
3I2 + 2 AL = 2 ALI 3
Йод может также окислять сернистую кислоту и сероводород:
H2 SO3 + I2 + H2 O = H2 SO4 + HI
H2 S + I2 = 2HI + S
Йод взаимодействует с нитратной кислотой:
I 2 + 10 HNO 3 = 2 HIO 3 + 10 NO 2 + 4 H 2 O
При соединении кислоты с щелочью образуется соль:
HIO 3 + KOH = KIO 3 + H 2 O
При окислении йодид-иона йодат-ионом в кислой среде образуется свободный йод:
5KI + KIO3 + 3H2 SO4 = 3I2 + 3K2 SO4 + 3H2 O
При нагревании йодатной кислоты она распадается, с образованием наиболее стойкого оксида галогенов:
2 HIO 3 = I 2 O 5 + H 2 O
Оксид йода (V) проявляет окислительные свойства. Его используют при анализе CO:
5 CO + I 2 O 5 = I 2 + 5 CO 2
Перйодатная кислота H 5 IO 6 - пятиосновная. Ее получают следующим образом:
5 Ba ( IO 3 )2 --- t --► Ba 5 ( IO 6 )2 + 4 I 2 + 9 O 2
Ba 5 ( IO 6 )2 + 5 H 2 SO 4 = 5 BaSO 4 ↓ + 2 H 5 IO 6
Это средняя по силе кислота. Может образовывать соли в орто-форме (Ag 5 IO 6 ) и в мета-форме (NaIO 4 ). Перйодатная кислота и ее соли используют в органической и аналитической химии как сильные окислители.
Йод хорошо взаимодействует с серноватистокислым натрием (тиосульфатом):
2 Na 2 S 2 O 3 + I2 = Na 2 S 4 O 6 + 2 NaI
Это его свойство используется в аналитической химии.
Адсорбируясь на крахмале, Йод окрашивает его в темно-синий цвет; это используется в Йодометрии и качественном анализе для обнаружения Йода.
Пары Йода ядовиты и раздражают слизистые оболочки. На кожу Йод оказывает прижигающее и обеззараживающее действие. Пятна от Йода смывают растворами соды или тиосульфата натрия.
2.4. Получение Йода.
Сырьем для промышленного получения Йода в России служат нефтяные буровые воды (рис. 7); за рубежом – морские водоросли, а также маточные растворы чилийской (натриевой) селитры, содержащие до 0,4% Йода в виде Йодата натрия. Для извлечения Йода из нефтяных вод (содержащих обычно 20 – 40 мг/л Йода в виде Йодидов) на них сначала действуют хлором или азотистой кислотой. Выделившийся Йод либо адсорбируют активным углем, либо выдувают воздухом. На Йод, адсорбированный углем, действуют едкой щелочью или сульфитом натрия. Из продуктов реакции свободный Йод выделяют действием хлора или серной кислоты и окислителя, например дихромата калия. При выдувании воздухом Йод поглощают смесью двуокиси серы с водяным паром и затем вытесняют Йод хлором. Сырой кристаллический Йод очищают возгонкой.
![]()
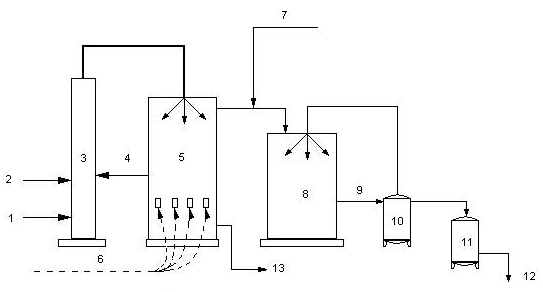
1) буровая вода;
2) кислота;
3) башня подкисления и окисления (хлоратор);
4) хлор;
5) башня отдувки элементного Йода (десорбер);
6) воздух;
7) сернистый газ;
8) уловитель (адсорбер);
9) Йодоватистая и серная кислоты (сорбент);
10) сборник сорбента;
11) кристаллизатор (здесь Йод выделяется из сорбента);
12) Йод – сырец;
13) безЙодная буровая вода;
Раздел 3. Распространение Йода.
3.1. Распространение в природе.
Среднее содержание Йода в земной коре 4*10- 5 % по массе. В мантии и магмах и в образовавшихся из них породах (гранитах, базальтах) соединения Йода рассеяны; глубинные минералы Йода неизвестны. История Йода в земной коре тесно связана с живым веществом и биогенной миграцией. В биосфере наблюдаются процессы его концентрации, особенно морскими организмами (водорослями, губками). Известны 8 гипергенных минералов Йода, образующихся в биосфере, однако они очень редки. Основным резервуаром Йода для биосферы служит Мировой океан (в 1 литре в среднем содержится 5*10-5 грамм Йода). Из океана соединения Йода, растворенные в каплях морской воды, попадают в атмосферу и переносятся ветрами на континенты. Местности, удаленные от океана или отгороженные от морских ветров горами, обеднены Йодом. Йод легко адсорбируется1 органическими веществами почв и морских илов. При уплотнении этих илов и образовании осадочных горных пород происходит десорбция, часть соединений Йода переходит в подземные воды. Так образуются используемые для добычи Йода Йодо-бромные воды, особенно характерные для районов нефтяных месторождений (местами 1 литр этих вод содержит свыше 100 мг Йода).
3.2. Йод в живом организме.
Йод – необходимый для животных и человека микроэлемент. В почвах и растениях таёжно-лесной нечерноземной, сухостепной, пустынной и горных биогеохимических зон. Йод содержится в недостаточном количестве или не сбалансирован с некоторыми другими микроэлементами (Са
, Mn
, Cu
); с этим связано распространение в этих зонах эндемического зоба. Среднее содержание Йода в почвах около 3*10-4
%, в
8-09-2015, 19:36
