Курсовая работа
на тему:
"Культивирование, идентификация и очистка герпесвирусов"
Введение
В группу герпесвирусов входят, вероятно, более 70 вирусов, имеющих широкий круг хозяев. Характеристика и классификация вирусов этой труппы детально рассмотрены Мэтьюсом. Герпесвирусы подразделяют на три подсемейства: α-герпесвирусы; β-герпесвирусы; γ-герпесвирусы. Разделение на подсемейства основано на нескольких критериях, в частности на характере репликации вирусов, круге хозяев, белковом составе и структуре генома.
В этой работе мы обсудим культивирование, очистку и титрование герпесвирусов, взяв в качестве примера по одному представителю каждого из подсемейств, указанных выше. Особое внимание, однако, будет уделено вирусам простого герпеса – наиболее интенсивно изучаемым вирусам этой группы. Будут рассмотрены цитометаловирус человека и герпесвирус саймири.
1. Вирусы простого герпеса типов 1 и 2
Эти два вируса входят в а-подгруппу герпесвирусов. Они вызывают разнообразные заболевания человека, такие, как воспаление десен, стоматит, менингит, энцефалит и венерическую форму воспаления гениталий. Эти вирусы вызывают заболевания в ослабленных организмах. Некоторые факты указывают на связь вируса простого герпеса типа 2 с раком шейки матки, а вируса простого герпеса типа 1 с некоторыми другими злокачественными новообразованиями. Именно поэтому данным герпесвирусам, в особенности последние 10 лет, уделяют пристальное внимание. За последнее время были разработаны высокоэффективные методы наращивания, очистки и титрования этих вирусов. Методы изучения ВПГ-1 – и ВПГ-2 сходны между собой.
1.1 Получение заготовок вируса
1.1.1 Клетки
Широкий круг хозяев ВПГ-1 и ВПГ-2 позволяет получать заготовки вирусов на различных клетках. Тем не менее, выбор чувствительной культуры не прост из-за того, что выход вирусов в различных клеточных линиях широко варьирует. На практике для получения заготовок вируса часто используют клетки линии Нер-2 или ВПК с КЗ. Работы, проведенные с ВПГ-1 и ВПГ-2 в нашей лаборатории, показывают, что выход различных штаммов отличается примерно в 10 раз для данных клеточных линий. Хотя из этих двух линий клетки ВНК менее требовательны к условиям культивирования, клетки обеих линий достигают высокой плотности в роллерных сосудах как из стекла Winchester, так и из пластика. В сосудах такого большого объема особенно важно поддерживать оптимальный рН. При использовании бикарбонатного буфера культуральную среду необходимо насыщать С02 еще до стерилизации. В противном случае клетки следует выращивать в атмосфере с высоким содержанием С02 . Аппаратуру для одновременного культивирования большого количества роллерных сосудов можно купить или изготовить в мастерских. Например, на рис. l'O.l сфотографирован аппарат, изготовленный из рамы Dexion, колес Meccano и моторов Parvalux в тропическом исполнении.
Клетки указанных выше линий способны расти в различных питательных средах. Обычно мы используем автоклавируемую среду Игла в модификации Глазго с 10% ТС. Для клеток линии ВНК в среду следует добавить 10% триптозофосфатного бульона. Окончательный выбор клеточной линии зависит от ряда факторов, в частности от характера эксперимента. Естественно, что используемые для приготовления вирусных заготовок клеточные линии должны быть предварительно проверены на отсутствие микоплазмы.
1.1.2 Методы заражения
Основной метод заражения описан Ватсоном и др. Целесообразно перед началом работы получить первичную и вторичную заготовки вируса, которые по возможности следует разместить в нескольких холодильниках на –70°С. Как правило, рабочие заготовки получают из вторичных и таким образом исключают длительное пассирование вируса. При этом сводится к минимуму возможность получения вирусных заготовок, сильно отличающихся по номеру пассажа, что создает трудности в прямом сравнении данных, полученных в разных экспериментах. В большинстве случаев для получения вирусных заготовок мы используем роллерные культуры, почти достигшие монослоя. Во флаконах обычно содержится 5–108 клеток ВНК или 3-108 клеток Нер-2. Высокая концентрация клеток позволяет получить и высокий титр вирусной заготовки. Клеточный монослой промывают для удаления слабо прикрепленных клеток и затем из вторичной заготовки вносят разведенный вирус. Чаще всего мы предпочитаем заражать клетки при множественности инфекции 0,001–0,01 БОЕ/кл, что предотвращает накопление дефектных вирионов.

1.1.3 Наращивание вируса
Любая стандартная среда для культивирования клеток может быть использована для получения вирусных заготовок. Обычно для выращивания клеток мы используем среду с 10% ТС. Уменьшение концентрации сыворотки приводит к некоторому снижению выхода вируса, однако при этом экономится дорогостоящая сыворотка. Заготовки вируса получают, используя следующую методику:
1. Вирус адсорбируют 1 ч в небольшом объеме среды, достаточном для покрытия монослоя. Множественность инфекции при этом составляет 0,001–0,01 БОЕ/кл.
2. Добавляют необходимое количество среды для культивирования клеток.
3. Клетки инкубируют 2–3 дня при соответствующей температуре. Однако продолжительное наращивание вируса при низкой температуре может привести к получению материала, содержащего большой процент температур-но-чувствительных мутантов или по крайней мере вируса, лучше растущего при 32°С, чем при 37°С. По этой причине мы предпочитаем инкубацию при 37°С.
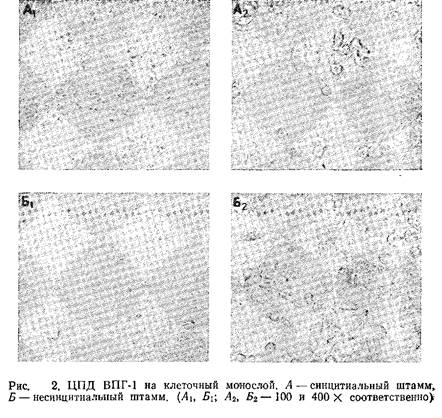
4. Через 2 дня инкубации при 37°С начинают появляться признаки ЦПД, однако сроки их появления могут варьировать в зависимости от штамма вируса и линии клеток. Как правило, ВПГ-2 размножается заметно быстрее, чем ВПГ-1. Как известно, существует два вида ЦПД: синцитиальное и несинцитиальное. Морфологическая картина ЦПД, вызванного этими двумя штаммами, показана на рис. 2.
5. Клетки собирают после максимального проявления признаков ЦПД. Методика сбора клеток зависит от штамма вируса и линии клеток. Так, в случае штамма HFEM и клеток линии ВНК основную массу среды можно удалить из культурального сосуда без потери вируса. Затем клетки собирают в оставшуюся среду стерильной резиновой палочкой и центрифугируют при малой скорости. При работе с другими штаммами вируса, например штаммом 186, инфицированные клетки удается собрать только центрифугированием культуральной среды, поскольку большая часть клеток отрывается от поверхности сосуда. Если лизис клеток уже произошел, необходимо использовать среду как составную часть заготовки вируса. Клетки собирают центрифугированием, а затем ресуспендируют в выбранной среде, например стерильной дистиллированной воде или же обычной культуральной среде. Заготовки можно ресуспендировать в среде с криопротектором, хотя это и не является строго обязательным.
6. Одной из серьезных проблем, возникающих по мере получения заготовок вирусов герпеса, является их очистка от клеточного материала, поскольку большая часть вируса тесно связана с клетками. Клетки разрушают, проводя ряд циклов замораживания и оттаивания, однако это может привести и к снижению титра вируса. Обработка клеток ультразвуком небезопасна из-за возможного образования аэрозолей, содержащих инфекционный вирус. Поэтому лучше всего проводить дезинтеграцию в ультразвуковой бане в закрытом сосуде. К сожалению, мы не можем рекомендовать какую-либо определенную марку ультразвукового дезинтегратора. Необходимо проверять эффективность каждого из них. Вирусные заготовки обрабатывают ультразвуком до полного разрушения клеток. Процедуру проводят в ледяной воде, чтобы не допустить сильного нагревания.
7. Клеточный дебрис удаляют центрифугированием, готовые заготовки разливают в ампулы и хранят, как описано ниже. Заготовки вируса герпеса длительное время лучше всего хранить при –70°С. Ни при каких обстоятельствах не следует хранить вирусы герпеса при –20°С, поскольку это приводит к значительному снижению инфекционного титра. В течение нескольких дней штамм HFEM можно хранить при 4°С, однако этот срок варьирует для разных штаммов. Оттаивание вируса необходимо проводить быстро, по возможности следует избегать повторного замораживания и оттаивания. Тем не менее, мы показали, что штамм HFEM, имеющий высокий титр в культуральной среде, теряет всего лишь 0,51og инфекционного титра при пятикратном замораживании и оттаивании. Мы обнаружили, что и при быстром оттаивании вирусных заготовок, хранящихся при –70°С даже в течение 5 лет, не происходит снижения титра вируса. Перед использованием каждую заготовку необходимо проверить на стерильность как на твердой, так и в обогащенной жидкой бактериальных средах. Лучше всего проверять заготовки под электронным микроскопом, чтобы исключить использование тех заготовок, в которых велико соотношение физических и инфекционных частиц. Мы установили, что с помощью описанных выше методов удается получать заготовки с титрами около 109 –1010 БОЕ/мл и низкими соотношениями физических и инфекционных частиц.
1.2 Электронная микроскопия
Подсчет частиц по методу "1 оор drop" предложен Ватсоном. Вирус разводят в воде или в растворе, содержащем 0,2 мг ВСА/мл в случае вирусных препаратов с концентрацией белка ниже 0,2 мг/мл, В любом случае вирус разводят до концентрации 109 –1010 частиц/мл. Суспензию смешивают с равным объемом калибровочного материала. Мы рекомендуем использовать полистироловый латекс "DOW", содержащий -109 латексных частиц/мл. К полученной смеси добавляют 0,12 мл нейтрального 2%-ного раствора фосфовольфрамата натрия. Одну каплю полученного материала наносят, а затем высушивают на формваровых сетках с ячейками размером: 400 меш. Сетки просматривают под электронным микроскопом при увеличении 40 000. Частицы, видимые под микроскопом, классифицируют как "голые", "покрытые оболочкой" и "покрытые оболочкой". Эти частицы представлены на рис. 5. Непроницаемые, покрытые оболочкой частицы выглядят как плотные белые шарики, однако можно показать их способность количественно превращаться в проницаемые, покрытые оболочкой частицы. Как правило, для характеристики каждого образца вируса просчитывают пять групп из 20 латексных частиц.
1.3 Определение инфекционного титра
Вирусы простого герпеса относительно легко титруются различными методами. Мы обычно используем суспензионный метод либо метод монослойных культур.
1.3.1 Титрование в суспензионной культуре
1. Готовят разведения вируса на культуральной среде. К2 мл каждого разведения добавляют 8-106 клеток ВНК.
2. Суспензию при постоянном перемешивании инкубируют 30 мин при 37°С. Затем добавляют 8 мл 2%-ной КМЦ в культуральной среде и перемешивают с вирусом и клетками. Для данного метода содержание ТС в среде может составлять не более 5%.
3. Приготовленные суспензии разливают на две чашки Петри диаметром 60 мм и инкубируют 2–3 дня при 37°С в атмосфере 5%-ного С02 .
4. Монослой клеток фиксируют при помощи обычных фиксаторов и окрашивают генциан-виолетом или метиленовым сидим.
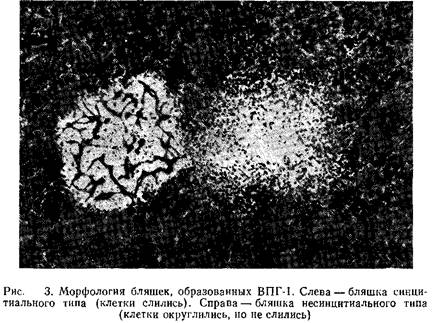
Вирусные бляшки можно обнаружить и невооруженным глазом, однако для их подсчета следует воспользоваться стереомикроскопом. Бляшки вирусов простого герпеса различаются по морфологии. Некоторые штаммы вызывают слияние клеток, что приводит к образованию больших синцитиальных бляшек, в то время как другие штаммы вызывают округление клеток. На рис. 3 для сравнения показана морфология описанных выше бляшек. Однако во многих случаях продолжительная инкубация клеток с вирусом, вызывающим образование синцитиев, приводит к изменению картины ЦПД. Бляшки при этом приобретают несинцитиальный характер.
1.3.2 Титрование на монослойной культуре
При использовании данного метода особенно важен выбор соответствующей клеточной линии. Как правило, инфицирование монослоя клеток ВНК приводит к образованию мелких бляшек. Кроме того, частота их возникновения, как свидетельствует наш опыт, также небольшая. При титровании вируса на монослойных культурах мы обычно используем клетки Vero, на которых эффективность бляшкообразования такая же, а для некоторых штаммов даже выше, чем на ВНК, находящихся в суспензии.
1. Клетки Vero рассевают в количестве 2–106 клеток на чашку за 18–24 ч до заражения.
2. Из чашек отсасывают среду и клетки инфицируют 0,1 мл соответствующего разведения вируса. Для адсорбции вируса чашки инкубируют 1 ч при 37°С.
3. В каждую чашку добавляют по 5 мл 2%-ной КМЦ, приготовленной на культуральной среде, и культуры инкубируют при 37°С. Время инкубации сильно варьирует в зависимости от штамма вируса. Быстрорастущий ВПГ-2 формирует хорошо различимые бляшки всего за 2 дня, в случае других вирусов требуется 4 дня.
4. Клетки фиксируют и окрашивают, как описано выше.
1.3.3 Среды для титрования
Существует множество разнообразных сред, используемых при титровании суспензионных и монослойных культур. Тем не менее мы предпочитаем среду, содержащую КМЦ, поскольку она удобна в работе и не ограничивает рост бляшек. Однако во время культивирования чашки должны находиться на ровной поверхности, и работать с ними следует осторожно, поскольку любое повреждение слоя КМЦ может привести к искажению картины бляшек.
1.3.4 Метод "оспин"
ВПГ-1 и ВПГ-2 формируют "оспины" на хорионаллантоисной мембране куриных эмбрионов. Существует предположение, что с помощью этого метода можно различить ВПГ-1 и ВПГ-2.
1.4 Приготовление экстрактов клеток, инфицированных вирусом
Тотальные гомогенаты клеток, инфицированных вирусом, или детергентные экстракты таких клеток обычно используются в качестве антигенов в различных иммунологических реакциях, таких, как ELISA и RIA. Кроме того, их применяют для иммунизации при получении гипериммунных антисывороток или моноклональных антител к белкам ВПГ. Поэтому выбор инфицируемой клеточной линии зависит от дальнейшего использования антигена.
1. Для радиоиммунологических методов используют клетки Vero или ВНК, которые заражают при множественности инфекции 10 БОЕ/мл.
2. Клетки вместе с культуральной средой собирают через 18–24 ч после заражения и центрифугируют при малой скорости.
3. Клеточный осадок дважды промывают PBS, а затем ресуспендируют в дистиллированной воде таким образом, чтобы концентрация клеток по возможности составляла 1-108 кл/мл.
4. Суспензию инфицированных клеток разрушают в ультразвуковой бане и хранят при –70°С. На рис. 6 показаны полипептиды, присутствующие в такой фракции.
Для некоторых методов, например иммунопреципитации, требуется фракция растворимого антигена. Такую фракцию получают центрифугированием суспензии разрушенных инфицированных клеток. С целью увеличения количества мембранных белков в этой фракции можно использовать детергенты. Свойства полученного антигена необходимо проверить при помощи ELISA или диффузией в геле по методу Оухтерлони, используя кроличью гипериммунную сыворотку к зараженным вирусом герпеса клеткам. Антиген для иммунизации получают, как описано выше, однако выбору клеток уделяют особое внимание. Например, для иммунизации животных с целью получения моноклональных антител используют антиген, выделенный из инфицированных L-клеток мыши, в то время как для получения кроличьих сывороток – антиген, выделенный из инфицированных клеток почки кролика RK13, растущих в присутствии 5% кроличьей сыворотки.
1.5 Получение очищенного вируса
Методы выделения вирусов простого герпеса довольно сложны по сравнению с другими вирусами. Более того, метод, хорошо зарекомендовавший себя при работе с одним штаммом вируса на определенной клеточной линии, может оказаться неприемлемым для других штаммов на той же линии или того же штамма вируса на других клетках. Поэтому мы опишем два метода. Мы показали, что первый метод можно успешно применять для получения штамма HFEM и некоторых других при условии, что для выращивания вируса используют клетки Нер-2. Данный метод прост и позволяет получать вирусные препараты высокой степени чистоты. Второй метод позволяет достигнуть удовлетворительных результатов со всеми штаммами вируса и различными типами клеток. Для выбора оптимальных условий получения высокого выхода вируса и качественного исходного материала для дальнейшей очистки следует вначале изучить кривую роста исследуемого вирусного штамма на различных линиях клеток. На рис. 4 показана кривая роста штамма HFEM на клетках Нер-2 при высокой множественности инфекции и культивировании клеток при 32°С.
1.5.1 Метод 1
1. Культуры Нер-2 в состоянии монослоя заражают при множественности инфекции 20–25 БОЕ/кл.
2. После адсорбции вируса зараженные клетки промывают, добавляют свежую среду и культивируют 2–3 дня при 32°С.
3. При необходимости радиоактивного мечения вирусоспецифических белков в культуральную среду вносят изотопы через 4 ч после начала культивирования.
4. По окончании культивирования культуральную среду центрифугируют при низкой скорости для удаления клеточного дебриса.
5. Вирус осаждают ПЭГ в присутствии 0,5 М NaCl или центрифугированием в роторе GSA в центрифуге SorvallRCS-5B.
6. Вирус ресуспендируют в трис-буфере низкой молярности, рН 7,8, содержащем 50 мМ NaCl. Полученную суспензию по возможности лучше оставить на ночь.

7. Вирусную суспензию наслаивают на 30 мл 5–45%-ного градиента сахарозы в указанном выше буфере и центрифугируют 1 ч при 12500 об/мин. После центрифугирования в центре градиента четко видна рыхлая белая полоса очищенного вируса. Эта видимая невооруженным глазом полоса и есть единственная в градиенте фракция инфекционного вируса.
Полученный вирус уже достаточно очищен, и его можно использовать в различных целях, в частности для выделения вирусной ДНК. Из фракции вирус легко осадить обычным центрифугированием. Для получения вирусных препаратов высокой степени чистоты может быть использован ряд других методов, включая повторное центрифугирование в градиенте сахарозы или CsCl. Эти методы позволяют получать препараты вируса, в которых отношение белка к числу частиц составляет менее чем 20 мкг на 1010 частиц.
1.5.2 Метод 2
Данный метод был разработан Спир и Ройзманом и Хейном и др.
1. Заражение клеток проводят по методу 1.
2. Клетки инкубируют 18–24 ч при 37°С, затем их снимают с подложки и центрифугируют при малой скорости.
3. Полученный таким образом клеточный осадок ресуспен-дируют в стандартном буфере для ретикулоцитов и в течение 10 мин дают клеткам набухнуть. Цитоплазматическую фракцию клеток получают в гомогенизаторе Даунса.
4. Клеточный гомогенат центрифугируют при малой скорости для удаления ядер и клеточного дебриса.
5. Супернатант, содержащий большую часть инфекционного вируса, наслаивают на 5–40%-ный градиент декстрана, приготовленный на трис-буфере, и центрифугируют 1 ч при 12500 об/мин. Фракция вируса видна невооруженным глазом в центре градиента.
6. Вирус из фракции осаждают центрифугированием в течение 1 ч при 20000 об/мин.
Полученный вирус уже достаточно очищен и может быть использован в различных целях. Кроме того, степень чистоты вируса можно повысить, как описано выше. Очищенный вирус, полученный любым методом, ресуспендируют в дистиллированной воде или в соответствующем буфере. Аликвоты суспензии можно использовать для заражения клеток, подсчета общего числа частиц и определения концентрации белка. Вирус хранят при –70°С, однако следует учитывать, что оттаивание ведет к частичному разрушению вирусной оболочки. На рис. 5 показаны различные вирусные частицы, обнаруженные в препаратах очищенного вируса.
1.5.3 Анализ структурных вирусных полипептидов
В большинстве случаев проводится электрофорез в пластинах полиакриламидного геля в присутствии ДДС-Na, как было описано впервые Даймэком и Ватсоном.
8-09-2015, 22:18
