МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
УКРАИНСКИЙ ГОСУДАРСТВЕННЫЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
РЕФЕРАТ
на тему: «Стерилизующая фильтрация»
Выполнила:
студентка группы 3-Ф-68
Смотрова О.А.
Проверил: Поляков Е.В
Днепропетровск 2007г
Механические методы стерилизации
Стерилизация растворов широко используется при приготовлении многих лекарственных форм, препаратов крови, кровезаменителей, питательных сред для культивирования и т.д.
В отличии других методов стерилизующая фильтрация позволяет обрабатывать растворы в медико-биологических целях, содержащая лабильные вещества.
Микробные клетки из споры можно рассматривать как нерастворимые образования с очень малым (1-2мкм) размером частиц.
Подобно другим включениям, они могут быть отделены от жидкости механическим путем – фильтрованием сквозь мелкопористые фильтры.
Этот метод стерилизации включен в ГФ–ХI для стерилизации термолабильных растворов.
По механизму действия фильтрующие перегонки, используемые для стерильной фильтрации, подразделяют на глубинные и поверхностные (мембранные) с размером пор не более 0,3 мкм.
Глубинные фильтры характеризуются сложным механизмом задержания микроорганизмов (ситовым, адсорбционным, инерционным). Введу большой толщины таких фильтров, удерживаются частицы меньшего размера, чем размер пор фильтрующей перегонки.
Глубинные фильтры классифицируют на: керамические и фарфоровые (размер пор 3-4мкм), стеклянные (около 2мкм), бумажно-асбестовые (1-1,8мкм).
Керамические фильтры.
Роль фильтрующих перегородок в них выполняют пористые керамические или стеклянные плитки, поэтому их часто называют патронами. Используются плитки диаметром 175мм, толщиной 20мм и размером пор до 40 мкм.
Указанные плитки изготавливают из кристаллов стекла, шамота(75%) и бентонита (25%) с последующим обжигом при 1300 0 С.
Керамический фильтр, применяемый для фильтрации инъекционных растворов, представляет собой плотно закрываемый цилиндрический корпус, внутрь которого вставлена крестовина. В открытые торцевые стенки крестовины вставлены керамические плитки. Раствор под давлением через патрубок поступает в корпус, проходит через плитки во внутреннюю полость крестовины и выходит из нее через патрубок. Регенерируют керамические плитки промывкой их водой под давлением 1+1,5 бар в обратном направлении движению фильтра.
Патронные фильтры применяются в микробиологической промышленности для освобождения концентрата от взвешенных частиц и микроорганизмов. Элемент подобного фильтра изготавливают из пористой керамики или прессованного кизельгура в виде патронов диаметром 50мм, высотой 270мм и толщиной стенки 45мм. пористость патрона — 340 %. Элементы закрепляют в отверстиях решетки, установленной в корпусе. Очищаемый раствор под давлением 2+2,5 бар подается в нижнюю часть корпуса, поступает черезкапилляры во внутреннюю часть элемента, а затем выливается из него в верхнюю часть фильтра и эвакуируется через патрубок за пределы установки.
Недостатками керамических и фарфоровых фильтров является продолжительность стерилизации, потеря раствора в порах толстого фильтра, образование микротрещин из-за хрупкости материала и, следовательно, ненадежность стерилизации.
Стеклянные и бумажно-асбестовые фильтры.
Стеклянные микропористые фильтры изготавливают из сваренных зерен стекла с диаметром до 2 мкм. Фильтры имеют вид пластинок или дисков, закрепленных в стеклянных сосудах. Стеклянные фильтры по сравнению с другими мелкопористыми фильтрами более удобны для применения в аптечной практике.
Бумажно-асбестовые фильтры несовершенны. Стеклянные фильтры малопроизводительны, бумажно-асбестовые фильтры не рекомендуются для стерилизации инъекционных растворов, поскольку они состоят из волокнистых материалов, и имеется угроза отрыва волокон от фильтра. Попадая в организм с раствором, такие волокна могут вызвать различные патологические реакции.
Мембранные фильтры.
В последние годы большое распространение для стерилизующей фильтрации получили микропористые мембранные фильтры. Они лишены недостатков присущих стеклянным и бумажно-асбестовым фильтрам.
Мембранные фильтры представляют собой тонкие (100-150мкм) пластины из полимерных материалов, характеризующиеся ситовым механизмом задержания микроорганизмов и постоянным размером пор (около 3мкм). Во избежание быстрого засорения фильтра мембраны используют в сочетании с префильтрами, имеющие более крупные поры. При стерилизации больших объемов растворов оптимальным является применение фильтров обоих типов.
Стерилизующая фильтрация имеет преимущества по сравнению с методами термической стерилизации. Для многих растворов термолабильных веществ (апоморфина гидрохлорид, викасол, барбитал натрия и др.) его признают единственно доступным методом стерилизации. Метод весьма перспективен при производстве глазных капель.
Проведение стерилизующей фильтрации не является достаточным условием стерилизации, если возможна стерилизация продукта в окончательной первичной упаковке. Предпочтительным является метод стерилизации паром.
Если стерилизация продукта в окончательной первичной упаковке невозможна, то перед наполнением растворов или жидкостей в предварительно стерилизованную первичную упаковку их следует пропускать через стерильные фильтры с номинальным размером пор не более 0,22 мкм или с эквивалентными свойствами по удержанию микроорганизмов. Такие фильтры могут задерживать большую часть бактерий или плесневых грибов, но не все вирусы или микоплазмы. По возможности процесс фильтрации следует дополнять соответствующей термообработкой.
В связи с тем, что у метода фильтрации есть дополнительный риск загрязнения микроорганизмами по сравнению с другими способами стерилизации, непосредственно перед наполнением можно рекомендовать повторную фильтрацию продукта через дополнительный удерживающий микроорганизмы стерилизующий фильтр. Окончательную стерилизующую фильтрацию продукта следует проводить как можно ближе к месту наполнения.
Перед использованием стерилизующего фильтра и сразу после его использования следует проверить отсутствие у него повреждений таким методом, как тест на "точку пузырька", методом диффузионного потока или выдержкой под давлением.
При аттестации следует измерять время, необходимое для фильтрации раствора заданного объема, и перепад давления на фильтре. Любые значительные отклонения в процессе производства от аттестованных показателей следует регистрировать и анализировать. Результаты этих проверок должны быть включены в протоколы на серию продукции. Сразу после использования следует подтверждать целостность критических газовых и воздушных фильтров. Целостность других фильтров необходимо подтверждать через соответствующие интервалы времени.
Не допускается использовать один и тот же фильтр в течение более одного рабочего дня, за исключением случаев, когда более длительное его использование подтверждено аттестацией (валидацией).
Применяемый фильтр не должен оказывать влияние на продукт, задерживая его компоненты или выделяя в него какие-либо посторонние вещества
Одной из важных операций в процессе получения растворов лекарственных веществ для парентерального введения является стадия фильтрования. Проведенные исследования фильтровальных перегородок из отечественных материалов (нетканого нолипропилена в 5—7 слоев и мембранных фильтров «Владипор») показали их эффективность для тонкого и стерилизующего фильтрования растворов.
Эффективность фильтрования определяется не только степенью очистки, фильтрата, но и производительностью фильтра. От гидродинамических свойств фильтровальных перегородок зависят их сопротивления току фильтруемой жидкости, скорость фильтрования, возможность получения максимального количества фильтрата с единицы фильтрующей поверхности. Практическому применению фильтрационных характеристик посвящены исследования процесса фильтрования растворов лекарственных веществ в химико-фармацевтической промышленности, в том числе инъекционных растворов.
В настоящее время было проведено сравнительное изучение свойств различных выпускаемых промышленностью фильтров с созданными в Институте физико-органической химии АН БСССР и серийно выпускаемыми капроновыми микрофильтрационными мембранами (Мифил).
Экспериментальная часть
В работе использованы мембранные фильтры фирм «САРТРИУС» (ФРГ), GS, «ДЮРАПОЛ» фирмы «МИЛЛИПОР» (США), МФА-1 (г. Владимир) и капроновые мембраны «МИФИЛ» с размером пор 0,2мкм. Оценку фильтрующих свойств мембран во всех случаях проводили на установке для стерилизующей фильтрацией под давлением 0,1МПа с применением инертного газа (гелий). Фильтрацию осуществляют на фильтродержателе с диаметром фильтра 47мм. Перед использованием все фильтры многократно отмывали дистиллированной водой, высушивали, помещали в фильтродержатель и стерилизовали при 1,1+0,2кгс/см2 и температуре 120+2 0 С в течение 30мин.
Для оценки стерилизующей оценки фильтров применяли синтетические питательные среды (минимальная среда Игла, среда Лейбовица, среда 199), физиологические растворы, сыворотки крови (крысиная, эмбриональная теленка, плацентарная человека). Опыты проведены с нативными инактевироваными нагреванием (56 0 С, 30мин) сыворотками предварительно центрифугированными (24000g) и пропущены через пакет предфильтров (диаметр пор 1,2, 0,8 и 0,45мкм). Применены как неразведенные сыворотки, так и после разведения одной из питательных сред (10 и 20% сыворотки в окончательном объеме).
Стерилизующую способность оценивали путем фильтрации предварительно контаминированных PseudomonasdiminutaATSS № 11568 Е.coliATSS №11775 (103 -104 бактерий/мл) растворов, которые затем помещали в термостат при 37 0 С. Наличие загрязнения определяли через 2 недели.
Экспериментальные данные по оценке производительности фильтров и динамике скорости фильтрации обработанной на компьютере HP-9845 (США) с использованием метода регрессионного анализа и последующей аппроксимацией данных аналитическими функциями.
Электронно-микроскопические исследования поверхности фильтров выполнены на сканирующих электронных микроскопах «Opton» (ФРГ) Jem-100 CX («Jeol», Япония)с приставкой «Acid 4 D».
Тест - объектами для изучения возможного цитотоксического влияния материала фильтров «Мифил» служили первичные культуры заднекорешковых ганглиев эмбрионов цыплят, тригеминальных ганглиев новорожденных крыс, а также перевиваемые линии клеток VERO, HeLa, HEP, MDSK
Результаты и их обсуждение
В таблице приведены величины проницаемости (Q), прочности σ и относительного удлинения при разрыве ε исследованных мембран.
Характеристики мембран различных марок с размером пор 0,2мкм.
| Марка мембраны | Место изготовления, фирмы | Q, мл/(мин·см2 ) при 0,1МПа |
Q, МПа | ε,% |
МФА-1 GS «Дюрапор» «Мифил» |
г. Владимир «Миллипор» (США) «Миллипор» (США) Таллин |
17 17 13 13 |
2,3 3,2 4,4 6,9 |
6,7 2,7 16,5 13,0 |
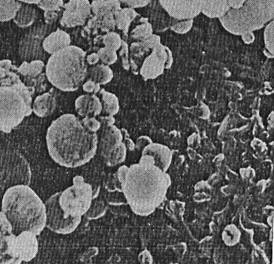
Рис. 1. Микрофлора Pseudomonasdiminuta на поверхности мембраны «Мифил»х1000.
Из рис. 1 следует, что все использованные пористые мембраны, подготовленные автоклавированием, обеспечивают очистку как спонтанно загрязненных, так и специально контаминированных биологических жидкостей от макрофлоры с размерами более 0,2мкм. Вчасти нативных сывороток спонтанно контаминированных микоплазмой (размеры менее 0,2 мкм), эффективная стерилизация не достигается без предварительной инактивации их прогреванием.
На рис. 2 представлены электронные микрофотографии поверхности исследованных мембран.

Рис.2.Электронныемикрофотографииповерхностеймембран. а – МФА; б – GS; в – «Дюрапор»; г – «Мифил».
Сравнительный анализ динамики скорости фильтрации показал однотипность и изменения этого параметра для всех изученных фильтров(рис. 3). Установлено, чтодля сложных поликомпонентных биологических жидкостей она определяется удельной пористостью мембраны, а также наличием в фильтруемых растворах макромолекул белковой природы (рис. 4).
Неорганические вещества и органические низкомолекулярные компоненты существенно не влияют на скорость фильтрации.
Такое заключение справедливо только для слабозагрязненных растворов. В этом случае изменение объема фильтруемой жидкости описывается уравнением вида υ = ατ-1 , где υ ─ объем профильтрованной жидкости; α ─ коэффициент регрессии; τ ─ время от начала фильтрации.
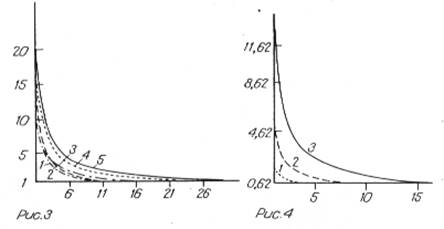
Рис.3. Кривые динамики скорости фильтрации сывороток плацентарной крови человека через мембраны «Мифил». 1- « Дюрапор»; 2 — GS; З— «Мифил»; 4 — «Сарториус»; 5 — МФА-1. Здесь и на рис. 2 по оси абсцисс τ (в с), по оси ординат — υ(в мл).Рис. 4. Кривые динамики скорости фильтрации сывороток плацентарной крови человека через мембраны «Мифил». Концентрация сывороток: 1 — 100 %. 2 —20 %. Э — 10%.
Возможность использован и я фильтров для медико-биологических задач определяется не только стерилизующей эффективностью, производительностью, механической прочностью, возможностью применения различных способов стерилизации, но и отсутствием выделения токсичных компонентовв стерилизуемую жидкость. Предполагаемое токсическое действие материала фильтров «Мифил» оценивали в опытах по культивированию клеток и тканей. Использование в качестве тест - объектов культуральных систем явилось следствием хорошо известного факта гиперчувствительности клеток invitroк любым повреждающим воздействиям в сравнении с клетками insitu. Проведено исследование функционального состояния клеток в развивающихся культурах, выращиваемых в различных питательных средах, фильтрованных через оцениваемый фильтр, или в присутствии материала фильтра в культуральной системе. В последнем случае отмытые и автоклавированные фильтры (100 мг на 1 мл среды) помещали в сосуд со средой и развивающимися культурами. Ежедневно в течение недели опытные культуры сравнивали с контрольными на предмет выявления в них цитотоксических изменений. Все культуры исследовали прижизненно микроскопически, часть из них фиксировали и окрашивали для гистологического и гистохимического анализа.

Рис.5. Культуры клеток и тканей, выращенные в присутствии материала мембраны «Мифил» в питательной среде.
1 – клетки линии MDSK. Окраска гематоксилином х16; 2 – клетки линии МА; эстеразная активность, выявляемая методом диазосочетаний. х40; 3 – культура тригеминального ганглия крысы, 12 дней invitro. Прижизненная микроскопия, фазовый контраст.х40.
Функциональную оценку культур проводили по следующим параметрам: укрепление клеток на субстрате, формирование и сохранение характерного рисунка монослоя, пролиферация для перевиваемых культур, рост отростков, формирование зоны роста, состояние нейронов для культур нервной ткани. Цитологический анализ таких культур не выявил цитотоксического эффекта материала фильтров «Мифил» (рис. 5).
Таким образом, проведенные исследования позволяют заключить, что микрофильтрационные капроновые мембраны «Мифил» обеспечивают эффективную стерилизацию биологических жидкостей, загрязненных микрофлорой с размерами более 0,2 мкм, являются нетоксичными, обладают высокой механической прочностью и не изменяют своих свойств при обычных методах стерилизации автоклавированием, а по производительности сопоставимы с фильтрами «Дюрапор» фирмы «Миллипор» (США).
Список литературы
1. Промышленная технология лекарств: [Учебник. В 2-х т. Том 2/ В.И Чуешов, М.Ю. Хохлова и др.]; Под редакцией профессора В.И. Чуешова. – Х.:МТК-Книга; Издательство НФАУ, 2002. – с.180-181,с. 555-556.
2. Технология лекарственных форм:[Учебник. В 2-х т. Том 1/ Т.С. Кондратьева, Л.А. Иванова, Ю.И. Зеликсон и др.;Под ред. Т.С. Кондратьевой.- М.: Медицина, 1991.ил.-(Учеб. Лит. Для студ. Фарм. Ин-тов)-с.351-354.
3. Химико-фармацевтический журнал. В.Я. Вильнер, Ю.М. Аркатов, Т.А. Коршунова, В.А. Артамонов «Стерилизующая фильтрация биологических жидкостей с помощью микрофильтрационных мембран».1988. с. 1001-1004.
4. Химико-фармацевтический журнал.И.В. Беседина, Ф.А. Конев, А.А. Болотова.»Изучение процесса фильтрования инъекционных растворов при использовании некоторых фильтровальных материалов».1988.с.98-101.
5. Интернет: http:|/wwww.unico94.ru/official/docs/show/ function.mysql-connect
8-09-2015, 23:07
