Каким образом кальций участвует в работе синапса? Попадая в цитоплазму синаптического окончания, кальций входит в связь с белками, образующими оболочку пузырьков, в которых хранится медиатор. В конечном итоге мембраны синаптических пузырьков сжимаются, выталкивая свое содержимое в синаптическую щель. Этот процесс очень напоминает сокращение мышечного волокна в мышце, во всяком случае, эти два процесса имеют одинаковый механизм на молекулярном уровне. Таким образом, связывание кальция белками оболочки пузырька приводит к ее сокращению, и содержание пузырька впрыскивается (экзоцитоз) в щель, которая отделяет мембрану одного нейрона от мембраны другого. Эта щель называется синоптической щелью. Из описания должно быть ясно, что возбуждение (электрический потенциал действия) нейрона в синапсе превращается из электрического импульса в импульс химический. Другими словами, каждое возбуждение нейрона сопровождается выбросом в окончании его аксона порции биологически активного вещества - медиатора. Далее молекулы медиатора связываются с специальными белковыми молекулами, которые находятся на мембране другого нейрона. Эти молекулы называются рецепторами. Рецепторы устроены уникально и связывают только один тип молекул. В некоторых описаниях указывается, что они подходят, как «ключ к замку» (ключ подходит только к своему замку).
Рецептор состоит из двух частей. Одну можно назвать «узнающим центром», другую - «ионным каналом». Если молекулы медиатора заняли определенные места (узнающий центр) на молекуле рецептора, то ионный канал открывается, и ионы начинают входить в клетку (ионы натрия) или выходить (ионы калия) из клетки. Другими словами, через мембрану протекает ионный ток, который вызывает изменение потенциала на мембране. Этот потенциал получил название постсинаптического потенциала (рис. 2.13). Очень важным свойством описанных ионных каналов является то, что количество открытых каналов определяется количеством связанных молекул медиатора, а не потенциалом на мембране, как в случае с электровозбудимой мембраной нервного волокна. Таким образом, постсинаптические потенциалы имеют свойство градуальности: амплитуда потенциала определяется количеством молекул медиатора, связанного рецепторами. Благодаря этой зависимости амплитуда потенциала на мембране нейрона развивается пропорционально количеству открытых каналов.
На мембране одного нейрона могут одновременно находиться два вида синапсов: тормозные и возбудительные. Все определяется устройством ионного канала мембраны. Мембрана возбудительных синапсов пропускает как ионы натрия, так и ионы калия. В этом случае мембрана нейрона деполяризуется. Мембрана тормозных синапсов пропускает только ионы хлора и гиперполяризуется. Очевидно, что если нейрон заторможен, потенциал мембраны увеличивается (гиперполяризация). Таким образом, нейрон благодаря воздействию через соответствующие синапсы может возбудиться или прекратить возбуждение, затормозиться. Все эти события происходят на соме и многочисленных отростках дендрита нейрона, на последних находится до нескольких тысяч тормозных и возбудительных синапсов.
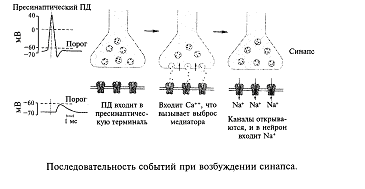
В качестве примера разберем, как действует в синапсе медиатор, который называется ацетилхолином. Этот медиатор широко распространен в головном мозге и в периферических окончаниях нервных волокон. Например, двигательные импульсы, которые по соответствующим нервам приводят к сокращению мышц нашего тела, оперируют ацетилхолином. Ацетилхолин был открыт в 30-х годах австрийским ученым О. Леви. Эксперимент был очень прост: изолировали сердце лягушки с подходящим к нему блуждающим нервом. Было известно, что электрическая стимуляция блуждающего нерва приводит к замедлению сокращений сердца вплоть до полной его остановки. О. Леви простимулировал блуждающий нерв, получил эффект остановки сердца и взял из сердца немного крови. Оказалось, что если эту кровь добавить в желудочек работающего сердца, то оно замедляет свои сокращения. Был сделан вывод: при стимуляции блуждающего нерва выделяется вещество, останавливающее сердце. Это и был ацетилхолин. Позже был открыт фермент, который расщеплял ацетилхолин на холин (жир) и уксусную кислоту, в результате чего прекращалось действие медиатора. Этим исследованием впервые была установлена точная химическая формула медиатора и последовательность событий в типичном химическом синапсе. Эта последовательность событий сводится к следующему.
Потенциал действия, пришедший по пресинаптическому волокну к синапсу, вызывает деполяризацию, которая включает кальциевый насос, и ионы кальция поступают в синапс; ионы кальция связываются белками мембраны синаптических пузырьков, что приводит к активному опорожнению (экзоцитозу) пузырьков в синаптическую щель. Молекулы медиатора связываются (узнающим центром) соответствующими рецепторами постсинаптической мембраны, при этом открывается ионный канал. Через мембрану начинает протекать ионный ток, что приводит к возникновению на ней постсинаптического потенциала. В зависимости от характера открытых ионных каналов возникает возбудительный (открываются каналы для ионов натрия и калия) или тормозной (открываются каналы для ионов хлора) постсинаптический потенциал.
Ацетилхолин весьма широко распространен в живой природе. Например, он находится в стрекательных капсулах крапивы, в стрекательных клетках кишечнополостных животных (например, пресноводной гидры, медузы) и пр. В нашем организме ацетилхолин выбрасывается в окончаниях двигательных нервов, управляющих мышцами, из окончаний блуждающего нерва, который управляет деятельностью сердца и других внутренних органов. Человек давно знаком с антагонистом ацетилхолина - это яд кураре, которым пользовались индейцы Южной Америки при охоте на животных. Оказалось, что кураре, попадая в кровь, вызывает обездвиживание животного, и оно погибает фактически от удушья, но кураре не останавливает сердце. Исследования показали, что в организме существуют два типа рецепторов к ацетилхолину: один успешно связывает никотиновую кислоту, а другой - мускарин (вещество, которое выделено из гриба рода Muscaris). На мышцах нашего тела находятся рецепторы никотинового типа к ацетилхолину, тогда как на сердечной мышце и нейронах головного мозга - рецепторы к ацетилхолину мускаринового типа.
В настоящее время в медицине широко применяют синтетические аналоги кураре для обездвиживания больных во время сложных операций на внутренних органах. Применение этих средств приводит к полному параличу двигательной мускулатуры (связывается рецепторами никотинового типа), но не влияет на работу внутренних оранов, в том числе сердца (рецепторы мускаринового типа). Нейроны головного мозга, возбуждаемые через мускариновые ацетилхолиновые рецепторы, играют большую роль в проявлении некоторых психических функций. Сейчас известно, что гибель таких нейронов приводит к старческому слабоумию (болезнь Альцгеймера). Другим примером, который должен показать важность именно рецепторов никотинового типа на мышце к ацетилхолину, может служить заболевание, называемое miasteniagrevis (мышечная слабость). Это генетически наследуемая болезнь, т. е. ее происхождение, связано с «поломками» генетического аппарата, которые передаются по наследству. Заболевание проявляется в возрасте ближе к половозрелости и начинается с мышечной слабости, которая постепенно усиливается и захватывает все более обширные группы мышц. Причиной этого недуга оказалось то, что организм больного вырабатывает белковые молекулы, которые прекрасно связываются ацетилхолиновыми рецепторами никотинового типа. Занимая эти рецепторы, они препятствуют связыванию с ними молекул ацетилхолина, выбрасываемых из синаптических окончаний двигательных нервов. Это и приводит к блокированию синаптического проведения к мышцам и, следовательно, к их параличу.
Описанный на примере ацетилхолина тип синаптической передачи - не единственный в ЦНС. Второй тип синаптической передачи также широко распространен, например, в синапсах, в которых медиаторами являются биогенные амины (дофамин, серотонин, адреналин и др.). В этом типе синапсов имеет место следующая последовательность событий. После того как образовался комплекс «молекула медиатора - рецепторный белок», активируется специальный мембранный белок (G-белок). Одна молекула медиатора при связывании с рецептором может активировать много молекул G-белка, и это усиливает эффект медиатора. Каждая активированная молекула G-белка в одних нейронах может открывать ионный канал, а в других активировать внутри клетки синтез специальных молекул, так называемых вторичных посредников. Вторичные посредники могут запускать в клетке многие биохимические реакции, связанные с синтезом, например, белка, в этом случае возникновения электрического потенциала на мембране нейрона не происходит.
Существуют и другие медиаторы. В головном мозге в качестве медиаторов «работает» целая группа веществ, которые объединены под названием биогенные амины. В середине прошлого столетия английский врач Паркинсон описал болезнь, которая проявлялась как дрожательный паралич. Это тяжелое страдание вызвано разрушением в мозге больного нейронов, которые в своих синапсах (окончаниях) выделяют дофамин - вещество из группы биогенных аминов. Тела этих нейронов находятся в среднем мозге, образуя там скопление, которое называется черной субстанцией. Исследования последних лет показали, что дофамин в мозге млекопитающих также имеет несколько типов рецепторов (в настоящее время известно шесть типов). Другое вещество из группы биогенных аминов - серотонин (другое название 5-окситриптамин) - вначале было известно как средство, приводящее к подъему кровяного давления (сосудосуживающее). Обратите внимание, что, это отражено в его названии. Однако оказалось, что истощение в головном мозге серотонина приводит к хронической бессоннице. В опытах на животных было установлено, что разрушение в мозговом стволе (задних отделах мозга) специальных ядер, которые известны в анатомии как ядра шва, приводит к хронической бессоннице и в дальнейшем гибели этих животных. Биохимическое исследование установило, что нейроны ядер шва содержат серотонин. У пациентов, страдающих хронической бессонницей, также обнаружено снижение концентрации серотонина в мозге.
К биогенным аминам относят также адреналин и норадреналин, которые содержатся в синапсах нейронов автономной нервной вегетативной системы. Во время стресса под влиянием специального гормона - адренокортикотропного (подробнее см. ниже) - из клеток коры надпочечников в кровь также выбрасываются адреналин и норадреналин.
ЭЛЕКТРОЭНЦЕФАЛОГРАФ
Необходимо специально подчеркнуть, что деятельность высшего из известных творений Эволюции — человеческого мозга неимоверно сложна и крайне трудно поддается изучению и систематизации. Поэтому, в отличие от большинства других физиологических сигналов, при анализе ЭЭГ используется намного меньше устойчивых числовых характеристик и детерминированных диагностических критериев, а адекватность клинического заключения в огромной степени определяется профессиональным опытом и внутренним чутьем высококвалифицированного клинициста.
Более того, если после анализа других электрофизиологических показателей обычно можно прописать лечение в той или иной мере восстанавливающее нормальное состояние, то результатом исследования ЭЭГ обычно являются лишь рекомендации по коррекции поведения и ограничение видов деятельности [1, стр. 127].
Коре головного мозга свойственна постоянная электрическая активность, являющаяся результатом генерации синаптических потенциалов и импульсных разрядов в отдельных нервных клетках.
Генерация в коре электрических колебаний была обнаружена Р. Катоном и А. Данилевским. Возможность регистрации биопотенциалов непосредственно от поверхности головы животных была показана В. Правдич-Неминским в 1925 г. В 1929 г. Г. Бергер зарегистрировал электрическую активность от поверхности головы человека — электроэнцефалограмму (ЭЭГ) [2, стр 147].
Электроэнцефалограмма - графическая запись биоэлектрических процессов мозга, отводимых с помощью электродов, расположенных на поверхности головы.
Ранее считали, что ЭЭГ характеризует суммарное воздействие потенциалов действия различных клеток тела и нервных волокон, расположенных вблизи измерительных электродов. Однако в настоящее время считают, что, так как пути распространения и временные соотношения между потенциалами действия в мозге почти случайны по своей, природе, то потенциалы действия вносят лишь незначительный вклад в ЭЭГ. В соответствии с принятой теорией биоэлектрические потенциалы, появляющиеся на поверхности кожи головы, характеризуют воздействие синхронизированных постсинаптическик (переходных) потенциалов (gradedpotentials) в различных комбинациях нейронов мозга.
Так как на окончания аксонов непрерывно поступают потенциалы действия, то потенциал покоя каждого нейрона мозга непрерывно изменяется. Эти изменения потенциалов покоя, которые происходят медленнее, чем изменения потенциалов действия, называются постсинаптическими или переходными потенциалами. Часто переходные потенциалы большого числа нейронов данной области мозга на какой-то период времени синхронизируются. Затем такая синхронизация нарушается, и возникают другие синхронизированные комплексы возбуждений, может быть, и на других частотах.
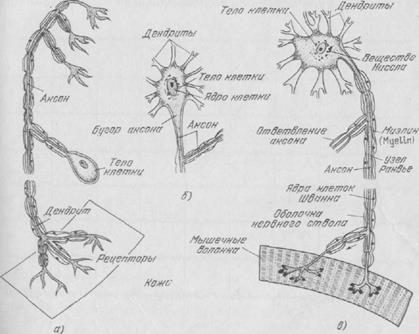
Рис. 12. Схематическое изображение трех различных типов нейронов: а) — спинальный сенсорный нейрон; б) — ассоциативный нейрон; в) — спинальный двигательный нейрон.
Как считают в настоящее время, такие синхронизированные переходные потенциалы и являются основными источниками потенциалов ЭЭГ. Типичные образцы записи ЭЭГ показаны на рис. 13. Эти потенциалы ЭЭГ, измеренные на поверхности кожи головы, в действительности представляют собой результат комбинированного (суммарного) воздействия постсинаптических (переходных) потенциалов в достаточно широкой области (коры головного мозга и в различных точках ниже ее. В общем случае эти потенциалы почти случайны по природе. Однако некоторые характеристики кривых ЭЭГ связаны с состоянием сна или патологической активностью. [4, стр. 88-92]
РИТМЫ
Под понятием "ритм" на ЭЭГ подразумевается определенный тип электрической активности, соответствующий некоторому определенному состоянию мозга и связанный с определенными церебральными механизмами. В клинических исследованиях обычно выделяют четыре типа ритмов, последовательно возрастающей частоты: дельта, тета, альфа и бета ритмы. В спокойном состоянии у человека в большей части коры больших полушарий регистрируется регулярный ритм с частотой около 8—13 Гц в секунду (альфа-ритм). В состоянии активной деятельности он сменяется частыми (более 13 в секунду) колебаниями небольшой амплитуды (бета-ритм). Во время сна он сменяется медленными (0,5—3.5 в секунду) колебаниями (дельта-ритм).
Аналогичные изменения происходят при активации восходящих путей, проецирующихся в кору. Таким образом, ЭЭГ позволяет судить о функциональном состоянии коры, например о глубине наркоза, о наличии в определенных ее зонах патологических процессов.
Для анализа деятельности корковых структур, в особенности у животных, возможно отведение потенциалов от отдельных нервных клеток. С помощью этого метода удалось охарактеризовать свойства пирамидных и вставочных нейронов, особенности, протекания в них синаптического возбуждения и торможения, действия на их мембрану различных медиаторов.
Большой интерес представляет исследование особенностей активности индивидуальных клеток коры во время выполнения различных функциональных задач. Регистрация активности пирамидных нейронов моторной зоны коры во время выполнения обезьяной произвольных движений позволила уточнить характер импульсации этих клеток в связи с двигательной функцией [2, стр. 147-148].
УСТРОЙСТВО ЭНЦЕФАЛОГРАФА
Типичная блок-схема энцефалографа представлена на рис. 14. Ниже мы более подробно обсудим назначение и особенности различных его элементов и узлов. Электроэнцефалографическая установка состоит из электродов, соединительных проводов, электродной распределительной коробки с пронумерованными гнездами, коммутационного устройства и некоторого количества каналов регистрации, позволяющих определенное количество независимых друг от друга процессов. При этом необходимо иметь в виду, что 4-канальные электроэнцефалографы непригодны для диагностических целей, так как позволяют выявить только грубые изменения, генерализованные по всей конвекситальной поверхности (конвекситальная поверхность мозга - поверхность мозга, прилегающая к лобным, теменным, височным и затылочным костям черепа), 8-12-канальные-пригодны только для общих диагностических целей-оценки общего функционального состояния и выявления грубой очаговой патологии. Только наличие 16 и более каналов позволяет регистрировать биоэлектрическую активность всей конвекситальной поверхности мозга одновременно, что дает возможность проводить самые тонкие исследования [5].
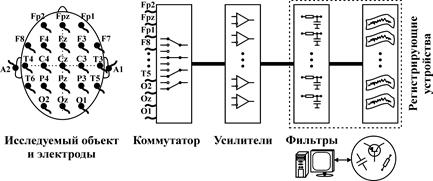
Рис. 14. Типичная блок-схема электроэнцефалографа.
ЭЛЕКТРОДЫ
По материалу исполнения требования к энцефалографическим электродам аналогичны требованиям к электродам других измерителей биопотенциалов.
По форме, и способу фиксации на голове выделяют 6 видов электродов:
1) контактные накладные неприклеивающися электроды, которые прилегают к голове при помощи тяжей шлема-сетки;
2) приклеивающиеся электроды;
3) базальные электроды (электроды, вводимые через носовые ходы и расположенные на твердом небе; отведение с области основания черепа)
4) игольчатые электроды;
5) пиальные электроды;
6) многоэлектродные иглы [5, гл. 1].
При исследовании электрической активности головного мозга различают инвазивные и неинвазивные способы регистрации этой активности. Инвазивные способы подразумевают введение электродов, имеющих форму игл, непосредственно в мозг. Как известно, в головном мозге человека практически нет болевых нервных окончаний, поэтому, такая операция проводится без наркоза. При неинвазивном способе регистрации электроды накладываются на поверхность кожи головы.
Т.к. электроэнцефалографические электроды размещаются на относительно небольшом расстоянии друг от друга, то необходимо обращать особое внимание на предотвращение непосредственного электрического контакта между парой электродов, например, через электродный гель. В электроэнцефалографии желательно использовать гели более густой консистенции, чем в других физиологических исследованиях (особенно при регистрации ЭЭГ у детей [6, стр 352]). Вместе с тем, необходимо обеспечить относительно низкие и стабильные во времени значения сопротивления между электродом и кожей головы (порядка 10 кОм) [6, стр 352].
Нужно отметить, что этап наложения электродов остается наиболее трудоемким при проведении ЭЭГ – исследований, он практически не поддается автоматизации и требует участия опытного квалифицированного специалиста. Перспективным направлением решения этих проблемм является метод магнитоэнцефалографии (МЭГ). В нем используются магнитные, а не электрические поля (как при ЭЭГ). МЭГ определяет направление аномальной электрической активности мозга, а не только усиливает сигналы. Многие ученые считают, что МЭГ дополняет ЭЭГ, но его применение в основном пока ограничивается исследовательскими целями [7] (рис.15).
а)
|
б)
|
|
в)
|
г)
|
д)
|
Рис. 15. a) Нейромагнитоэнцефалограф и б) -г) Современные способы представления результатов исследований с помощью ЭВМ (с сайтов http://ntl-cbm.narod.ru/MEG-SITE/index-meg.htm и http://jenameg10.meg.uni-jena.de/gallery.htm)
Коммутатор (би - и монополярные отведения)
Анализ ЭЭГ, в конечном итоге, направлен на выделение характерных типов электрических потенциалов и определение локализации их источников в мозге. С теоретической точки зрения, регистрация потенциала какой-либо точки в неискаженном виде возможна в условиях, когда один
8-09-2015, 19:29