Широко применяемые для лечения ран аэрозоли в виде растворов, суспензий, пленкообразующих форм: «Ливиан», «Винизоль», «Лиоксазоль», «Левовинизоль», «Лифузоль» и др. представляют собой либо масляные, либо спиртовые растворы, что не является оптимальным вариантом для лечения гнойных ран. В I фазе раневого процесса, особенно при обильной экссудации, они не должны применяться. Использование их во II фазе раневого процесса ограничено либо недостатками лекарственной формы, либо однонаправленным действием («Лиоксазоль»), либо отсутствием антимикробных средств («Винизоль»). Поэтому эти препараты играют вспомогательную роль в местном лечении ран. Используемые в современной медицине пенообразующие формы аэрозолей содержат различные по действию антимикробные средства антибиотики и антисептики, такие как: диоксизоль (диоксидин), сульйодовизоль (йодовидон), сульйодопирон (йодопирон), нитазол (нитазол), аэрозоль мирамистина, цимезоль (циминаль, тримекаин, порошок окисленной целлюлозы), гипозоль-АН (нитазол, аекол, метилурацил) и другие. Такие формы обладают многокомпонентным действием, что дает возможность использования их для лечения ран в I и II фазе раневого процесса. Не устраивает то, что в состав препаратов входят «старые» антибиотики (левомицетин), к которым развилось привыкание микроорганизмов; другие антимикробные средства (производные йода, мирамистин) оказывают в ране узконаправленное действие на ассоциативную микрофлору, что не отвечает требованиям современной хирургии. Цена некоторых препаратов является также сдерживающей причиной их применения в ЛПУ вследствие недостаточности финансирования. [44,46,47]
Местное медикаментозное лечение ран с использованием существующих лекарственных средств в последние годы становится менее эффективным.
В середине 80-х гг. XX в. на фоне переоценки места и значимости антибиотиков возродился интерес к антисептикам. Все больше исследователей считают, что в лечении и профилактике местных инфекций приоритет должен быть отдан антисептикам или препаратам, в том числе антибиотикам, которые удовлетворяют требованиям, предъявляемым к антисептикам. [40,48,49]
Применение антисептиков при местных и системных инфекционных процессах вызвано рядом целей:
1) предупреждение генерализации процесса;
2) снижение численности популяции и подавление жизнедеятельности находящихся в инфекционном очаге микробов;
3) предупреждение перехода острых местных инфекционных процессов в хроническую форму; в результате суперинфекции, реинфекции и вторичной инфекции, в результате заноса микроорганизмов из внешней среды, с других областей тела больного или в результате активации местной аутофлоры;
4) сохранение нормальной микрофлоры в пораженном органе, а в случае изменения - ее восстановление.
Для профилактической и терапевтической антисептики ран имеется большой выбор антисептиков. [38,49,50]
Однако широко используемые в клинической хирургии растворы перекиси водорода (3%), калия перманганата (0,1-0,5%), борной кислоты (1-3%), диоксидина (1%), хлоргексидина биглюконата (0,02%), фурацилина (1:5000), хлорамина Б (1%), этакридина лактата обладают узким спектром действия, они токсичны и аллергичны. [51]
Традиционно применяемые для обработки гнойных ран водные растворы перекиси водорода и калия перманганата не оказывают существенного влияния. На микробную флору, их антисептический эффект ограничивается раневой поверхностью и не распространяется в глубь тканей, где находятся микробы. Использование раствора перекиси водорода больше отвечает требованию щадящей механической обработки, чем обеззараживанию. Так фурацилин активен в отношении Гр.(+) и некоторых Гр.(-) микроорганизмов, неактивен в отношении синегнойной палочки, протея, энтерококков, токсичен. Рабочие растворы часто контаминированны Гр.(-) микроорганизмами. В отношении хлорамина Б в последние годы отмечено снижение фоновой чувствительности к микроорганизмам и появление устойчивых штаммов микроорганизмов, кроме того хлорамин Б оказывает раздражающее действие на ткани в месте его нанесения. Описаны частые случаи контаминации растворов. Многие исследователи отмечают низкую эффективность фурацилина, хлорамина Б и борной кислоты в отношении стафилококков, кишечной палочки, псевдомонад и протея. Фурацилин и хлорамин Б не эффективны и в отношении Гр.(-) микроорганизмов. Еще меньшую эффективность в отношении Гр.(+) и Гр.(-) флоры оказывают асептол, риванол, йодпирон. Хлоргексидин биглюконат более активен в отношении Гр.(+) микроорганизмов, чем Гр.(-), в популяциях бактерий появляются устойчивые варианты к нему. Эффективность его до 1000 раз снижается в присутствии крови и гноя, а также в кислой среде. Хлоргексидин биглюконат вызывает развитие аллергических реакций у лиц с повышенной чувствительностью кожи. Этакридина лактат оказывает бактерицидное действие на Гр.(+) микроорганизмы, особенно стрептококки. В некоторых микробных популяциях, особенно у стафилококков, широко распространены устойчивые варианты. Рабочие растворы этакридина лактата нередко контаминированны Гр.(-) микроорганизмами. Бализ-2 оказывает бактериостатическое действие на стафилококки, менее активен в отношении протея и псевдомонад. Мирамистин действует на Гр.(+) микроорганизмы хуже, чем на Гр.(-) микроорганизмы. Препараты йода обладают рядом негативных свойств, к ним относятся появление йодоустойчивых штаммов бактерий, снижение антимикробных свойств в присутствии гноя, токсичность, аллергичность, окрашивание кожи вследствие глубокой диффузии в ткани, «узость» лечебной активности. Кроме того, длительное применение мешает заживлению швов и ран. [45,51,52]
В настоящее время отмечается значительное распространение среди больничных и внебольничных штаммов-микроорганизмов биологически устойчивых форм к широко применяемым антисептикам. Например, процент устойчивости у стафилококков к фенолу равен 77,4%, натрия лаурату - 64%, хлорамину Б - 58%, борной кислоте - 65,6%, роккалу - 38,7%, цетилперидиний-хлориду - 31,3%, хлоргексидину - 24,4%. У псевдомонад отмечен высокий процент биологически устойчивых форм к хлоргексидину - 39,9%, хлорамину Б - 30,0%, резорцину - 29,0%, этакридину - 25,1%. Среди энтеробактерий биологически устойчивые формы к этакридину выявлены в 99,5% случаев, к резорцину и йодопирону - 27,0%, хлоргексидину - 9,5%. Не произошло снижения уровня чувствительности в результате адаптации к больничным условиям обитания у стафилококка к декамитоксину, сульфацил-натрию, диоксидину, йодопирону, резорцину, у псевдомонад - к сульфацил-натрию, йодопирону, первомуру, у энтеробактерий - к сульфацил-натрию, диоксидину, хлорамину Б, борной кислоте, а также к этонию, цетилпиридиний-хлориду. К роккалу процент биологически устойчивых штаммов среди внебольничных вариантов энтеробактерий выше, чем среди больничных. Повышение уровня устойчивости бактерий произошло не только к тем антисептикам, к которым они обладали видовой чувствительностью, но и к антисептикам, к которым испытанные виды естественно резистентны. [48,50,53]
А.П. Красильниковым в исследованных выборных штаммах золотистого стафилококка, синегнойной палочки и энтеробактерий выявлены не только биологические, но и клинически устойчивые формы. Видовая устойчивость к рабочим концентрациям антисептиков установлена у псевдомонад и энтеробактерий к цетилпиридиний-хлориду, роккалу, этонию, натрию лаурату и натрию лаурилсульфату, этакридину. Приобретенная клиническая устойчивость выявлена у внебольничных штаммов стафилококка к диоксидину - 71,3% испытанных штаммов, натрию лаурату - 34,0%, этакридину - 15,6%; у псевдомонад к хлоргексидину - 46,8% и хлорамину Б - 2,1%; у энтеробактерий к хлорамину Б- 71,9%, к хлоргексидину - 8,3%. Среди больничных штаммов частота клинически устойчивых форм еще выше. Устойчивые формы стафилококков обнаружены к фенолу (76,3%), борной кислоте (30,5%), хлорамину Б (58%), натрию лаурилсульфату (28,7%). У псевдомонад повысился процент клинически устойчивых штаммов к хлоргексидину, диоксидину, хлорамину Б, у энтеробактерий появились устойчивые штаммы к йодопирону.[54,55]
К 90-м гг. XX в. появились публикации о микробной контаминации почти всех используемых в практике медицины типов антисептиков и обнаружении в них представителей всех систематических групп бактерий и грибов. Основным контаминантом антисептиков являются псевдомонады, часто обнаруживаются условно-патогенные энтеробактерий: клебсиеллы, энтеробактер, серратии и эшерихии. В йодофорах, хлорактивных препаратах, перекиси водорода, фура-цилине обнаруживаются золотистые, эпидермальные и сапрофитные стафилококки.[23,45,56]
Внедряемые в клиническую хирургию антисептики йодофоры, декаметоксин, мирамистин, бетадин, ксимедон, куриозин недоступны в настоящее время для широкого круга населения и ЛПУ из-за чрезмерной цены. [43,56]
Вышесказанное определяет необходимость изыскания экономически выгодных высокоэффективных препаратов для лечения инфекционных заболеваний.
2. ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Фуразолидон как антимикробный препарат
N- (5-Нитро-2-фурфурилиден) -З-аминооксазолидон-2
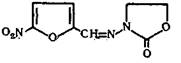
C8 H7 N3 O5 M. в. 225,16
Описание. Желтый или зеленовато-желтый порошок без запаха, слабо горького вкуса. Растворимость. Практически нерастворим в воде и эфире, очень мало растворим в 95% спирте.
Подлинность. 0,05 г препарата смешивают с 20 мл воды и 5 мл 30% раствора едкого натра и нагревают; появляется бурое окрашивание.
0,01 г препарата растворяют в 3 мл (плотность не более 0,945); появляется желтое окрашивание. Прибавляют две капли 1 н. раствора едкого кали в 50% спирте; появляется фиолетовое окрашивание, но на смоченных этим раствором стенках .пробирки окраска раствора синяя. 1 мл фиолетового раствора разбавляют водой до 10 мл; появляется желтое окрашивание. После прибавления нескольких капель 1 н. раствора едкого кали в 50% спирте цвет раствора не меняется.
Температура плавления 253-258° (с разложением).
Посторонние вещества. 0,2 г препарата смешивают с 1 мл воды и 0,5 мл разведенной серной кислоты. Смесь нагревают до кипения и осторожно проверяют запах выделившихся паров; не должно появляться ни запаха бензальдегида, ни запаха уксусной кислоты.
Хлориды. 0,5 г препарата смешивают с 25 мл воды при сильном взбалтывании и фильтруют через двойной фильтр. 10 мл прозрачного фильтрата должны выдерживать испытание на хлориды (не более 0,01% в препарате).
Сульфаты. 10 мл того же фильтрата должны выдерживать испытание на сульфаты (не более 0,05% в препарате).
Потеря в: весе при высушивании. Около 0,5 г препарата (точная навеска) сушат при 100-105° до постоянного веса. Потеря в весе не должна превышать 0,5%.
Сульфатная зола и тяжелые металлы. Сульфатная зола из 0,5 г препарата не должна превышать 0,1% и должна выдерживать испытание на тяжелые металлы (не более 0,001% в препарате).
Мышьяк. 0,5 г препарата должны выдерживать испытание на мышьяк (не более б*,0б01% в препарате).
2.2 Количественное определение фуразолидона
Около 0,1 г препарата (точная навеска) помещают в мерную колбу емкостью 50 мл, прибавляют 30 мл диметилформамида (плотность не более 0,945), закрывают колбу притертой пробкой. После растворения препарата прибавляют 2 мл 0,05 н. спиртового раствора едкого кали, перемешивают, охлаждают до 20°, доводят объем раствора диметилформамидом до метки и опять хорошо перемешивают.
0,6 мл раствора помещают в мерную колбу емкостью 100 мл, доводят объем раствора водой до метки и точно через 20 минут, считая с момента прибавления 0,05 н. спиртового раствора едкого кали, определяют оптическую плотность полученного раствора на фотоэлектроколориметре в кювете с толщиной слоя 0.5 см и фиолетовым светофильтром с длиной волны около 360 нм. Во вторую кювету наливают воду.
Во время проведения опытов температура растворов должна быть 20±1°. Место приготовления растворов не должно быть ярко освещено.
Содержание фуразолидона в процентах (X) вычисляют по следующей формуле:
![]()
где D - оптическая плотность испытуемого раствора;
Е1% см - удельный показатель поглощения стандартного образца фуразолидона, определенный в тех же условиях; а - навеска препарата в граммах. Содержание C8 H7 N3 O5 в пересчете на сухое вещество должно быть не менее 98,0% и не более 102,0%.
2.3 Метод диффузии в агар
Применение новых типов мазевых основ требует строго измерять и контролировать активность мазей. В связи с этим уделяется все больше внимания изучению высвобождения лекарственных веществ из мазевых основ в клинических и фармацевтических исследованиях.
В настоящее время имеется много различных методов по определению высвобождения лекарственных веществ мазевыми основами.
Для оценки процесса высвобождения веществ из мазей и определения их антимикробной активности использовали метод диффузии в агар, описанный в ГФ XI издания.
Исследования проводят в асептических условиях. В качестве тест-культур используют: StaphilococcusaureusATCC6538-P, EscherichiacoliATCC25922, BacillussubtilisATCC 6633, BacilluscereusATCC 10702, PseudomonasaeruginosaATCC9027, CandidaalbicansATCC885-653.
Смесь культур производят стерильным изотоническим растворов натрия хлорида и разводят по стандарту мутности Государственного контрольного института медицинских и биологических препаратов имени Л.А. Тарасевича до образования взвеси с нужной микробной нагрузкой.
Питательную среду (мясо-пептонный агар расплавляют, охлаждают до 40˚ С и вносят в нее соответствующую культуру тест-микроорганизма. Затем разливают в чашки Петри и “подсушивают” в термостате в течении 30 минут при 37˚ С. На поверхность засеянной среды, на равном расстоянии друг от друга и от края чашки расставляют стерильные цилиндры единого размера и массы (высота 10±0,1 мм, внутренний диаметр 6,0±0,1 мм) из нержавеющей стали. В цилиндры каждой чашки помещают равное количество исследуемого образца 0,1 г. Для уменьшения влияний колебаний во времени между внесением мазей и началом термостатирования, чашки выдерживают при комнатной температуре в течении часа. После 18 часов инкубирования при температуре (36±1˚ С) определяют диаметр зон угнетения роста микроорганизмов (мм). Диаметр или ширина зоны торможения характеризует степень диффузии лекарственного вещества из мазевой основы.
2.4 Используемая посуда и оборудование
1) весы аптечные;
2) колба Бунзена;
3) весы торсионные;
4) электромагнитная мешалка;
5) электрическая плитка;
6) конические колбы;
7) фиксированные пипетки;
8) химические стаканы;
9) чашки Петри;
10) водяная баня;
11) сушильный шкаф;
12) воронка Бюхнера;
13) коническая колба;
14) термостат;
15) ножницы;
16) эксикатор;
17) карандаш по стеклу;
18) фарфоровая чашка;
19) пробирки;
20) насос Камовского;
21) цилиндр мерный;
2.5 Используемые химические реактивы и материалы
1) этиловый спирт;
2) метиловый спирт;
3) парафин;
4) фуразлидон;
5) вода дистиллированная;
6) физиологический раствор;
7) сульфат кобальта;
8) тест-культуры;
9) дикаин;
10) глицерин.
3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3.1 Разработка состава и технологии получения мази, содержащей биокомплекс кобальта с фуразолидоном
В работе были использованы химические, физико-химические, микробиологические методы исследования. Комплексные соединения кобальта получали по ранее разработанной методике.
Антимикробная активность фуразолидона и его комплексного соединения кобальта изучалось совместно с кафедрой микробиологии методом диффузии в агар в отношении ряда стандартных микроорганизмов. Полученные результаты представлены в таблице 1.
Таблица 1 - Антимикробная активность фуразолидона и его комплексного соединения с кобальтом
| Основной антимикробный компонент | Диаметр зоны задержки роста тест-штаммов, мм (М±m) | |||
| Staphylococcus aureus ATCC 209-P | Escherichia coli ATCC 25922 | Bacillus subtilis ATCC 6633 | Bacillus cereus ATCC 10702 | |
| Фуразоли-дон | 16,2±0,2 | 16,3±0,2 | 15,8±0,3 | 16,2±0,3 |
| Комплекс кобальта с фуразолидоном | 20,3±0,4 | 24,0±0,5 | 21,3±0,5 | 22,0±0,5 |
Из приведенных видно, что максимальная антимикробная активность наблюдается в случае комплексного соединения кобальта с фуразолидоном, т.е. комплексообразование с лекарственным средством способствует увеличению антимикробной активности фуразолидона.
Для разработки состава и технологии получения антимикробных гелей в качестве гелеобразователя использовались: модифицированное производное целлюлозы - натрийкарбоксиметилцеллюлоза (Na-КМЦ), коллаген и гидрогель метилкремниевой кислоты (энтеросгель), а также эти соединения в различных сочетаниях. В ранее выполненных дипломных работах было установлено, что эти соединения являются хорошими гелеобразующими основами и способны с достаточной скоростью высвобождать лекарственные препараты в водные растворы натрия хлорида, соляной кислоты.
Согласно литературным данным эти основы обладают также большой биосовместимостью и способны с достаточной скоростью высвобождать лекарственные вещества в состав раневого экссудата. Высокая целесообразность в разработке новых способов скорейшего очищения раны от микроорганизмов и продуктов их жизнедеятельности, некротических тканей – общеизвестна. Поэтому целенаправленное устранение девитализированных тканей дренажами и сорбентами, протолитическими ферментами и новыми химическими антисептиками – активно изучается исследователями.
Так как лизированные некротические массы в составе раневого экссудата длительное время остаются в ране и не удаляются, то это препятствует нормализации локального гомеостаза и процессу очищения гнойной раны, а это в свою очередь удлиняет сроки лечения.
В связи с этим в I фазе течения раневого процесса после промывки раны раствором антисептика можно наносить гидрофильные гели и мази, содержащие кроме антимикробных веществ различные сорбенты, в частности, мы предлагаем энтеросгель. В дипломной работе Емельяновой Е. показано, что энтеросгель обладает хорошей сорбционной активностью в отношении St.aureus. Поэтому в продолжение этих исследований для усиления адсорбционного эффекта мы выбрали энтеросгель.
Кроме этого в состав гелей и мазей дополнительно рекомендуется введение коллагена, так как общеизвестны различные ранозаживляющие средства на его основе.
Высвобождение фуразолидона и его комплексного соединения с кобальтом из изучаемых основ проводили методом диализа. В результате проведенных исследований установлено, что эти основы по скорости высвобождения изучаемого комплексного соединения располагаются в следующей последовательности в порядке возрастания:
коллаген –> энтеросгель –> натрийкарбоксиметилцеллюлоза
Концентрация гелеобразующих основ в эксперименте составляет 5%. Количество выделившегося фуразолидона и его комплексного соединения с кобальтом составило около 85-89 % за 3 часа эксперимента. Такое высвобождение может обеспечить пролонгированное действие фуразолидона и его комплексного соединения с кобальтом. Данные по изучению антимикробной активности 5%-ных глицерогелей, содержащих фуразолидон и его биокомплекс представлены в табл. 2-4.
Таблица 2 - Антимикробная активность 5%-го глицерогеля (NaКМЦ), содержащего фуразолидон и его комплексное соединение с кобальтом
| Основной антимикробный компонент геля* | Диаметр зоны задержки роста тест-штаммов, мм (М±m) | |||
| Staphylococcus aureus ATCC 209-P | Escherichia coli ATCC 25922 | Bacillus subtilis ATCC 6633 | Bacillus cereus ATCC 10702 | |
| Фуразолидон | 16,5±0,2 | 16,2±0,2 | 15,5±0,1 | 16,0±0,2 |
| Комплекс кобальта с фуразолидоном | 19,8±0,1 | 23,0±0,1 | 20,3±0,1 | 21,6±0,2 |
*концентрация основного антимикробного компонента в геле 0,5%
Таблица 3 - Антимикробная активность 5%-го глицерогеля коллагена, содержащего фуразолидон и его комплексное соединение с кобальтом
| Основной антимикробный компонент геля* | Диаметр зоны задержки роста тест-штаммов, мм (М±m) | |||
| Staphylococcus aureus ATCC 209-P | Escherichia coli ATCC 25922 | Bacillus subtilis ATCC 6633 | Bacillus cereus ATCC 10702 | |
| Фуразолидон | 15,6±0,2 | 15,5±0,2 | 14,7±0,1 | 15,0±0,2 |
| Комплекс кобальта с фуразолидоном | 18,6±0,1 | 21,8±0,3 | 19,0±0,2 | 20,4±0,2 |
*концентрация основного антимикробного компонента в геле 0,5%
Таблица 4 - Антимикробная активность 5%-го глицерогеля метилкремниевой кислоты, содержащего фуразолидон и его комплексное соединение с кобальтом
| Основной антимикробный компонент геля* | Диаметр зоны задержки роста тест-штаммов, мм (М±m) | |||
| Staphylococcus aureus ATCC 209-P | Escherichia coli ATCC 25922 | Bacillus subtilis ATCC 6633 | Bacillus cereus ATCC 10702 | |
| Фуразолидон | 16,0±0,2 | 16,0±0,2 | 15,0±0,1 | 15,8±0,2 |
| Комплекс кобальта с фуразолидоном | 19,0±0,1 | 22,2±0,3 | 19,8±0,2 | 21,0±0,2 |
*концентрация основного антимикробного компонента в геле 0,5%
Анализ полученных данных показал, что достаточно высокая антимикробная активность комплексного соединения фуразолидона с кобальтом сохраняется и в 5%-ых глицерогелях NaКМЦ, коллагена и энтеросгеля, т.к. диаметр зоны задержки роста в отношении Staphylococcusaureus, Escherichiacoli, Bacillussubtilis, Bacilluscereus больше по сравнению с диаметром задержки роста тест-штаммов в случае использования чистого фуразолидона.
Поскольку одной из важных проблем в стоматологии и хирургии является обезболивание, то нам представлялось интересным включить в полученные гели, кроме антимикробных лекарственных средств и обезболивающие вещества. В качестве анестетика нами был выбран лидокаин.
Составы разработанных гелей представлены в табл. 5,6.
Таблица 5 - Состав
8-09-2015, 22:57
