ОТ МОЛЕКУЛ К КЛЕТКЕ
С давних пор людей интересовало происхождение живой материи. Сегодня многие ученые считают проблему зарождения жизни почти решенной. Им не ясно лишь, что сыграло роль “первой скрипки” нуклеиновые кислоты или белки. Существует немало гипотез, акцентирующих внимание, либо на отборе матриц (ДНК, РНК) в бесферментных условиях, либо на безматричном усовершенствовании древних ферментов. На наш взгляд, главный их недостаток - исключение тех этапов эволюции, которые предшествовали появлению и матриц, и ферментов. В настоящей работе построена полная модель эволюционного перехода от хаоса разнородных органических молекул к феноменальной сложности и упорядоченности клетки.
Около четырех миллиардов лет назад на Земле появились водоемы, в которых образовался так называемый первичный бульон. В нем присутствовали многие органические соединения: аминокислоты, азотистые основания, нуклеотиды, нуклеиновые кислоты, полипептиды и др. Возможность их синтеза под действием УФ-света, электрических разрядов и других энергетических факторов молодой Земли доказана многими экспериментами. Древняя атмосфера не содержала кислород, и пропускала УФ-излучение в области 260 нм. В таких условиях главным критерием отбора молекул первичного бульона была их устойчивость к ультрафиолету, способность не разрушаться при облучении, а сохранять свою структуру и свойства. Важнейшее значение имели внутримолекулярные и межмолекулярные переносы энергии.
В 60-х годах был открыт так называемый триплет-экситонный перенос энергии в нуклеиновых кислотах (ДНК или РНК) под действием УФ-света. Этот процесс начинается, когда одно из азотистых оснований полинуклеотидной цепи поглощает УФ-квант. Оно переходит в возбужденное триплетное состояние, после чего передает энергию соседнему основанию, а само возвращается в невозбужденное состояние. Перенос энергии по цепи идет при строгом соответствии квантовых свойств соседних оснований и оптимальных расстояниях между ними. Он продолжается до какого-либо нарушения однородной первичной структуры макромолекулы (модифицированного основания, перегиба цепи и др.), где энергия может высвободиться. Экспериментально доказано, что деструкции РНК происходят не в точках поглощения УФ-квантов, а в участках с внутренней предрасположенностью.
Для нас важно, что триплет-экситонный перенос успешно идет в биологической РНК, состоящей из стандартного набора 4-х азотистых оснований, соединенных 3'-5'-связями. В древних водоемах имелись разнородные нуклеиновые кислоты, изначально не обладавшие упорядоченной структурой. При УФ-поглощениях те фрагменты, в которых шел триплет-экситонный перенос, сохранялись, другие изменялись. Происходила селекция макромолекул, подобных биологическим.
Ясно, что при интенсивном УФ-облучении устойчивость РНК зависела не только от внутримолекулярных переносов, но и от передачи энергии вовне. Здесь требовались индуктивно-резонансные взаимодействия с какими-либо молекулами-акцепторами. Для них важно, чтобы дистанция донора энергии и акцептора не превышала некую пороговую величину (около 100А), а спектральная полоса флюоресценции донора перекрывалась с полосой поглощения акцептора. Подходящие спектральные полосы имели многие органические соединения первичного бульона. Но их использованию в качестве акцепторов индуктивно-резонансного переноса мешала удаленность от УФ-активированных РНК.
В живых клетках контакты молекул-доноров с молекулами-акцепторами обеспечивают специальные биокатализаторы - ферменты. Они состоят из синтезированных матричным путем полипептидов, сопряженных с некоторыми другими химическими группировками. Ферменты очень недолговечны. Их полипептидные компоненты должны постоянное обновляться.
В первичном бульоне без матричного синтеза не могло быть подлинных ферментов, но имелись "дикие" полипептиды, которые при определенных условиях выполняли ту же роль. Рассмотрим два варианта их взаимодействий с РНК, поглощающей УФ-кванты. 1. Полипептид сам служит акцептором индуктивно-резонансных переносов энергии. При этом его структура меняется. 2. Полипептид связывает определенную молекулу (субстрат) и удерживает ее в зоне индуктивно-резонансного переноса в качестве акцептора энергии. В этом случае он становится аналогом фермента (проферментом) и вместе с РНК образует нуклеопротеидный комплекс, осуществляющий фотокатализ (Рис. 1). Особую конформацию, позволяющую связывать конкретный субстрат, профермент приобретал стихийно в ходе взаимодействий первого типа. Вместе с субстратной специфичностью он получал важное селективное преимущество - устойчивость при взаимодействиях второго типа. Потеряв ее, он возвращался к роли акцептора энергии и вновь подвергался изменениям.
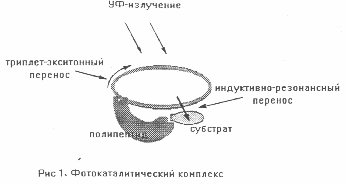
Одним из важнейших свойств живой материи является динамичность. В клетках постоянно идет распад и самосборка многих функциональных компонентов цитоплазмы. Здесь важную роль играют метастабильные межмолекулярные связи, возникающие при диссипации энергии в ходе биокатализа. Древние молекулярных комплексы также имели метастабильные связи. Ночью в отсутствии УФ-излучения они распадались, днем повторяли самосборку. Такая цикличность, подчиненная суточному ритму, усиливала изменчивость РНК и полипептидов, ускоряла отбор, что было необходимым условием эволюции. Сборка комплексов зависела от расположения их компонентов в водной среде, от ориентации к потоку УФ-света. Мы предположили, что большое селективное преимущество давало их соединение в пленку, состоящую из многих УФ-поглощающих, субстратсвязующих и соединительных элементов. Роль последних могли выполнять фосфолипиды, отличающиеся стабильностью и способностью спонтанно образовывать пленочную структуру.
Успешность самосборок метастабильных комплексов в пленку в большой степени зависела от свойств их УФ-поглощающих компонентов. Мы предположили, что приоритет имели РНК с кольцеобразной вторичной структурой. Дело в том, что в кольце РНК при интенсивном УФ-облучении идет циркуляция экситонных переносов, удлиняющая время взаимодействия с акцептором. Энергия нескольких УФ-квантов может суммироваться и передаваться акцептору импульсами, зависящими от размера кольца. В этом случае кольцо РНК играет роль накопительной антенны, а индуктивно-резонансный перенос приобретает характер автоколебаний. Равные кольца имеют равную энерговооруженность. На заре абиогенеза циркуляция энергии в однотипных РНК давала им преимущество при сборке фотокаталитических комплексов. Прочие полинуклеотиды оставались вне комплексов. Поглощая УФ-излучение, они подвергались деструкции.
Итак, на первом этапе абиогенеза под давлением УФ-света шла селекция макромолекул и формировались пленки, осуществлявшие фотокатализ. Для них он стал не разрушителем, а необходимым источником устойчивости. Чтобы проверить эту гипотезу нужны специальные экспериментальные исследования, которые позволят, во-первых, конкретизировать условия отбора нуклеиновых кислот и пептидов по критерию УФ-устойчивости, во-вторых, уточнить состав первичного бульона.
2
Молекулярные пленки расселялись в древних водоемах. Если они располагались в несколько слоев, только верхние поглощали ультрафиолет и сохраняли устойчивость. Нижние были закрыты от УФ-света, испытывали дефицит энергии и распадались. Для их устойчивости требовались иные механизмы преобразования и переноса энергии.
У всех автотрофных организмов есть системы фотофосфорилирования, превращающие энергию видимого света в химическую энергию молекул-макроэргов: АТФ, ГТФ и др. Известны два варианта таких систем. В одном из них в качестве первичного поглотителя света используется хлорофилл, в другом - бактериородопсин. При всех своих отличиях, и тот, и другой имеют столь сложную организацию, что не могут обходится без ферментов, синтезированных матричным путем. На заре абиогенеза матричный синтез не существовал. Но, т.к. вместо видимого света использовался более богатый энергией ультрафиолет, фосфорилирование было организовано значительно проще современного. Мы предположили, что его осуществляли фотокаталитические комплексы, появившиеся еще на первом этапе. Их субстратсвязующие компоненты приобрели сродство с АДФ, ГДФ и т.п. Для синтеза АТФ и ГТФ путем присоединения неорганического фосфата они использовали энергию УФ-квантов, поглощенных РНК.
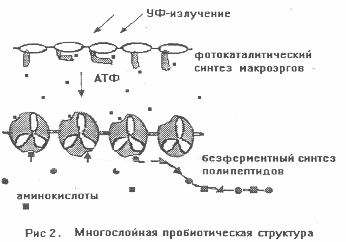
В многослойных пробиотических структурах УФ-зависимое фосфорилирование могло идти только в верхних слоях. Нижним требовалась химическая энергия АТФ и подобных молекул. Энергоснабжение, основанное на диффузии макроэргов из верхних слоев в нижние, создало предпосылки для бурного роста пробиотических пленок. (Рис. 2) Но очередным препятствием стало низкое содержание в водной среде строительных материалов, особенно полипептидов. Следовательно, дальнейшие перспективы абиогенеза зависели от способности самих пробионтов их синтезировать.
Живые клетки синтезируют полипептиды из аминокислот матричным путем с использованием многих ферментов, а источником энергии служит АТФ. На втором этапе абиогенеза еще не было ферментов, и пробионты не могли освоить матричный синтез. Но в них уже производились макроэрги типа АТФ, и это позволило начать безматричную полимеризацию аминокислот. У живых клеток в состав молекулярных комплексов, связывающих аминокислоты (рибосом и тРНК), входят цепочки РНК типа "клеверный лист", имеющие кольцеобразные и спиралевидные участки вторичной структуры. В эпоху многослойных пленок полинуклеотиды с таким сложным строением разрушались в верхних УФ-поглощающих слоях, но могли появляться в нижних, защищенных от ультрафиолета. Там они стали частью новых нуклеопротеидных комплексов - предков тРНК, которые связывали аминокислоты, используя энергию от гидролиза АТФ. Происходил безматричный синтез полипептидов, давший пробионтам важное селективное преимущество - постоянное снабжение макромолекулярным сырьем. На этом этапе очередность аминокислот в полипептидах не имела решающего значения.
Второй этап абиогенеза привел к появлению у пробионтов функциональной дифференцировки субструктур. Возникло автономное энергоснабжение и безматричный синтеза макромолекул. Затенение нижних слоев из помехи превратилось в обязательное условие устойчивости.
3
Если на первом этапе абиогенеза отбор нуклеиновых кислот был подчинен селективному давлению УФ-света, то уже на втором понадобились молекулы РНК со сложной вторичной структурой, требующие защиты от УФ-света. Их массовое воспроизводство было невозможно без матричного синтеза.
Во всех живых клетках молекулы РНК синтезируются на матрицах ДНК при участии многих ферментов. Этот процесс называется - транскрипция. Она начинается с разделения двух цепей спирали ДНК. После чего одна из них служит матрицей для синтеза РНК, а на другой воспроизводится парная (комплементарная) ДНК. Это позволяет повторно копировать ее информацию. Известно, что синтез РНК и ДНК идет при разных значениях pH водной среды. Кроме того уменьшение pH инициирует разделение двух цепей ДНК.
Предпосылками для появления транскрипции у пробионтов было то, что в них уже производились молекулы АТФ и другие макроэрги, из которых синтезируются ДНК и РНК. Вполне могли появиться двухцепочечные фрагменты ДНК - будущий матричный материал. Но поскольку еще не было ферментов, требовались другие факторы, управляющие разделением двух цепей ДНК, синтезом РНК и восстановлением спаренной ДНК.
Мы предположили, что решающим фактором стало различие pH в соседних участках внутренней среды пробионта - так называемая компартментализация. Причиной параметрического различия сред был перенос протонов через каталитически активные пленки. (Аналогичные процессы в живых клетках - трансмембранные протонные переносы открыл английский ученый П.Митчел.) В одном из компартментов пробионта создавались условия, благоприятные для синтеза РНК, а в другом - ДНК. Транскрипция начиналась с рассоединения двойной спирали ДНК и переноса одной из ее цепей через мембрану, разделяющую две среды. Эта цепь становилась матрицей для синтеза РНК, а другая оставалась в прежнем компартменте и служила матрицей для восстановления парной ДНК (Рис. 3). Можно предположить, что и у живых клеток важным условием транскрипции служит компартментализация при переносе протонов через мембрану, содержащую рибосомы.
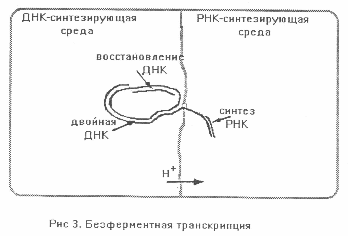
На третьем этапе абиогенеза благодаря матричному синтезу произошло наращивание генетического материала ДНК, количественное и качественное усовершенствование РНК. Возникла согласованность многих каталитических процессов и открылись новые перспективы усложнения пробионтов.
4
Так как УФ-энергия поступала только днем, ночью пробионты теряли активность и распадались, а каждое утро рождались заново. Это стало очередным эволюционным препятствием, для преодоления которого на последнем этапе абиогенеза нужны были принципиально новые “ночные” системы энергоснабжения. Как известно, у многих бактерий основой энергетики является гликолиз. Энергия, высвобождающаяся от частичного окисления некоторых органических соединений, направляется на фосфорилирование, т.е. на синтез АТФ и других макроэргов. Различные варианты подобного окислительного фосфорилирования служат важной частью энергоснабжения всех живых клеток.
Для перехода от ежедневных циклов ассимиляции и распада у пробионтов к круглосуточной жизни клетки требовался процесс, подобный гликолизу, направляющий химическую энергию органических молекул на синтез АТФ. Известно, что без ферментов он невозможен, т.к. доминирует обратный процесс - гидролиз АТФ. Ферменты образуются только из полипептидов, синтезированных матричным путем. Следовательно, зарождению первых клеток должен был предшествовать матричный синтез полипептидов.
В пробионтах уже существовали молекулярные системы безматричного синтеза полипептидов и матричного синтеза РНК. Имелись нуклеопротеидные комплексы, обладающие сродством с аминокислотами - предшественники тРНК. Оставалось преодолеть очередной эволюционный барьер - создать генетический код. Первоначально он мог быть значительно проще современного. Даже грубое кодирование основных типов аминокислот сказывалось на свойствах синтезированных макромолекул и, тем самым, давало пробионтам огромные селективные преимущества. Первые аналоги рибосом могли представлять собой относительно простые нуклеопротеидные комплексы, в которых контроль кодон-антикодонового соответствия иРНК и тРНК шел за счет переносов энергии при их контактах. Возможно, следы этих микропроцессов проявляются в работе рибосом всех живых клеток и могут быть выявлены экспериментально.
Попытки матричного синтеза полипептидов продолжались долгое время, не оказывая существенного влияния на эволюцию пробионтов. Но как только были синтезированы первые молекулы, способные связать какую-либо окислительную реакцию с фосфорилированием, матричные процессы приобрели огромную селективную ценность. Пробионты перешли в режим круглосуточной активности. Главным критерием отбора стало качество синтезируемых ферментов, их влияние на производство АТФ. Можно предположить, что первые ферменты катализировали окисление сахарного альдегида в фосфоглицериновую кислоту, сопряженное с переносом неорганического фосфата на АДФ. Позже по мере истощения запасов органики в первичном бульоне, цепочки ферментативного окислительного фосфорилирования удлинялись.
На этом этапе могли возникнуть так называемые гиперциклические сети каталитических реакций, значительно ускорившие эволюцию. Их описал немецкий ученый М.Эйген. Гиперциклы стали возможны благодаря круглосуточному энергоснабжению. Они обеспечили быстрое увеличение генетического материала, усовершенствование матричных процессов, рост арсенала ферментов. Сформировались системы ферментативного биосинтеза аминокислот, пигментов, полисахаридов; образовались клеточные оболочки, цитоплазматические мембраны, рибосомы и т.д. Пробионты превратились в живые клетки.
| Этапы | Факторы селективного давления | Эволюция структур | Эволюция функций |
| 1 | УФ-излучение. | Нуклеопротеидные комплексы. Молекулярные пленки. | Фотокатализ. |
| 2 | Неравномерность УФ-света в пространстве (затенение). | Многослойные пробиотические структуры. | Фотофосфорилирование. Безматричный синтез полипептидов. |
| 3 | Недостаток макромолекулярного сырья в среде. | Пробионты с неоднородной внутренней средой. | Матричный синтез РНК и ДНК. |
| 4 | Неравномерность УФ-света во времени (суточный ритм). | Первые клетки. | Матричный синтез полипептидов. Окислительное фосфорилирование. |
Таблица. Этапы абиогенеза.
Итак, путь от молекулярного хаоса первичного бульона к первым живым клеткам включал четыре эволюционных этапа. На каждом действовали новые деструктурирующие факторы, создававшие селективное давление. Поэтапная смена источников селекции вызывала переход пробионтов от одного уровня устойчивости к следующему. Финал предбиологической эволюции стал началом эры развития жизни на Земле.
Автор М.Каценберг
29-04-2015, 01:58
