Несеребряные изображения из металлохелатов
В принципе такого сокращения можно достигнуть двумя путями. Первый из них, в последние годы широко распространившийся, сводится к изготовлению галогенсеребряных фотоматериалов со сниженным удельным содержанием серебра. В этом случае либо используют микрокристаллы AgHal с повышенной чувствительностью к тому или иному виду излучения, либо - что проще - увеличивают дисперсность элементного серебра в полученном после стандартной процедуры (проявления и фиксирования) изображении. Но вот беда - содержащееся в нем серебро остается у потребителя и фактически безвозвратно теряется. Более того, зачастую уменьшенное содержание серебра в таких фотоматериалах вызывает снижение чувствительности к излучениям отдельных видов, прежде всего - ионизирующих.
Указанных недостатков можно избежать, если пойти по другому пути - регенерировать серебро, извлекать его из уже полученного изображения. Достигается это такой химической обработкой, в ходе которой содержащееся в нем элементное серебро заменяется тем или иным интенсивно окрашенным соединением, а само переходит в какой-либо из применяемых растворов, откуда может быть извлечено и вновь направлено в производство. В настоящее время уже широко распространился вариант регенерации серебра с образованием несеребряных изображений из органических красителей. Это не что иное, как хорошо знакомая читателю цветная фотография. Однако все такие красители имеют один “генетический” порок - они малоустойчивы к действию света и агрессивных агентов окружающей среды, а потому изображения сравнительно быстро выцветают. (Пример подобного процесса можно было воочию наблюдать в 80-е годы в Москве на Ленинградском вокзале: висевшее в его северной части, рядом с перроном, яркое фотопанно с изображением экспресса ЭР-200 полностью выцвело всего за каких-то три-четыре года. И это несмотря на то, что оно не подвергалось действию прямого солнечного света!)
Такой порок можно устранить, если в качестве носителей фотоизображения использовать металлохелаты - своеобразную и интересную группу координационных соединений ионов разных металлов с органическими реагентами. Металлохелаты достойны пристального внимания и сами по себе, но здесь мы ограничимся лишь применением их в фотографии. В обширном мире разных несеребряных изображений те, что получают на основе металлохелатов не имеют аналогов как по своим оптическим характеристикам, так и по способам формирования. Столь необычные носители фотоизображений вполне заслуживают специального обсуждения, тем более что до начала наших работ химико-фотографической науке они вообще не были известны.
Для химической обработки галогенсеребряных фотоматериалов используется немало реагентов, которые переводят находящееся в изображении элементное серебро в одно из его соединений - обычно в галогенид AgHal или гексацианоферрат(II) Ag4 [Fe(CN)6 ]. Одновременно с этим в фотослое осаждаются другие металлсодержащие вещества. В состав наиболее известных реагентов, применяемых для тонирования, входят гексацианоферрат(III) калия K3 [Fe(CN)6 ], растворимая соль 3d-элемента (как правило, хлорид или сульфат) и дикарбоновая кислота (обычно щавелевая) или оксикислота (например лимонная или винная). При обработке уже сформированного после проявления и фиксирования серебряного изображения такими реагентами в фотослое образуется смесь гексацианоферрата(II) того металла, который присутствовал в тонирующем растворе, и соединения серебра - AgHal или Ag4 [Fe(CN)6 ]. Тиосульфатом натрия Na2 S2 O3 (хорошо знакомым фотолюбителям фиксажем) можно затем перевести как AgHal, так и Ag4 [Fe(CN)6 ] в растворимое соединение Na3 [Ag(S2 O3 )2 ] и тем самым полностью удалить серебро. Металлгексацианоферрат(II) (МГФ) при этом остается в фотослое, поскольку с Na2 S2 O3 не взаимодействует. Дальнейшей обработкой фотослоя раствором, содержащим хелатобразующий агент, удается трансформировать МГФ в соответствующий металлохелат, который и станет носителем несеребряного изображения.
Процесс его образования, как видно из сказанного, состоит из трех этапов. Химические реакции, протекающие на первых двух, имеют некаталитический характер, и при исчерпывающей полноте их проведения количество образующегося в слое металлгексацианоферрата(II) определяется исключительно исходным содержанием серебра. Третий же этап - это не что иное, как процесс комплексообразования, поэтому количество металлохелата как носителя несеребряного фотографического изображения (и соответственно его оптическая плотность D') будет зависеть от содержания МГФ в фотослое, природы и концентрации хелатобразующего агента, температуры и времени реакции. Варьируя эти параметры, можно в очень широких пределах (на порядок и даже более) изменять фотографические характеристики, в том числе чувствительность к излучению, одного и того же галогенсеребряного материала. Именно третий этап и оказывается решающим в формировании оптических показателей фотоизображения. Важное значение имеет также растворимость металлохелата в воде: она должна быть довольно низкой, чтобы это соединение не вымывалось из фотослоя, в противном случае изображение будет разрушаться.
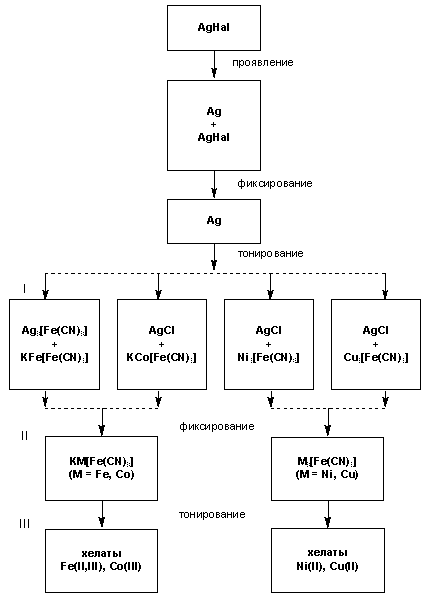
Общая схема формирования металлохелатных фотоизображений на галогенсеребряных фотоматериалах.
Римскими цифрами указаны стадии образования хелатов.
Методика получения металлохелатных изображений, как можно заметить, в принципе-то весьма нехитрая. Почему же они до начала наших работ фактически оставались вне поля зрения исследователей? Об этом остается только гадать.
Наиболее известный металлохелат, интенсивность окраски которого достаточно высока для построения несеребряного изображения, - комплекс двухвалентного никеля Ni c диметилглиоксимом (этот комплекс, кстати, входит в состав губной помады как красящий компонент). На первом этапе проявленный и закрепленный галогенсеребряный фотоматериал (т.е. готовый серебряный снимок) обрабатывают раствором, содержащим комплекс никеля с лимонной кислотой, гексацианоферрат(III)- и хлорид-анионы. Из образующихся в результате соединений только два - гексацианоферрат(II) никеля и хлорид серебра - не растворимы в воде. Именно они и остаются в фотослое, другие же удаляются в процессе промывки, а за счет последующего воздействия тиосульфата натрия извлекается и AgCl. И наконец, на третьей стадии содержащийся в фотослое гексацианоферрат никеля вступает в реакцию с диметилглиоксимом и образует хелат - бис(диметилдиоксимато)никель.
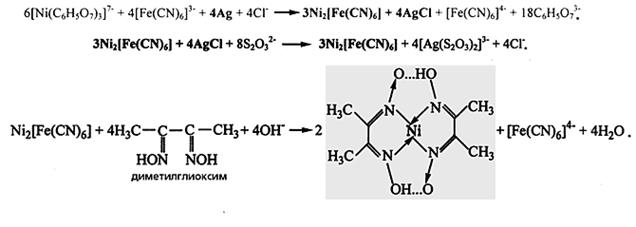
Схема реакций, приводящих к образованию хелатного соединения на основе двухвалентного никеля с диметилглиоксимом. Обработкой исходного серебряного снимка раствором, содержащим комплекс никеля с лимонной кислотой, гексацианоферрат(III)- и хлорид-анионы, элементное серебро переводится в AgCl, которое после взаимодействия с тиосульфатом натрия Na2 S2 O3 превращается в растворимое соединение и вымывается из фотослоя. Оставшийся в нем гексацианоферрат никеля вступает в реакцию с диметилглиоксимом и образуется металлохелат - носитель несеребряного изображения розово-красного цвета. Соединения, остающиеся в фотослое, выделены жирным шрифтом.
Полученное в итоге несеребряное изображение окрашено в розово-красный цвет и имеет бо льшую оптическую плотность D', по сравнению с первоначальной серебряной DAg . Значения D' монотонно нарастают по мере увеличения концентрации диметилглиоксима и продолжительности реакции и зависят от DAg . Подобная зависимость D' = f(DAg ) сохраняется неизменной для любой концентрации этого органического реагента, а нередко и при образовании хелатов никеля с другими соединениями - различными аналогами диметилглиоксима, а также с производными 8-меркаптохинолина. Бывает, однако, что не так просто и получить металлохелатные изображения, и описать процесс формирования оптической плотности. Наиболее яркий тому пример - изображения из хелатов Ni c дитиооксамидом.
Первые две стадии их получения такие же, как для бис(диметилдиоксимато)никеля. А вот заключительный, третий, этап гораздо сложнее, поскольку в ходе его образуется как минимум пять разных координационных соединений, причем четыре из них трудно растворимы в воде и потому могут формировать металлохелатное изображение. С увеличением продолжительности этой стадии оптические плотности вначале растут, достигают некоторых максимальных значений и затем падают. Время же, необходимое для получения максимальной оптической плотности при любой заданной DAg , с ростом концентрации дитиооксамида сокращается, но если она очень высока (0.1 моль/л и более), изображение… вообще не образуется (!!!).
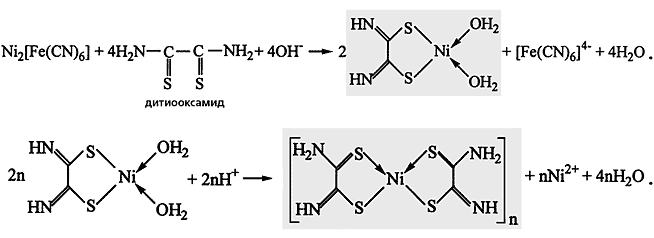
Заключительная стадия синтеза хелата никеля с дитиооксамидом. Образовавшийся вначале металлохелат розово-фиолетовой окраски при подкислении раствора превращается в новое координационное соединение другого цвета - голубого или синего.
Сей парадокс связан с тем, что увеличение концентрации дитиооксамида усиливает тенденцию к образованию растворимых комплексов, которые легко диффундируют из фотослоя в раствор. Интересно, что если полученный таким образом снимок выдержать в каком-либо кислом растворе (рН 5 или менее), первоначальная розово-фиолетовая окраска почти моментально изменится на голубую или синюю, так как исходный хелат трансформируется в другое координационное соединение.
Следует отметить, что это свойство можно использовать для изготовления так называемых синих слайдов, которые предпочтительнее традиционных, ибо имеют гораздо более высокую чистоту светлых линий, четкость и контрастность изображения. К тому же диапазон варьирования оптической плотности D' таких слайдов при одной и той же DAg значительно шире, а это далеко не последнее качество.
Если розово-фиолетовые, голубые и синие изображения образуются никелевыми хелатами, то темно-зеленые - хелатом из дитиооксамида с двухвалентной медью, а янтарно-желтые - с трехвалентным кобальтом. Обработка исходного серебряного снимка та же, трехстадийная.
Чтобы получить хелатные соединения меди, на первом этапе используют комплекс Cu(II) со щавелевой кислотой, уже упоминавшийся ион [Fe(CN)6 ]3- и карбонат-анион. Для образования кобальтового хелата нужен комплекс кобальта с лимонной кислотой, гексацианоферрат- и хлорид-анионы.
Третья стадия процесса протекает по одной и той же схеме, если судить только по суммарным уравнениям реакций. Однако они далеко не отражают всей сложности химического процесса, благодаря которому формируются изображения на основе хелатов меди и кобальта. Наглядное тому свидетельство - необычное изменение оптической плотности несеребряного снимка из хелатов Co c дитиооксамидом: с ростом DAg она не увеличивается, как следовало бы ожидать, а, напротив, уменьшается. Феномен в фотографической практике уникальный!
Конечно, никакого чуда тут нет: просто несеребряное изображение состоит не из одного компонента, как в случае никелевого хелата c диметилглиоксимом, а не менее чем из трех, к тому же оптическая плотность одного из них гораздо ниже, чем двух других. Интересно было бы детально обсудить протекающие при этом процессы - прямо скажем, весьма мудреные! - и объяснить только что указанный феномен, но, к сожалению, в небольшой статье этого не сделаешь. Отмечу лишь, что возможна ситуация (для какой-то определенной концентрации дитиооксамида и заданного времени реакции), когда при более высокой плотности исходного серебряного изображения мольная доля хелатного компонента со слабым поглощением окажется значительно больше, чем таковая при меньшей величине DAg
. Именно благодаря этому и появляются минимумы на отдельных кривых D' = f(DAg
).
 |
 |
 |
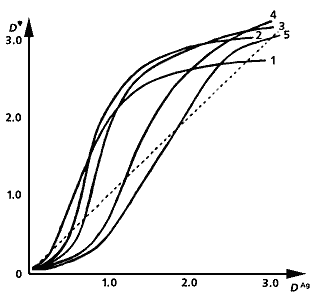 |
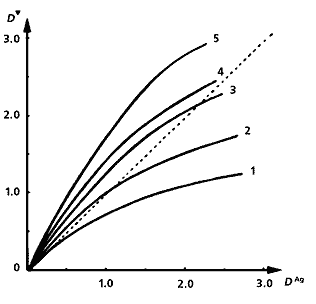
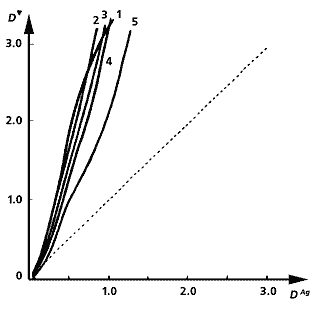
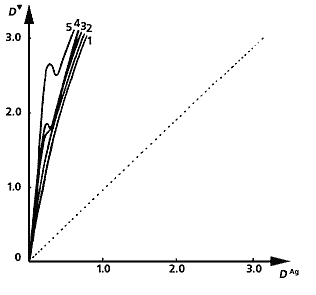
Несеребряные изображения, полученные из металлохелатов. Под каждой фотографией приведен график зависимости оптической плотности хелатного изображения D' от оптической плотности первоначального серебряного снимка DAg при разной длительности третьей стадии процесса - образования металлохелатного соединения. Слева направо: изображение из хелата никеля с диметилглиоксимом (его концентрация - 5·10-2 моль/л); из хелата никеля с дитиооксамидом (концентрация - 2·10-2 моль/л.); изображение, полученное из хелата меди с дитиооксамидом (2·10-2 моль/л); из хелатного соединения кобальта с тем же реагентом (концентрация - 8·10-3 моль/л). Оптические плотности измерены за зеленым, желтым, красным и синим светофильтрами, соответственно. Длительность третьей стадии процесса: 1 мин (1), 2 (2). 4 (3), 6 (4), 10 мин (5). Процесс образования хелата (D') усиливается или ослабляется, по сравнению с исходным изображением (DAg ; штриховая прямая), в зависимости от того, сколько времени продолжается третья стадия.
С практической точки зрения, безусловно, наиболее ценными в качестве носителей несеребряных изображений были бы хелаты двух- или трехвалентного железа - наиболее дешевого и доступного металла среди всех других. Их применение в подобном качестве, однако, ограничивается тем, что в большинстве своем они сравнительно мало устойчивы и довольно-таки растворимы в воде, да и поглощение ими света в видимой области спектра невелико. Вот почему ассортимент хелатов железа, пригодных для формирования фотографических изображений, весьма невелик: в настоящее время это лишь хелаты Fe(II) c 8-гидроксихинолинами и Fe(III) с 8-меркаптохинолинами.
Чтобы получить такие снимки, сначала исходное серебряное изображение выдерживают в растворе, содержащем “смешанный” (на языке современной координационной химии - гетеролигандный) комплекс трехвалентного железа с лимонной и винной кислотами и все тот же ион [Fe(CN)6 ]3- , в результате чего образуется металлгексацианоферрат - промежуточное несеребряное изображение синего цвета. За счет последующего взаимодействия этого МГФ с 8-гидроксихинолином синтезируется металлохелатное соединение - носитель окончательного серовато-черного изображения. Цветом оно похоже на первоначальное серебряное, но оптические плотности D' его в целом выше. В ходе процесса образуется преимущественно лишь одно соединение - бис(оксинато)железо(II), поэтому не удивительно, что оптические плотности D' монотонно нарастают по мере увеличения DAg . Если для синтеза металлохелата использовать 8-меркаптохинолин, промежуточного изображения не будет, так как двухвалентное железо в координационном соединении под воздействием атмосферного кислорода сразу же окисляется в трехвалентное. Полученная в итоге фотография имеет различные оттенки красно-коричневого цвета.
Вне всякого сомнения, носителями фотоизображения могут быть и хелаты других ионов металлов, в частности Ti(IV), Cr(III), Mn(III), Zn(II), Sn(II). Сие, однако, экспериментально никем (в том числе и автором этих строк) пока не подтверждено, так что их синтез и детальное изучение еще впереди. Увеличение ассортимента металлохелатных изображений достижимо и другим путем - за счет химических реакций иных типов: электрофильного замещения, темплатного синтеза, присоединения p-акцепторных соединений и др. Все это - настоящая золотая (во всяком случае - серебряная, причем в буквальном, а не в переносном смысле!) жила научной фотографии, которая вполне заслуживает целенаправленных поисков.
 |
 |
 |
 |
Cхема синтеза хелатного соединения на основе двухвалентного железа с 8-гидроксихинолином. Конечный продукт этих реакций - бис(оксинато)железо(II) - окрашен в серовато-черный цвет.
Остается сказать в заключение, что несеребряные изображения из металлохелатов в принципе можно получить и более простым способом - проявить экспонированный галогенсеребряный фотоматериал, промыть его и далее провести положенные три стадии процесса, который заканчивается образованием металлохелата. Таким образом, удается разом “убить двух зайцев”: сократить время получения несеребряного изображения и сделать более эффективным протекающее на первом этапе окисление элементного серебра, содержащегося в фотослое.
В незапамятные времена человек, истребив мамонтов, поневоле вынужден был всерьез заняться разведением домашнего скота, дабы хоть как-то удовлетворить свои насущные потребности в мясной пище. Подобным же образом нарастающая угроза “серебряного голода” в фотографии заставляет ее искать новые методы записи информации, где роль серебра сведена к минимуму. И кто знает, не окажутся ли те самые несеребряные изображения, о которых шла речь, хоть каким-то да подспорьем в создании принципиально нового вида фотографии вообще и цветной, в частности.
Работа выполнена при поддержке Российского фонда фундаментальных исследований. Проект 96-03-32112.
Литература
Михайлов О.В. // Журн. научн. и прикл. фотогр. и кинематогр. 1991. Т.36 №4. С.344–355.
Mikhailov O.V. // J. Coord. Chem. 1999. V.47. №1. P.31–58.
Mikhailov O.V., Khamitova A.I., Kazymova M.A.
// Journ. of Soc. of Photogr. Science and Technology of Japan. 1998. V.61. №6. P.387–393.
29-04-2015, 01:59
