2.6. КРУГООБОРОТЫ ВЕЩЕСТВ В БИОСФЕРЕ
Основой динамического равновесия и стойкости биосферы является кругооборот веществ и превращения энергии, который состоит из многообразных процессов. Хорошо известны глобальные процессы кругооборота воды, кислорода, углерода, азота, фосфора, микроэлементов на Земле. В.Р. Вильямс писал, что единственный способ придать чему-то конечному свойства бесконечного – это заставить конечное вращаться по замкнутой кривой, то есть вовлечь его в кругооборот. В этом высказывании есть доля философского и религиозного понимания сути кругооборотов веществ и превращения энергии. Выделяют два основных кругооборота: большой (геологический ) и малый (биологический). Геологический кругооборот веществ имеет наибольшую скорость в горизонтальном направлении между сушей и морем. Смысл большого кругооборота в том, что горные породы подвергаются разрушению, выветриванию, а продукты выветривания, в том числе растворимые в воде питательные вещества, сносятся потоками воды в Мировой океан с образованием морских напластований и возвращаются на сушу лишь частично, например, с осадками или с извлеченными человеком из воды организмами. Далее в течение длительного временного отрезка протекают медленные геотектонические изменения – движение материков, поднятие и опускание морского дна, вулканические извержения и т.д., в результате которых образовавшиеся напластования возвращаются на сушу и процесс начинается вновь. Малый кругооборот , являясь частью большого, происходит на уровне биогеоценоза. Он состоит в том, что питательные вещества почвы, вода, CO2 и другие вещества из атмосферы за счет фотосинтеза аккумулируются в веществе продуцентов (растений и некоторых бактерий), расходуются на построение тел и жизненные (обменные) процессы продуцентов и консументов. Затем в основном за счет редуцентов органические вещества разлагаются и частью минерализуются, вновь становятся доступными растениям и снова ими вовлекаются в поток вещества (кругооборот). Скорость перемещения веществ при биологическом кругообороте значительно выше, чем при геологическом. Кругооборот (перемещение) химических веществ из неорганической среды через растительные и животные организмы обратно в неорганическую среду с использованием солнечной энергии с протеканием биохимических превращений (реакций) носит название биогеохимического цикла . Годичные биогеохимические циклы приводят в движение примерно 480 млрд т веществ, в основном биофильных элементов – углерода, азота, водорода, кислорода и др.
2.6.1. Кругооборот углерода
![]() Этот кругооборот, как и большая часть других кругооборотов, может быть представлен в виде упрощенной схемы (рис. 2.5.):
Этот кругооборот, как и большая часть других кругооборотов, может быть представлен в виде упрощенной схемы (рис. 2.5.):
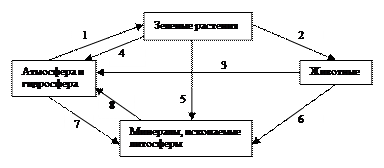
Рис. 2.5. Кругооборот углерода
Кругооборот углерода, как и любого другого элемента, совершается как по большому, так и по малому циклам.
Большой (геологический) кругооборот углерода можно представить в виде схемы (рис. 2. 6.).
В атмосфере и водных источниках присутствует углекислый газ СО2 . Под его действием, а также при участии ветра и воды (Н2 О) частью изменяется состав горных пород (например, карбонатных: известняка СаСО3 , магнезита МgCO3 , доломита СаСО3 ×МgCO3 ):
СаСО3 + СО2 + Н2 О ® Са(НСО3 )2
МgCO3 + СО2 + Н2 О ® Мg(НСО3 )2 .
Образующиеся растворимые соли (гидрокарбонаты) вымываются и выносятся в океан, частью насыщает воду океана. Частью же под воздействием неорганических условий и фильтрации воды через живые организмы (например, моллюски) эта соль преобразуется и отлагается на дне океана в виде осадочных пород (того же, например, СаСО3 , частью представленного в виде ракушечника, как остатки раковин умерших моллюсков) (пункты 6, 7 рис. 2.5.). Осадочные породы претерпевают метаморфоз (различные превращения), а также под действием тектонических сил перемещаются в глубину земной коры, откуда частью через длительный период поднимаются на поверхность, а быстрее идут процессы под действием вулканических извержений, которые являются вновь источниками углерода в атмосфере в виде СО2 , а иногда и СО, окисляющегося до СО2 .
Биотический кругооборот углерода – составная часть большого кругооборота, он связан с жизнедеятельностью организмов.
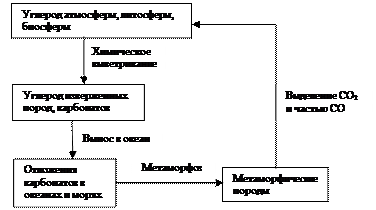
Рис. 2.6. Большой (геологический) кругооборот углерода
Запасы углерода, содержащегося в виде СО2 , в атмосфере составляют 23,5×1011 т. Органическое вещество синтезируется зелеными растениями из СО2 атмосферы (пункт 1, рис. 2.5.), содержание которого там лишь 0,03 – 0,04 % (табл.2.8), а затем вместе с веществом растений (продуцентов) потребляется консументами разных трофических уровней (пункт 2, рис. 2.5.).
Синтез органических веществ зеленые растения осуществляют с помощью энергии солнечного излучения из СО2 и Н2 О в процессе фотосинтеза.
Таблица 2.8. Количество углекислого газа в атмосфере и его кругооборот, в кг
| По Ю.Саксу |
По Г.Гредеру |
По Е.Рейнау |
|
| Количество СО2 |
2500×1012 |
2100×1012 |
1530×1012 |
| Усваивается растениями за год |
648×1012 |
60×1012 |
86,5×1012 |
| За сколько лет растения вычерпали бы запасы СО2 в атмосфере |
4 |
35 |
18 |
Значение света для зеленых растений подчеркивал еще Аристотель: «Те части растений, в которых влажное не смешивается с солнечными лучами, остаются белыми».
В 1777 г. Д. Пристли открыл, что растения днем выделяют кислород, очищая воздух, «испорченный» горением или дыханием животных. Сам процесс фотосинтеза был досконально изучен К.А. Тимирязевым (1843-1920). По Тимирязеву, процесс фотосинтеза протекает под воздействием содержащегося в зеленых частях растений сложного органического вещества – хлорофилла, спектр поглощения которого показан на рис. 2.7. Коэффициент использования энергии солнечного света при фотосинтезе невелик (» порядка 2 %).
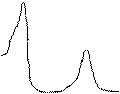
 Поглощение
Поглощение
420 500 580 660 740 Длина волны, мкм
Рис. 2.7. Спектр поглощения хлорофилла
Усвоение СО2 растениями при фотосинтезе эндотермический процесс, который протекает с поглощением большого количества теплоты с DН=112 ккал/моль в случае синтеза глюкозы:
hn
6СО2 + 6Н2 О = С6 Н12 О6 + 6О2 – 674 ккал.
В 1961 г. за раскрытие механизма фотосинтеза американскому ученому М. Келвину присуждена Нобелевская премия. Механизм фотосинтеза такой: попадая в клетку зеленого листа, СО2 присоединяется к акцептору (углеводрибулезодифосфат), с которым продолжается дальнейшее передвижение и превращение. Благодаря ферменту альдолазы образуется глюкоза С6 Н12 О6 , а далее – сахароза С12 Н22 О11 , крахмал (С6 Н10 О5 )n и другие углеводы Сn (Н2 О)m . Суммарно фотосинтез можно выразить так:
hn
nСО2 + mН2 О = Сn (Н2 О)m + nО2 – Q.
Фотосинтез осуществляется за счет энергии солнечных лучей (26500 млрд ккал/с на всей земной поверхности).
Часть синтезированного в этом процессе вещества снова переходит к акцептору. Так и реализуется циклический процесс. Только циклические процессы могут быть саморегулирующимися (фотосинтез в их числе). Дальше с помощью других ферментов из углеводов синтезируются белки, жиры и другие нужные для жизни растений органические вещества.
Следует заметить, что содержание СО2 в атмосфере невелико, и он бы полностью исчерпался за 4-35 лет (табл. 2.8.).
Откуда же он поступает в атмосферу? Ежегодно все растения и животные выдыхают СО2 1013 -1014 кг, а люди – 1,08×1012 кг (пункты 3,4; рис.2.5).
Экзотермическая реакция окисления углерода до СО2 протекает в тканях живого организма под действием вдыхаемого кислорода, который переносится по кровеносной системе посредством гемоглобина – сложного органического вещества (с молярной массой М»68000 г/моль), содержащего 4 атома железа, каждый из которых способен связывать одну молекулу О2 .
Процесс дыхания упрощенно можно изобразить схематически так (где Гем – гемоглобин):
1) Гем + О2 = Гем·О2 (легкие: вдыхание);
2) Перенос с кровью в ткани;
3) Гем·О2 + С (из пищи) = Гем·СО2 (ткани);
4) Перенос в легкие;
5) Гем·СО2 = Гем + СО2 (легкие: выдыхание).
Таким образом, можно сказать, что гемоглобин ведет себя как катализатор. Другие источники поступления СО2 в атмосферу – извержения вулканов, кислотные дожди, действующие на известняки (пункт 8, рис. 2.5). Часть СО2 образуется при гниении, разложении, отмирании живых организмов под действием редуцентов, а также при пожарах и, наконец, при антропогенном воздействии. Так, ежегодно в промышленности и на транспорте при сжигании топлива выбрасывается в атмосферу 1,5×1012 кг СО2 и эта цифра ежегодно растет, что создает глобальную проблему - парниковый эффект.
Если бы не происходило побочных процессов, то количество СО2 , выделяемого в атмосферу и усваиваемого растениями, было бы одинаковым. Однако же часть углерода временно выводится из кругооборота за счет частичной минерализации останков растений (пункт 5, рис. 2.5) и животных (пункт 6, рис. 2.5) с образованием торфа, нефти, углей и других ископаемых в литосфере.
Общее количество углерода земной коры (трех оболочек), по Вернадскому, составляет примерно 1×1017 т, причем большая часть его рассеяна повсюду в природе, поэтому такой разброс в данных по распределению его по отдельным формам нахождения (табл. 2.9).
Таким образом, основная масса углерода принимает участие в медленном геологическом кругообороте. Естественно предположить, что в настоящее время атмосфера содержит лишь ничтожную часть СО2 от того запаса, который первоначально имелся, и углерод постепенно выводился из биологического кругооборота из-за отложений в литосфере. Но из-за антропогенных факторов (использование горючего, его сгорания) в последнее время доля СО2 , а значит, и углерода в атмосфере неуклонно растет из года в год.
Таблица 2.9. Количество углерода, в т
| Скопление углерода |
Количество углерода, т |
|
| По Вернадскому |
По Г.В. Стадницкому и А.И. Родионову |
|
| Атмосфера |
3×1012 |
2,35×1012 |
| Океан |
1×1014 |
- |
| Карбонатные отложения |
- |
1,3×1016 |
| Кристаллические породы |
- |
1×1016 |
| Известняки |
3×1016 |
- |
| Живое вещество |
1×1012 |
» 5×1011 |
| В растительных тканях |
- |
5×1011 |
| В животных тканях |
- |
5×109 |
| Каменные угли |
2×1013 |
- |
| В каменных углях + нефти |
- |
3,4×1015 |
Большим регулятором содержания СО2 в атмосфере является Мировой океан. Много углерода исключается из биологического кругооборота веществ на суше и попадает в океан в основном в виде карбонатных солей. Если в атмосфере повышается содержание СО2 , то часть его растворяется в воде, вступает в реакцию с СаСО3 , с образованием растворимых в воде гидрокарбонатов, например Са(НСО3 )2 . Наоборот, при уменьшении содержания СО2 в атмосфере, гидрокарбонаты, которые всегда содержатся в морской воде, превращаются в карбонаты, которые выпадают из раствора, частью используются организмами для построения скелетов или панцирей (раковин) животных, при отмирании, а частью и без отмирания в виде СаСО3 оседают на морское дно. Таким образом, существует обратимый процесс:
® уменьшение концентрации СО2
Са(НСО3 )2 « СаСО3 ¯ + Н2 О + СО2 .
¬ увеличение концентрации СО2
2.6.2. Кругооборот кислорода
Один из наиболее сложных кругооборотов, так как с кислородом О2 вступает в реакцию большое количество органических и неорганических веществ, а также водород (последний дает с О2 ® воду Н2 О). Упрощенная схема кругооборота кислорода представлена на рис. 2.8).
Кругооборот кислорода непосредственно связан с кругооборотом углерода (процессы фотосинтеза, дыхания и питания животных). Особенностью кругооборота кислорода является широкое многообразие кислородсодержащих веществ в биосфере. Кислород в
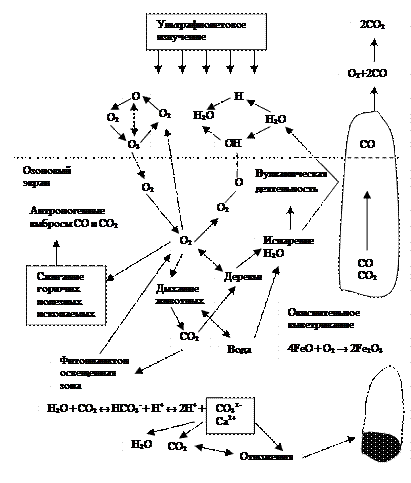
Рис. 2.8. Кругооборот кислорода
целом самый распространенный в биосфере химический элемент. В свободном виде (О2 ) он присутствует в наземных водных источниках, в почве и составляет основу воздуха, присутствуя в атмосфере также и в виде озона (главным образом в стратосфере). Роль озона в биосфере, его образование подробно рассматривается в других разделах пособия. В связанном виде кислород составляет основу горных пород и минералов (например, солевых и оксидных), а также газообразных продуктов (например, оксидов углерода, серы, азота и др.), и, наконец, воды (самого распространенного на планете вещества), образование которых рассматривается в других кругооборотах элементов и веществ.
Нарушение стабильного кругооборота кислорода происходит в основном из-за больших объемов сжигания органического топлива (свободный кислород тратиться на окисление), а с другой стороны, из-за массовой вырубки лесов (главного источника поступления свободного кислорода в биосферу). Одновременно с этим возникает целый блок глобальных проблем (парниковый эффект, кислотные дожди, явления "смога" и др.).
2.6.3. Кругооборот серы
Существуют гипотезы, что в ранние геологические эпохи Земли недостаток О2 предполагал существование серы в основном в виде Н2 S и солей (главным образом, сульфидов, например FeS2 ). С формированием О2 начинаются окислительные процессы. В наше время сера на планете присутствует в виде Н2 SО4 и Н2 S (и их солей), и части свободной серы, SО2 , а также в виде органических веществ в живых организмах.
Величайшую роль в кругообороте выполняют бактерии. Мы уже знакомы с фотосинтезом, но, кроме этого, некоторые бактерии, используя энергию химических экзотермических реакций окисления (хемосинтез), синтезируют органические вещества. Так под действием особого вида бактерий (серобактерии) идет окисление Н2 S до S:
2Н2 S + О2 ® 2Н2 О + 2S + 127 ккал (+ Q).
Cера откладывается в «телах» серобактерий, составляя до 95 % их общей массы, тем самым устраняя вредное действие Н2 S на растения и животных. Это неполный процесс окисления серы, он идет и дальше до Н2 SО4 под действием О2 воздуха, а также пурпурных бактерий, для которых дыхание заменяется процессом:
бактерии
Н2 S + 2О2 ® Н2 SО4 + 189 ккал.
Сера окисляется на воздухе, а также в организмах серобактерий, если они будут лишены сероводородной среды:
2S + 3О2 + 2Н2 О = 2Н2 SО4 + 251 ккал,
SО2 или Н2 SО3 – практически не образуются, а образуется Н2 SО4 , так как протекают достаточно сложные процессы:
2S + 2О2 + 2Н2 О = 2Н2 SО3 + 157 ккал, (1)
2Н2 SО3 + Н2 О + O2 = 2Н2 SО4 + 94 ккал. (2)
Вторая реакция протекает быстрее, поэтому Н2 SО3 (или же SО2 + Н2 О) не накапливается. Свободная Н2 SО4 в природе встречается редко (разве что при кислотных дождях), она очень активна, поэтому реагирует с содержащимися в почве и воде веществами или горными породами, например:
СаСО3 + Н2 SО4 = СаSО4 + СО2 + 2Н2 О.
Большая часть сульфатов уносится водами рек, а также под действием осадков и выветривания минералов, в моря, частью растворяясь в океанических водах, а частью откладываясь на дне в виде напластований и образуя минералы, особенно природного гипса СаSО4 ×2Н2 О, перемещаясь в глубины литосферы, а затем через годы – на поверхность и т.д.
Попадая в глубокие слои литосферы, тот же СаSО4 , претерпевает восстановительный процесс, например, с участием органических веществ:
СаSО4 + СН4 ® СаS + СО2 + 2Н2 О ® СаСО3 + Н2 S + Н2 О.
Таким образом, возникают сероводородные («серные») источники (например, Мацеста, Пятигорск). Но существуют и другие бактерии – сульфатовосстанавливающие, которые питаются за счет сульфатов. Так, на глубине ниже 150 м, например, в Черном море, сульфаты под действием этих бактерий восстанавливаются до сероводорода, который, поднимаясь наверх, вновь подвергается действию серобактерий, окисляется до SО4 2- , а часть Н2 S уходит в атмосферу. Источники Н2 S – болота, вулканическая деятельность, природные процессы гниения отмерших живых организмов.
При извержении вулканов выделяется Н2 S и SО2 , концентрации которых могут быть различными, тогда возможно протекание реакции: 2Н2 S + SО2 ® 3S + 2Н2 О.
При избытке Н2 S, выделяющаяся сера защищается от окисления и потому может образовывать на некоторой глубине в толще литосферы – пласты S или вкрапления.
Кроме того, на больших глубинах формируются горючие природные ископаемые (тот же уголь, и углеводороды, содержащие серу), откладываются сланцы и другие осадочные породы, содержащие серу.
При добыче этих ископаемых, их сжигании или химической переработке, а также их естественном разложении в атмосферу выбрасываются SО2 и Н2 S, которые окисляются до Н2 SО4 и, наряду с природными источниками, затем выпадают на землю в виде осадков – кислотных дождей. И так, круг замыкается. Особенно из-за деятельности человека, а также из-за окислительной способности воздуха в наше время кругооборот осуществляется с увеличением содержания сульфатов, а в прошлом – преобладали сульфиды.
Остался неучтенным процесс потребления серы растениями, с учетом которого кругооборот серы можно выразить упрощенной схемой (рис. 2.9).
Переработка сульфатов растениями, в том числе и с использованием бактерий, очень сложный процесс, приводящий к синтезу растениями
29-04-2015, 04:46
