Содержание
1. МИНЕРАЛОГИЯ И ПОНЯТИЕ О МИНЕРАЛЕ
2. ЗЕМНАЯ КОРА И ОСОБЕННОСТИ ЕЕ СОСТАВА
2.1 Строение земного шара
2.2 Состав земной коры
2.3 Некоторые особенности распределения тяжелых металлов в земной коре
3. КОНСТИТУЦИЯ И СВОЙСТВА МИНЕРАЛОВ
3.1 Общие сведения
3.2 Химический состав и формулы минералов
3.2.1 Соединения постоянного состава
3.2.2 Соединения переменного состава (твердые растворы, смешанные кристаллы, изоморфные смеси)
3.2.3 Водные соединения
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. МИНЕРАЛОГИЯ И ПОНЯТИЕ О МИНЕРАЛЕ
Минералогия принадлежит к числу геологических наук. Название этой науки в буквальном смысле означает учение о минералах, которое объемлет все вопросы о минералах, включая и их происхождение. Термин "минерал" происходит от старинного слова "минера" (лат. minera — руда, ископаемое). Это указывает, что его появление связано с развитием горного промысла.
Интуитивно минералы можно определить как составные части горных пород и руд, отличающиеся друг от друга по химическому составу и физическим свойствам (цвету, блеску, твердости и т. д.). Например, биотитовый гранит как горная порода состоит из трех главных минералов различного состава: светлоокрашенного полевого шпата, серого кварца и черной слюды (биотита).
В настоящее время большинство объектов минералогии отвечает следующему определению:
Минерал — однородное природное твердое тело, находящееся или бывшее в кристаллическом состоянии.
Таким образом, определенное понятие минерала отвечает минеральному индивиду — естественно ограниченному телу — и охватывает все разнообразие реальных единичных объектов минералогии, встречающихся в природе. В число минералов обычно не включаются высокомолекулярные органические образования типа битумов, не отвечающие в большинстве случаев требованиям кристалличности и однородности.
С генетической точки зрения минералы представляют собой природные химические соединения и простые вещества, являющиеся естественными продуктами различных физикохимических процессов, совершающихся в земной коре и прилегающих к ней оболочках (включая и продукты жизнедеятельности организмов)1. К минералам относят и космогенные объекты, отвечающие вышеприведенным требованиям однородности и кристалличности.
Минералогия как наука о природных химических соединениях (минералах) изучает во взаимной связи их состав, кристаллическое строение, свойства, условия образования и практическое значение.
В соответствии с этим и задачи данной науки должны быть тесно связаны, с одной стороны, с достижениями смежных с нею наук (физики, химии, кристаллохимии и др.), а с другой — с запросами практики поисково-разведочного дела.
Главнейшими задачами минералогии в настоящее время являются:
1) всестороннее изучение и более глубокое познание физических и химических свойств минералов во взаимной связи с их химическим составом и кристаллическим строением с целью практического использования их в различных отраслях промышленности и выявленияновых видов минерального сырья;
2) изучение закономерностей сочетания минералов и последовательности образования минеральных комплексов в рудах и горных породахс целью выяснения условий возникновения минералов и истории процессов минералообразования (генезиса), а также использованияэтих закономерностей при поисках и разведках различных месторождений полезных ископаемых.
металл минерал кристалл изоморфный
2. ЗЕМНАЯ КОРА И ОСОБЕННОСТИ ЕЕ СОСТАВА
2.1 Строение земного шара
Главным объектом геологических, в том числе и минералогических исследований является земная кора, под которой подразумевается самая верхняя оболочка земного шара, доступная непосредственному наблюдению.
Наши фактические знания о строении и химическом составе земной коры основываются почти исключительно на наблюдениях над самыми поверхностными частями нашей планеты.
Горообразующие процессы, совершавшиеся в различные геологические эпохи и приводившие к образованию высоких горных хребтов, подняли из глубины самые различные породы, не образующиеся вблизи поверхности Земли. Наиболее глубинные по происхождению горные породы из доступных прямому изучению — мантийные ксенолиты, обнаруживаемые в трубках взрыва, — являются объектом пристального внимания исследователей. Их изучение дает возможность, как показывают геологические наблюдения и подсчеты, получить более или менее реальное представление о составе и строении земного шара только до глубины 100–150 км (радиус же его превышает 6300 км).
О строении и составе глубоких недр земного шара можно судить лишь на основании косвенных данных. Как показывает сопоставление плотностей всего земного шара (5,527) и земной коры (2,7–2,8), внутренние части нашей планеты должны обладать значительно большей плотностью, чем поверхностные. Различные данные (геофизические наблюдения, данные сравнения Земли с другими космическими телами, состав метеоритов и пр.) дают основания предполагать, что это обстоятельство обусловлено не только увеличением с глубиной давления, но и изменением состава внутренних частей нашей планеты.
Согласно современным моделям, построенным на основании геофизических данных, в строении Земли выделяется несколько концентрических оболочек (геосфер), различающихся по физическим свойствам и составу (табл. 1).
Таблица 1Характеристики геосфер Земли
| Оболочка | Индекс | Нижняяграница, км | Плотность | Компонентный состав |
| Кора | A | 10-30 | 2,80–2,85 | SiO2 , Al2 O3 ,FeO, CaO, MgO, Na2 O, K2О |
| Верхняя мантия | B | 350–400 | 2,9–3,5 | SiO2 , MgO, FeO, CaO, Al2 O3 |
| Переходная зона | C | 770 | 3,8–4,2 | SiO2 , MgO, FeO, CaO, Al2 O3 |
| Нижняя мантия | D | 2875 | 4,5–5,6 | SiO2 , MgO, FeO, Fe, MgS, FeS |
| Внешнее ядро | E | 4711 | 9,8–12,2 | FeO, Fe, FeS, Si, Ni, H, C |
| Переходная зона | F | 5160 | 12,2–12,5 | Fe, FeS, Ni, H, C |
| Внутреннее ядро | G | 6371 | 12,7–14,0 | Fe, Ni, H, C |
2.2 Состав земной коры
Впервые состав твердой части земной коры в весовых процентах подсчитал американский исследователь Ф. Кларк в 1889 г. Большая работа по уточнению полученных цифр была проделана В. И. Вернадским, А. Е. Ферсманом, И. и В. Ноддаками, Г. Гевеши, В. М. Гольдшмидтом и А. П. Виноградовым. Последний подсчитал средний химический состав лишь литосферы (без учета гидросферы и атмосферы).
Из более чем ста химических элементов, приведенных в периодической таблице элементов Менделеева, лишь немногие пользуются широким распространением в земной коре. Такие элементы в таблице располагаются преимущественно в верхней ее части, т. е. относятся к числу элементов с малыми порядковыми номерами.
Наиболее распространенными элементами являются: О, Si, Al, Fe, Ca, Na, К, Mg, Ti, H и С. На долю всех остальных элементов, встречающихся в земной коре, приходится всего лишь несколько десятых процента (по весу). Подавляющее большинство этих элементов в земной коре присутствует почти исключительно в виде химических соединений. К числу элементов, встречающихся в самородном виде, относятся очень немногие. Те и другие возникают в результате химических реакций, которые протекают в земной коре при различных геологических процессах, приводящих к образованию самых разнообразных па составу массивов горных пород и месторождений полезных ископаемых.
2.3 Некоторые особенности распределения тяжелых металлов в земной коре
Многие из указанных редких в земной коре элементов под влияниемсовершающихся в природе геохимических процессов нередко образуютисключительно богатые скопления минерального вещества, носящие название рудных месторождений. Если бы не существовало процессов, приводящих к образованию таких месторождений, которые имело бы смыслразрабатывать с целью извлечения ценных для промышленности металлов, то можно с уверенностью сказать, что не было бы и столь мощногоразвития техники и культуры, какое наблюдается в настоящее время.
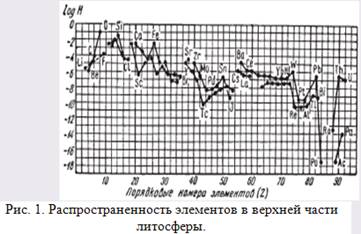
|
Природные соединения тяжелых металлов представляют собой в основном сравнительно простые соединения. Часть этих элементов (Fe, Mn, Sn, Сr, W, Nb, Та, Th, U) преимущественно распространена в виде кислородных соединений, но зато многие другие элементы (Fe, Ni, Co, Zn, Cu,Pb, Hg, Mo, Bi, As, Sb, Ag и др.) встречаются главным образом в виде скоплений сернистых, мышьяковистых и сурьмянистых соединений. Железосовмещает в себе свойства сидерофильных, литофильных и халькофильных элементов, обладая заметным сродством как к кислороду, так и к сере.
На диаграмме(рис. 1) данылогарифмы атомных кларков (H) как функция порядкового номера (Z), причем кислород принят за единицу.
На диаграмме по оси абсцисс расположены порядковые номера химических элементов, а по оси ординат — логарифмы их атомныхкларков. Можно видеть, что с увеличением порядкового номера кривыекларков как четных, так и нечетных элементов в общем обнаруживаюттенденцию к понижению. Это означает, что для большинства химическихэлементов имеет место обратно пропорциональная зависимость их среднего содержания в земной коре от порядкового номера, хотя встречаютсяи исключения (например, для Li, Be, В и др.).
3. КОНСТИТУЦИЯ И СВОЙСТВА МИНЕРАЛОВ
3.1 Общие сведения
Замечательной особенностью многих природных соединений является их окраска. Для ряда минералов она постоянна и весьма характерна. Например, киноварь (сернистая ртуть) всегда обладает карминно-крассным цветом, для малахита характерна ярко-зеленая окраска, кубические кристаллики пирита легко узнаются по металлически-золотистому цвету и т. д. Наряду с этим окраска большого количества минералов изменчива. Таковы, например, разновидности кварца: бесцветные (прозрачные), молочнообелые, желтоватообурые, почти черные, фиолетовые, розовые.
Блеск — также весьма характерный признак многих минералов. В одних случаях он очень похож на блеск металлов (галенит, пирит, арсенопирит), в других — на блеск стекла (кварц), перламутра (мусковит). Немало и таких минералов, которые даже в свежем изломе выглядят матовыми, т. е. не имеют блеска.
Все свойства минералов (физические и др.),находятся в причинной зависимости от особенностей химического состава и кристаллической структуры вещества — от конституции минее рала, что, в свою очередь, обусловлено размерами атомов или ионов (участвующих в составе минерала), строением их электронных оболочек (особенно наружных) и свойствами, которые определяются положением химических элементов в системе Д. И. Менделеева. Поэтому многое из того, что раньше казалось загадочным, теперь, в свете современных достижений точных наук, становится все более и более понятным. Эти достижения способствуют не только правильному пониманию природных явлений, но и помогают нам в практическом использовании свойств минералов.
Конституция минерала представляет собой единство его химического состава и кристаллической структуры. Понятие "конституция" описывает, можно сказать, сущность минерала; она является его собственным, внутреннейшим свойством, в отличие от прочих свойств и признаков, являющихся откликами на внешние воздействия, проявляющихся и формирующихся во взаимодействии со средой. Именно конституция минерала определяет его видовую принадлежность, диагностические же свойства (признаки) минералов, являющиеся функцией его состава и структуры, служат для установления видовой принадлежности.
3.2 Химический состав и формулы минералов
Подавляющее большинство встречающихся в природе минералов представлено химическими соединениями. Среди последних различают:
· а) соединения постоянного состава (дальтониды) и
· б) соединения переменного состава.
3.2.1 Соединения постоянного состава
Все химические соединения постоянного состава, как известно, строго подчиняются закону кратных отношений (закон Дальтона) и закону валентных паев, связывающему отношения компонентов данного соединения с отношениями их в других типах соединений. Эти законы находятся в полном соответствии с Периодической системой элементов Д. И. Менделеева, законами кристаллохимии и учением о симметрии в кристаллических средах.
Характерно, что эти соединения отличаются целым рядом особых физических свойств, отчетливо выступающих на физико-химических диаграммах плавкости, растворимости, электропроводности, твердости, удельного веса, показателей преломления и пр.
Лишь отдельные индивиды минералов, формирующиеся в специфических условиях природной дистилляции, приближаются к соединениям постоянного состава. Тем не менее в качестве идеализации многие минералы полезно условно рассматривать как соединения постоянного состава.
Такое абстрагирование от реального состава позволяет использовать понятие минерального вида и характеризовать индивиды минералов, относящиеся к определенному минеральному виду, единообразными и относительно простыми химическими формулами, отражающими устойчивые особенности их, вообще говоря, непостоянного состава.
К числу бинарных химических соединений относятся:
· простые оксиды:
![]()
· сульфиды:
![]()
· галогениды:
![]()
Соединения, состоящие из атомов трех элементов, называются тернарными; таковы различные кислородные соли.
![]()
Существуют, конечно, и соединения более сложного состава.
Химический состав химических соединений может изображаться двояким способом:
1) в виде эмпирических формул;
2) в виде конституционных или структурных формул.
Помимо бинарных и тернарных химических соединений, в природе распространены и более сложные соединения, например, двойные соли. Двойными солями называются такие соединения постоянного состава, которые состоят как бы из двух простых солей, присутствующих в кратных отношениях. В большинстве случаев эти соли являются двойными по катионам, реже — по анионам или одновременно по катионам и анионам. В качестве примеров могут быть приведены следующие:
![]()
3.2.2 Соединения переменного состава (твердые растворы, смешанные кристаллы, изоморфные смеси)
Кроме химических соединений постоянного состава, получаемых обычно в лабораториях с использованием чистых исходных компонентов, существует огромное множество таких соединений, состав которых не является постоянным, а колеблется то в узких, то в более широких пределах, причем эти колебания состава не могут быть объяснены наличием каких-либо механических примесей посторонних веществ. Наоборот, колеблющийся состав соединений с кристаллохимической точки зрения находит объяснение в растворимости составных компонентов в данном соединении.
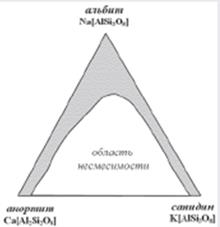
Такие химические образования получили название соединений переменного состава.
Среди минералов соединения переменного состава составляют большинство. Существование веществ (фаз) переменного состава кажется вполне естественным, если речь идет о жидких растворах, состав которых определяется соотношением количеств растворенного вещества и растворителя. Таким образом, состав раствора колеблется в пределах от чистого растворителя до насыщенного раствора; он может быть любым из непрерывного множества возможных составов в пределах, зависящих от температуры и давления. Способность кристаллических веществ различного состава образовывать непрерывно меняющиеся по составу соединения одинаковой кристаллической структуры основана на изоморфизме, т. е. свойстве атомов различных элементов заменять друг друга в твердых химических соединениях.
Системы с изоморфными замещениями могут быть и более чем двухкомпонентными. В случае таких систем речь уже идет не о рядах, а о полях и целых областях изоморфной смесимости, как это характерно, например, для полевых шпатов (рис. 2) при высоких температурах, когда смешению подвергаются плагиоклазы и калиевые полевые шпаты.
Ионные радиусы в вертикальных группах Периодической системы элементов возрастают с увеличением порядкового номера и уменьшаются в горизонтальном направлении с увеличением номера группы (т. е. с увеличением валентности). На этом основании А. Е. Ферсманом выведен закон диагональных рядов изоморфных ионов в Периодической системе элементов, справедливый для левой ее части. Намечаются следующие гетеровалентные ряды изоморфизма ионов (в скобках показаны ионные радиусы в ангстремах):
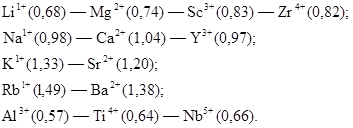
Действительно, в природных соединениях нередко наблюдаются, что литиевые минералы, например, содержат изоморфные примеси магния, магниевые минералы — примеси скандия, натриевые — примеси кальция, кальциевые — примеси иттрия и т. д.
3.2.3 Водные соединения
К числу водных соединений следует относить только такие, которые в своем составе содержат электрически нейтральные молекулы воды.
В зависимости от того, каким способом удерживается вода в минералах, различают:
1) кристаллизационную, или связанную, воду, входящую в кристаллические структуры минералов;
2) свободную воду, не участвующую в строении самого кристаллического вещества.
Связанная вода в кристаллической структуре участвует в виде молекул Н2О, занимающих в ней строго определенные места. Количество молекул воды находится в простых отношениях к другим компонентам соединения. В качестве примеров можно привести следующие: Na2CO3 . 10H2O (сода), Ca[SО4] . 2H2O (гипс), Ni3[AsO4]2 . 8H2O (аннабергит), Аl2[РО4](ОН)3 . 5Н2О (вавеллит)
![]()
Это так называемые кристаллогидраты, которые, по Вернеру, должны рассматриваться как "комплексные соединения", т. е. такие, в которых молекулы воды как структурные единицы располагаются в определенной координации вокруг каких-либо ионов, создавая таким путем своего рода комплексные ионы.
Свободная вода, присутствующая в минеральных массах, характеризуется тем, что не принимает прямого участия в строении кристаллического вещества минералов. При нагревании она выделяется постепенно.
Различают три вида свободной воды:
а) цеолитную;
б) коллоидную;
в) гигроскопическую.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Бетехтин А. Г. Курс минералогии: учебное пособие / А. Г. Бетехтин. — М. : КДУ, 2007. — 721 с: ил., табл.
2. М.П. Шаскольская "Кристаллография" - М, "Высшая школа", 1984.
3. Успенская М. Е, Посухова Т. В. "Минералогия с основами кристаллографии и петрографии " – М, Изд-во МГУ.
4. Булах А.Г. "Минералогия с основами кристаллографии" – М, Недра, 1989.
29-04-2015, 00:57
