Что означают для двуокиси серы эти двое суток времени пребывания? На какое расстояние в среднем она может распространиться с помощью ветра? Возьмем скорость ветра 10 м/с, которая довольно часто бывает на высоте 1 км от поверхности Земли. Легко можно подсчитать, что одна "средняя" молекула двуокиси серы на "крыльях ветра" может удалиться примерно на 2000 км от места выброса. Если же мы примем во внимание среднее значение скорости ветра у поверхности почвы (в Венгрии приблизительно 3 м/с), то среднее пройденное молекулой расстояние составит около 500 км. Таким образом, молекула двуокиси серы в среднем может покрыть расстояние 1000 км. Для двуокиси азота это расстояние из-за более продолжительного времени пребывания может быть еще больше.
Распространение загрязняющих веществ в таких масштабах создало много международных проблем. Поскольку загрязнение воздуха не знает границ, выброс загрязняющих веществ в одном государстве может загрязнить воздух другого. Например, существует тесная связь между образованием кислотных дождей в Скандинавских странах и эмиссией двуокисей серы и азота в Средней и Западной Европе. Европейская экономическая комиссия ООН (ЕЭК) в рамках "Совместной программы наблюдения и оценки распространения загрязняющих воздух веществ на большие расстояния в Европе" (ЕМЕП) подсчитала, в какой степени то или иное европейское государство несет ответственность, например, за выпадение кислотных дождей в Скандинавских странах. Необходимо принять во внимание также количества загрязняющих веществ, которые удаляются из определенной страны и поступают туда из других стран. Это можно вычислить исходя из круговорота веществ на данной территории. Если в какой-либо стране выброс загрязняющего вещества (например, двуокиси серы или окиси азота) на ее территории превышает его выпадение в неизменной или преобразованной форме, то баланс этой страны отрицательный, т.е. она больше загрязняет, чем загрязняется сама. Венгрия, например, имеет отрицательный баланс по сере, т. е. может считаться загрязняющей страной, в то время как баланс кислотных соединений азота находится в относительном равновесии.
За передвижением масс воздуха между странами и распространением таким способом загрязняющих веществ можно проследить. Используя различные метеорологические данные (например, направления ветра на различной высоте, скорость ветра), можно определить, где находящаяся над определенной территорией масса воздуха будет располагаться через 0; 3; 6; ... 36ч. Естественно, воздействие каждого источника загрязнения проявляется тем больше, чем ближе он находится от места измерения. Расположенный близко менее значительный источник может перекрыть влияние более отдаленного мощного источника загрязнения.
Таким образом, мы схематично ознакомились с вертикальным перемешиванием (конвекция) и горизонтальным распространением (адвекция) загрязняющих веществ. Однако их только теоретически можно отделить друг от друга, в действительности оба эти процесса идут параллельно. Для математического описания (моделирования) распространения загрязняющих веществ необходимо также учитывать химическое взаимодействие, седиментацию микроэлементов, влияние рельефа на формирование потока воздуха и т.д. Такие математические модели очень сложны. Однако с некоторыми упрощениями можно получить относительно хорошие результаты.
Химические превращения загрязняющих кислотных веществ в атмосфере.
Попадающие в воздух загрязняющие вещества в значительной мере подвергаются физическим и химическим воздействиям в атмосфере. Эти процессы идут параллельно их распространению. Очень часто загрязняющие вещества, испытав частичное или полное химическое превращение, выпадают в осадок, изменив таким образом свое агрегатное состояние.
Рассмотрим подробнее химические реакции и фазовые изменения, происходящие с атмосферными кислотными микроэлементами (веществами).
Химические превращения соединений серы:
Сера входит в состав в неполностью окисленной форме (степень окисления ее равна 4). Если соединения серы находятся в воздухе в течение достаточно длительного времени, то под действием содержащихся в воздухе окислителей они превращаются в серную кислоту или сульфаты.
Рассмотрим в первую очередь наиболее значительное с точки зрения кислотных дождей вещество¾ двуокись серы. Реакции двуокиси серы могут протекать как в гомогенной среде, так и в гомогенной.
Одной из гомогенных реакций является взаимодействие молекулы двуокиси серы с фотоном в видимой области спектра, относительно близкой к ультрафиолетовой области:
![]() .
.
В результате этого процесса возникают так называемые активированные молекулы, которые располагают избыточной энергией по сравнению с основным состоянием. Звездочка означает активированное состояние. Активированные молекулы двуокиси серы в отличие от «нормальных» молекул могут вступать в химическое взаимодействие с находящимся в воздухе в довольно больших количествах молекулярным кислородом:
![]()
(активированная молекула двуокиси + молекулярный кислород ![]() свободный радикал)
свободный радикал)
![]()
(свободный радикал + молекулярный кислород ![]() трехокись серы + озон)
трехокись серы + озон)
Образовавшаяся трехокись серы, взаимодействуя с атмосферной водой, очень быстро превращается в серную кислоту, поэтому при обычных атмосферных условиях трехокись серы не содержится в воздухе в значительных количествах. В гомогенной среде двуокись серы может вступить во взаимодействие с атомарным кислородом, также с образованием трехокиси серы:
![]()
(двуокись серы + атомарный кислород ![]() трехокись серы)
трехокись серы)
Эта реакция протекает в тех средах, где имеется относительно высокое содержание двуокиси азота, которая также под действием света выделяет атомарный кислород.
В последние годы было установлено, что описанные выше механизмы превращения двуокиси серы в атмосфере не имеют превалирующего значения, так как реакции протекают главным образом при участии свободных радикалов. Свободные радикалы, возникающие при фотохимических процессах, содержат непарный электрон, благодаря чему они обладают повышенной реакционноспособностью. Одна из таких реакций протекает следующим образом:
![]()
(двуокись серы +радикал гидроксила ![]() свободный радикал)
свободный радикал)
![]()
(свободный радикал + радикал гидроксила ![]() серная кислота)
серная кислота)
В результате реакции образуются молекулы серной кислоты, которые в воздухе или на поверхности аэрозольных частиц быстро конденсируются.
Превращение двуокиси серы может осуществляться и в гетерогенной среде. Под гетерогенным превращением мы понимаем химическую реакцию, которая происходит не в газовой фазе, ав каплях или на поверхности частиц, находящихся в атмосфере.
Кроме двуокиси серы в атмосфере можно обнаружить значительное количество других природных соединений серы, которые в конечном счете окисляются до серной кислоты. В их превращении важную роль играют образовавшиеся фотохимическим путем свободные радикалыи атомы. Конечные продукты играют определенную роль в анторпогенной кислотной седиментации.
Химические превращения соединений азота:
Наиболее распространенным соединением азота, входящим в состав выбросов, является окись азота ![]() , котрая при взаимодействии с кислородом воздуха образует двуокись азота. Последняя в результате реакции с радикалом гидроксида превращается в азотную кислоту:
, котрая при взаимодействии с кислородом воздуха образует двуокись азота. Последняя в результате реакции с радикалом гидроксида превращается в азотную кислоту:
![]()
(двуокись азота + радикал гидроксила ![]() азотная кислота).
азотная кислота).
Полученная таким образом азотная кислота может долгое время оставаться в газообразном состоянии, так как она плохо конденсируется. Другими словами, азотная кислота обладает большей летучестью, чем серная. Пары азотной кислоты могут быть поглощены капельками облаков, осадков или частицами аэрозоля.
Кислотная седиментация (кислотные дожди).
Заключительным этапом в круговороте загрязняющих веществ является седиментация, которая может происходить двумя путями. Первый путь¾ вымывание осадков или влажная седиментация. Второй путь¾ выпадение осадков или сухая седиментация. Совокупность этих процессов является кислотной седиментацией.
Вымывание кислотных веществ из атмосферы.
Вымывание происходит во время образования облаков и осадков. Одним из условий образования облаков является перенасыщенность. Это означает, что воздух содержит больше водяного пара, чем он может принять при заданной температуре, сохраняя равновесие. При понижении температуры способность воздуха накапливать воду в виде пара уменьшается. Тогда начинается конденсация водяного пара, которая происходит до тех пор, пока не прекратится перенасыщенность. Однако при обычных атмосферных условиях водяной пар способен конденсироваться только при относительной влажности 400-500%. Относительная влажность в атмосфере лишь в редких случаях может превысить 100,5%. При такой перенасыщенности капельки облаков могут возникать только на частицах аэрозоля¾ так называемых конденсационных ядрах. Этими ядрами часто являются хорошо растворимые в воде соединения серы и азота.
После начала образования капель элементы облака продолжают поглощать аэрозольные частицы и молекулы газа. Поэтому воду облака или его кристаллы можно рассматривать как раствор атмосферных элементов.
Элементы облака не могут безгранично увеличиваться. Возникающая под действием гравитации седиментация, которая растет с увеличением размера капель, рано или поздно приводит к выпадению капель облаков с высоты нескольких сотен или тысяч метров. Во время выпадения эти капли промывают слой атмосферы между облаками и поверхностью земли. В это время поглощаются новые молекулы газа и новые аэрозольные частицы захватываются падающей каплей. Таким образом, достигающая поверхности земли вода вопреки всеобщему мнению никоим образом не является дистиллированной водой. Более того, во многих случаях растворенные в воде осадков вещества могут служить важным и иногда даже единственным источником восстановления запасов этих веществ в различных сферах.
Сухие осадки.
Хотя эта форма седиментации существенно отличается от влажной седиментации, конечный результат их действительно идентичен¾ попадание кислотных атмосферных микроэлементов, соединений серы и азота на поверхность Земли. Известно достаточно много разнообразных кислотных микроэлементов, однако содержание большинства из них настолько мало, что их роль в кислотной седиментаци можно не принимать во внимание.
Эти кислотные вещества могут выпадать на поверхность двумя способами. Один из них¾ турбулентная диффузия, под действием которой в осадок выпадают вещества, находящиеся в газообразном состоянии. Турбулентное диффузионное движение в первую очередь возникает из-за того, что движение струящегося воздуха над почвой и другой поверхностью является неравномерным вследствие трения. Обычно в вертикальном от поверхности направлении ощущается увеличение скорости ветра и горизонтальное движение воздуха вызывает турбулентность. Таким путем компоненты воздуха достигают Земли, и наиболее активные кислотные вещества легко взаимодействуют с поверхностью.
Влияние кислотных осадков на биосферу.
Кислотные осадки оказывают вредное воздействие не только на отдельные предмет или живые существа, но и на их совокупность. В природе и в окружающей среде образовались сообщества растений и животных, между которыми, как и между живыми и неживыми организмами, существует постоянный обмен веществ. Эти сообщества, которые можно также называть экологической системой, обычно состоят из четырех групп: неживые объекты, живые организмы, потребители и разрушители.
Влияние кислотности в первую очередь сказывается на состоянии пресных вод и лесов. Обычно воздействия на сообщества бывают косвенными, т.е. опасность представляют не сами кислотные осадки, а протекающие под их влиянием процессы (например, высвобождение алюминия). В определенных объектах (почва, вода, ил и т.д.) в зависимости от кислотности могут возрасти концентрации тяжелых металлов, так как в результате изменения рН изменяется их растворимость. Через питьевую воду и животную пищу, например, через рыбу в организм человека также могут попасть токсичные металлы. Если под действием кислотности изменяются строение почвы, ее биология и химия, то это может привести к гибели растений (например, отдельных деревьев). Обычно эти косвенные воздействия не являются местными и могут влиять на расстоянии нескольких сотен километров от источника загрязнения.
Косвенные воздействия.
Воздействия на леса и пашни. Кислотные осадки воздействуют либо косвенным путем; через почву и корневую систему, либо непосредственно (главным образом на листву). Подкисление почвы определяется различными факторами. В отличие от вод почва обладает способностью к выравниванию кислотности среды, т.е. до определенной степени она сопротивляется усилению кислотности. Попавшие в почву кислоты нейтрализуются, что ведет к сохранению существенного закисления. Однако наряду с естественными процессами на почвы в лесах и на пашнях воздействуют антропогенные факторы.
Химическая стабильность, способность к выравниванию, склонность почв к закислению изменчивы и зависят от качества подпочвенных пород, генетического типа почвы, способа ее обработки (возделывания), а также от наличия поблизости значительного источника загрязнений (рис. 23). Кроме того, способность почвы сопротивляться влиянию кислотности зависит от химических и физических свойств подстилающих слоев.
Косвенные воздействия проявляются по-разному. Например, осадки, содержащие соединения азота, некоторое время способствуют росту деревьев, так как снабжают почву питательными веществами. Однако в результате постоянного потребления азота лес им перенасыщается. Тогда увеличивается вымывание нитрата, что ведет к закислению почвы.
Во время выпадения осадков вода, стекающая с листьев, содержит больше серы, калия, магния, кальция и меньше нитрата и аммиака, чем вода осадков, что приводит к увеличению кислотности почвы. В результате этого возрастают потери необходимых для растений кальция, магния, калия, что ведет к повреждению деревьев.
Поступающие в почву ионы водорода могут замещаться находящимися в почве катионами, в результате чего происходят либо выщелачивание кальция, магния и калия, либо их седиментация в обезвоженной форме. Далее возрастает также мобильность токсичных тяжелых металлов (марганец, медь, кадмий и др.) в почвах с низкими значениями рН.
Растворимость тяжелых металлов также сильно зависит от рН. Растворенные и вследствие этого легко поглощаемые растениями тяжелые металлы являются ядами для растений и могут привести к их гибели. Широко известно, что алюминий, растворенный в сильнокислой среде, ядовит для живущих в почве организмов. Во многих почвах, например, в северных умеренных и бореальных лесных зонах, наблюдается поглощение более высоких концентраций алюминия по сравнению с концентрациями щелочных катионов. Хотя многие виды растений в состоянии выдержать это соотношение, однако при выпадении значительных количеств кислотных осадков отношение алюминий/кальций в почвенных водах настолько возрастает, что ослабляется рост корней и создается опасность для существования деревьев.
Происходящие в составе почвы изменения могут преобразовать состав микроорганизмов в почве, воздействовать на их активность и тем самым повлиять на процессы разложения и минерализации, а также на связывание азота и внутреннее закисление.
Так, например, гибель лесов в Средней и Западной Европе произошла главным образом под влиянием косвенных воздействий. Почти полностью погибли леса на площади в несколько сотен тысяч гектаров.
В Венгрии, согласно исследованиям экологов, погибло более 10% дубов в северном горном массиве. Большей частью это происходит из-за извлечения тяжелых металлов в результате закисления лесных почв. Алюминий и различные тяжелые металлы непосредственно воздействуют на живые существа, но могут также изменить структуру почвы и ее способность обеспечивать питательными веществами.
Вероятной причиной омертвения дубов является разрушение прикрепляющихся к корневой системе грибов Mikorrhiza. Эти грибы находятся в симбиозной связи с отдельными высшими растениями (например, с дубом); присоединяясь к разветвленной корневой системе, они в несколько раз увеличивают ее способность впитывать питательные вещества. Для грибов Mikorrhiza характерна очень большая чувствительность к кислотности. Тенденция к их сокращению и гибели в последние годы находится в непосредственной связи с вымиранием дубов. Аналогичная ситуация сложилась с очень редким, находящимся под охраной растением, — орхидеей. Согласно исследованиям венгерских экологов, они в определенных местах полностью исчезли или значительно поредели.
Дальнейшую озабоченность вызывает то, что в результате гибели наиболее чувствительных к закислению существ (микроорганизмы почвы, грибы, дубы) в структуре материального и энергетического баланса живых сообществ могут произойти неблагоприятные изменения, и в конечном итоге сам человек также пострадает из-за происходящих при этом необратимых процессов.
Обрабатываемые земли (пашни) находятся в несколько ином положении по сравнению с естественными лесными системами. Причиной повышения кислотности обрабатываемых земель в первую очередь является широкое применение минеральных удобрений. Например, суперфосфаты содержат несколько процентов свободной серной кислоты. Азотистые удобрения содержат значительные количества нитратов и соединений аммония.
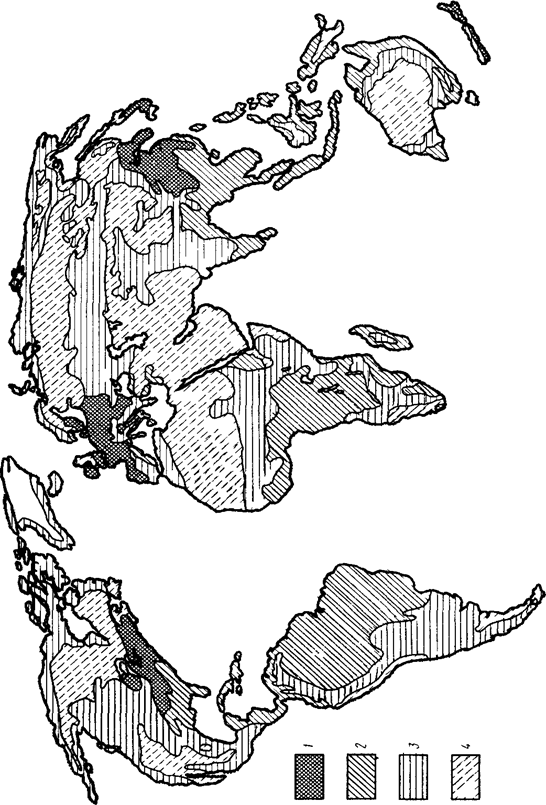
Способность почв к закислению в различных частях Земли .
1-высокая; 2-выше средней; 3-средняя; 4-низкая.
Растения, принимая ион аммония, отдают соответствующее количество ионов водорода в почву, что также ведет к ее закислению. Согласно наблюдениям в Венгрии обрабатываемые земли испытывают стремительное закисление. Частично это объясняется тем, что при уборке растений происходит перенос вещества производительного слоя, из-за чего снижается щелочная среда почвы. Главной же причиной является внесение
минеральных удобрений. Для нейтрализации их воздействия на 1 га нужно внести 300-400 кг карбоната кальция в год, в то время как для нейтрализации воздействия кислотных осадков достаточно около 10 кг карбоната кальция. Таким образом, на интенсивно удобренных территориях кислотные осадки играют только второстепенную роль в закислении почв. Согласно мнению отдельных специалистов, из-за внесения удобрений в Венгрии может начаться закисление почвы в катастрофических размерах. Этого можно избежать только регулярным известкованием почвы, а также путем исключения использования аммонийсодержащих минеральных удобрений.
Закисление пресных вод. /Собственно говоря, закисление прёсных вод -
29-04-2015, 02:10
