Профессор Ю.К. Новиков,РГМУ
Пневмония – распространенное заболевание органов дыхания, встречающееся у 3–15 человек на 1000 населения. Академик РАМН, профессор А.Г. Чучалин приводит цифру в 1,5 миллиона человек, заболевающих пневмонией в России за год. В США ежегодно заболевают до 4 миллионов человек, из которых в 1 миллионе наблюдений требуется госпитализация. Пациенты старше 65 лет госпитализируются в 3,5 раза чаще, чем в среднем по популяции. Наиболее часто болеют лица моложе 5 и старше 75 лет.
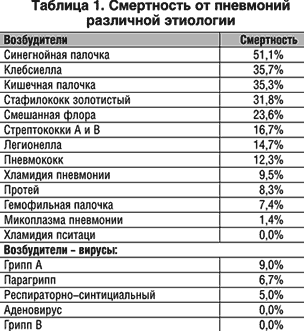
Смертность от внебольничных пневмоний составляет 5%, но у пациентов, нуждающихся в госпитализации, она доходит до 21,9%, от нозокомиальных – 20%, у пожилых больных – до 46%. До применения пенициллина смертность от пневмококковой пневмонии с бактериемией составляла 83%. В таблице 1 приведены показатели смертности от пневмоний, вызванных различными возбудителями.
Учение о пневмониях формировалось в течение нескольких столетий, начиная с Цельса, Виллиса (1684 г.), Лаеннека (1830 г.), Рокитанского (1842 г.), Рентгена (1895 г.), но законченность приобрело только в ХIХ веке, когда была описана этиологическая составляющая нозологии и были открыты пневмококк (1884 г.), клебсиелла (1882 г.), гемофильная палочка (1892 г.) и др.
Большинство определений пневмонии содержат ключевые слова: воспаление, инфекция, альвеолы, клетки воспаления и экссудат.
Таким образом, определение пневмонии может быть представлено в следующем варианте. Пневмония – это инфекционное поражение альвеол, сопровождающееся инфильтрацией клетками воспаления и экссудацией паренхимы, как ответ на внедрение и пролиферацию микроорганизмов в стерильные (в норме) отделы респираторного тракта.
Традиционно в классификациях (Н.В. Молчанов, 1964; Е.В. Гембицкий и О.В. Коровина, 1968; В.П. Сильвестров, 1982) пневмонии подразделяются по этиологии в силу значимости микробного фактора в генезе заболевания.
И в определении, и в классификациях подчеркивается значимость инфекционного фактора, как основного – этиологического, а соответственно и проведение наиболее рационального вида лечения – этиотропного. Но современная классификация исходит из практических целей и предусматривает разделение на:
– внебольничные пневмонии (в том числе и атипичные);
– внутрибольничные пневмонии (госпитальные, нозокомиальные);
– аспирационные пневмонии;
– пневмонии у лиц с иммунодефицитом (врожденным или приобретенным).
Рубрики, указывающие на локализацию и распространенность процесса, осложнения, по–прежнему указываются в диагнозе.
Грамотрицательная флора, как этиологический фактор, фигурирует при всех видах пневмоний. А значимость ее при формировании легочной патологии подчеркивается высокой смертностью. Так, при пневмококковых пневмониях смертность составляет 12,3%, стафилококковых – 31,8%, а при синегнойной инфекции достигает 51,1%.
При внебольничных пневмониях наиболее частыми возбудителями являются:
– Streptococcus pneumoniae 20–60%;
– Mycoplazma pneumoniae 1–6%;
– Hemophilus influenzae 3–10%;
– Influenza virus 2–15%;
– Chlamidia pneumoniae 4–6%;
– Legionella spp. 2–8%;
– Staphylococcus aureus 3–5%;
– Грамотрицательная флора 3–10%.
В 20–30% наблюдений этиологию пневмоний установить не удается.
Таким образом, при внебольничных пневмониях, привычно ассоциирумых с грамположительной и атипичной флорой, в 3–10% присутствуют грамотрицательные микроорганизмы, не считая гемофильную палочку и легионеллу.
Грамотрицательная флора при внебольничных пневмониях
Легионелла была идентифицирована в 1976 году во время вспышки заболевания пневмонией среди участников Съезда американских легионеров.
Было установлено, что клинически легионеллез может проявляться в виде двух основных форм: болезнь легионеров – пневмония, вызванная легионеллой, и понтиакская лихорадка.
Смертность при внебольничной пневмонии достигает 16–30% при отсутствии лечения или при назначении неэффективных антибиотиков, а при госпитальных – 50%.
Клинические симптомы пневмонии, не имеющие особенностей, плюс гастроинтестинальные симптомы – такова клиническая картина болезни легионеров. Инкубационный период составляет 2–10 дней, начало заболевания с интоксикационного синдрома с присоединением затем локальных симптомов: кашель со скудной мокротой (иногда окрашенной кровью), боли в грудной клетке, реже кровохарканье. Клиническая картина тяжелой пневмонии при соответствующем эпиданамнезе и высокой лихорадке может свидетельствовать о легионеллезной инфекции, а при присоединении желудочно–кишечных симптомов и отсутствии эффекта от b-лактамных антибиотиков достоверность такого диагноза увеличивается.
Лабораторная диагностика включает: клинический анализ крови (лейкоцитоз со сдвигом формулы влево, повышение СОЭ, относительная лимфопения, тромбоцитопения, гипонатриемия, гипофосфатемия); клинический анализ мочи (гематурия, протеинурия); иммунологические исследования (определение антигена в моче, антител в крови) и полимеразная цепная реакция.
Рентгенологическая картина заболевания неспецифична: инфильтративные тени со склонностью к слиянию, усиление легочного рисунка, симптомы эксудативного плеврита. Рентгенологические изменения видны к 3–му дню, а при обратном развитии несколько отстают от клиники и нормализуются не ранее месяца.
Внелегочные проявления встречаются редко, но может быть эндокардит, миокардит, перикардит, синусит, парапроктит, панкреатит, перитонит, пиелонефрит (особенно у больных с иммунодефицитом).
При выборе антибиотика были выявлены несоответствия результатов чувствительности легионеллы in vivo и in vitro, что связано с особенностями роста легионеллы на средах и внутриклеточным расположением в организме. Наиболее эффективными являются антибиотики, создающие высокую внутриклеточную концентрацию: макролиды, тетрациклины, фторхинолоны, рифампицин. Современные макролиды, особенно азитромицин (Хемомицин), являются антибиотиками выбора для лечения легионелезной инфекции. Достоинством макролидов является способность создавать очень высокие и стабильные концентрации в тканях, превышающие уровень препарата в сыворотке крови. Наиболее высокие тканевые концентрации, в 10–100 раз превышающие концентрации в крови, характерны для азитромицина (Хемомицин). Существенным является то, что макролиды, особенно азитромицин, способны проникать внутрь фагоцитарных клеток, таких как макрофаги, фибробласты, полиморфноядерные гранулоциты, и с ними транспортироваться в воспалительный очаг. Азитромицин редко вызывает побочные эффекты, хорошо сочетается с основными группами лекарственных средств. Препарат следует принимать всего один раз в сутки, что повышает приверженность пациентов к лечению.
При тяжелом течении инфекции макролиды назначают внутривенно в высоких дозах (эритромицин до 4 г/сутки), а затем переходят на пероральный прием. При нетяжелом течении антибиотики назначают сразу внутрь в среднетерапевтических дозах: азитромицин по 500 мг 1 раз в день в течение 3–х дней или по 250 мг 2 раза в день в 1–й день и по 250 мг 1 раз в день со 2–го по 5–й дни (эритромицин по 250–500 мг – 4 раза/сутки, кларитромицин по 250 мг 2 раза/сутки). Популярна комбинированная терапия леогинеллезной пневмонии макролидами в сочетании с рифампицином. Эффективны при лечении болезни легионеров и макролиды, имеющие лекарственные формы для парентерального введения. Длительность приема антибиотиков – 2–3 недели, так как при более коротком курсе повышается риск рецидива инфекции. Коротким курсом можно назначать только азитромицин, что связано со способностью препарата кумулировать в организме и оказывать пролонгированный терапевтический эффект. При этом следует еще раз напомнить, что зачастую клиническое выздоровление при легионеллезной инфекциях нижних дыхательных путей существенно опережает более позднее рентгенологическое, которое порой затягивается на многие недели или даже месяцы.
При проведении эмпирической терапии при неизвестном возбудителе используются комбинации b-лактамных антибиотиков и макролидов, а также монотерапия новыми фторхинолонами, обладающими широким спектром противомикробной активности, включая кокковую флору, грамотрицательные и атипичные возбудители.
Долевая пневмония, вызванная клебсиеллой, также имеет свои особенности. Для нее характерна скудная физикальная симптоматика из–за густой, вязкой, цвета «малинового желе» мокроты, не позволяющей образовываться звуковым феноменам в виде хрипов и крепитаций. Симптомы уплотнения легочной ткани – такие же, как и при пневмококковой пневмонии. И, конечно, клебсиелла резистентна к действию пенициллинов, что может служить критерием этиологического диагноза и требовать назначения цефалоспоринов, аминогликозидов и фторхинолонов. Лабораторные данные неспецифичны, рентгенологически определяется долевое поражение, но в отличие от пнемококковой пневмонии, носящее сливной характер из нескольких инфильтративных теней. В мокроте определяется при окраске по Граму в виде грамотрицательных палочек, окончательная идентификация – при росте на питательных средах.
Очаговая пневмония, вызванная гемофильной палочкой, не имеет каких–либо клинических и рентгенологических особенностей, проявления ее неспецифичны. Диагнозу могут способствовать указания на имеющийся хронический бронхит, курение. Микробиологическая диагностика состоит в обнаружении грамотрицательных коротких палочек при окраске по Граму, культуральные свойства выявляются при посеве на питательные среды. Гемофильная палочка чувствительна к b-лактамным антибиотикам (защищенным пенициллинам и цефалоспоринам), макролидам, фторхинолонам.
Микробный спектр возбудителей госпитальных пневмоний разнообразен и включает как грамположительную, так и грамотрицательную флору, а также анаэробы (табл. 2).
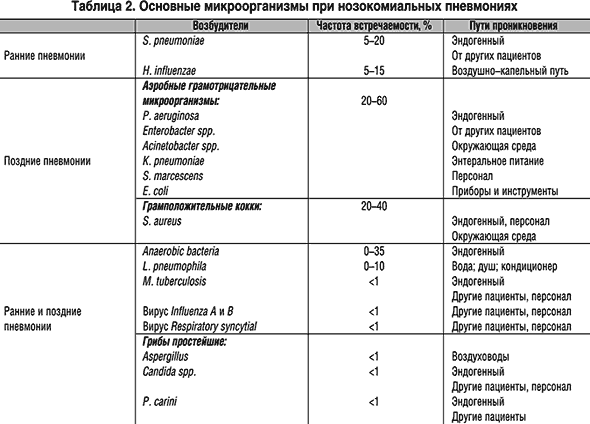
Привычно выделяют флору, характерную для ранних (до 5 суток) и поздних (после 5 суток) госпитальных пневмоний. В первом случае возбудители характерны для внебольничных пневмоний, во втором флора меняется на внутрибольничную. Таким образом, заболевшие в стационаре в ранние сроки госпитализации лечатся, как пациенты с внебольничными пневмониями. К возбудителям ранних пневмоний из грамположительной флоры относят пневмококк, встречающийся в 5–20%. Его источником могут быть пациенты при воздушно–капельном пути распространения и сам пациент с наличием пневмококка в верхних дыхательных путях. Hemophilus influenzae также вызывает ранние пневмонии, относится к грамотрицательным микроорганизмам. Встречается у курильщиков и больных хроническим бронхитом.
Поздние пневмонии, вызываемые микроорганизмами из грамотрицательной группы, встречаются в 20–60% случаев госпитальной пневмонии и составляют основные трудности в лечении больных. К ним относятся синегнойная палочка, кишечная палочка, протей, клебсиелла, энтеробактер, а из грамположительной группы – золотистый стафилококк, частота встречаемости которого достигает 20–40%. В нижние дыхательные пути эти микроорганизмы попадают из эндогенных источников или от других пациентов и медицинского персонала при интубации, постановке назогастральных катетеров и через медицинский инструментарий и приборы.
Флора, встречающаяся при ранних и поздних госпитальных пневмониях, представлена анаэробами (0–35%) и L. Pneumophila (0–10%) из эндогенных источников, водопроводной воды, кондиционеров. M. tuberculosis встречается менее чем в 1%, и это в основном или эндогенная инфекция, или передача от бацилловыделителя. Из многочисленных вирусов для развития пневмонии имеют значение вирусы гриппа и респираторно–синтициальный вирус (менее 1%). Заражение происходит в основном от пациентов и персонала. Аспергиллы и кандиды встречаются менее чем в 1%, заражение – за счет эндогенного источника или от другого пациента, медицинского персонала. Пневмоциста также встречается редко (менее 1%) и имеет те же пути распространения, что и грибы.
Приведенные данные не являются абсолютными, и каждый раз врач решает вопросы этиологии и эмпирической терапии, ориентируясь на местные микробиологические данные, сроки развития пневмонии, тяжесть заболевания и наличие факторов риска, выявленных при сборе анамнеза и осмотре больного.
Госпитальная пневмония
Госпитальная пневмония – это пневмония, развившаяся через 48 часов и позднее после госпитализации (сюда не входят инфекционные заболевания в инкубационном периоде, при которых возможно поражение легких).
Госпитальные пневмонии занимают первое место среди причин смертности от внутрибольничных инфекций. Она достигает 70%, но непосредственной причиной гибели больного пневмония является в 30–50% случаев, когда инфекция является основной причиной летального исхода.
Сложности, с которыми встречается врач в практической работе, начинаются с эпидемиологии: госпитальные пневмонии не относятся к заболеваниям, требующим регистрации, и, соответственно, точной статистики нет. Предполагается, что госпитальная пневмония встречается в 5–10 случаях на 1000 госпитализированных. Однако имеются данные о росте этого показателя до 30–100 на 1000 больных при проведении искусственной вентиляции легких. Каждый день пребывания пациента в реанимационном отделении или блоке интенсивной терапии при проведении вентиляционного пособия на 1–3% увеличивает риск развития госпитальной пневмонии. Сложность этой проблемы находит свое отражение и в классификации пневмоний, когда один из ведущих патогенетических механизмов – аспирация, рассматриваемая как при госпитальных, так и при негоспитальных пневмониях, в разделах патогенеза выносится в название отдельной рубрикой «аспирационные пневмонии». Дифференциальная диагностика сложна, и прежде всего рассматриваются неинфекционные поражения легких: тромбозы и эмболии легочной артерии, респираторный дистресс–синдром взрослых, ателектаз, аллергические поражения легких, включая и лекарственные, застойная сердечная недостаточность. Лечебные проблемы в первую очередь связаны с этиологической диагностикой и возрастающей полирезистентностью некоторых штаммов госпитальных инфекций.
Патогенез
Суть патогенеза госпитальной пневмонии такая же, как и при любой другой пневмонии: взаимодействие вирулентного и в достаточном количестве необходимого для развития патологического процесса микроорганизма с макрорганизмом, у которого исходно или под воздействием микроорганизма нарушены механизмы защиты.
Попадание инфекционного агента в стерильные отделы респираторного тракта возможно при микроаспирации ротоглоточного секрета, которое в норме отмечается у 45% здоровых людей. У людей больных аспирация возможна при нарушениях в сфере сознания, вызванного болезнью или медикаментами, угнетающими сознание, при наличии болезней желудка и пищевода, при постановке назогастрального зонда или интубации трахеи. Возможна массивная аспирация, и тогда инфицирование происходит за счет как орофарингеальной, так и желудочно–кишечной флоры. Проникновение микроорганизмов через системы вентиляции больных, через приборы и инструменты также является одним из вариантов. Различного типа катетеры, ёмкости для увлажнения при вентиляции легких также рассматриваются как источники вирулентной флоры. Наиболее значимыми факторами риска при нозокомиальных пневмониях являются:
– тяжесть заболевания;
– длительная госпитализация;
– длительное нахождение в блоке интенсивной терапии;
– пожилой возраст;
– антибактериальная терапия;
– эндотрахеальная интубация;
– трахеостомия;
– антацидная терапия;
– курение;
– хирургичекие вмешательства;
– уремия.
Перечисленные факторы связаны с орофарингеальной колонизацией микроорганизмов и в основном имеют значение при микроаспирационном механизме развития пневмонии.
Для пациентов, находящихся на искусственной вентиляции легких, добавляются факторы риска, свойственные этим больным:
– длительность механической вентиляции;
– хронические легочные заболевания;
– подавление сферы сознания за счет заболевания или лекарств;
– торакальные или абдоминальные операции;
– назогастральный зонд;
– бронхоскопия и др.
Критерии определения тяжести госпитальной пневмонии, и в первую очередь выделение критериев тяжелой пневмонии, не отличаются от таковых при внебольничных пневмониях.
Антибактериальная терапия госпитальных пневмоний
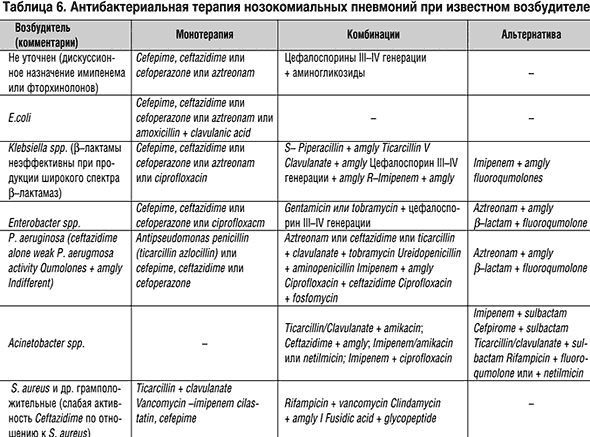
Предлагаемые варианты назначения антибиотиков различаются между собой по количеству критериев, детализирующих госпитальную ситуацию. Так как возбудители в основном известны, то может быть предложен вариант, когда эмпирически назначаются антибиотики цефалоспоринового ряда (цефтазидим, цефепим или цефоперазон) или азтреонам в монотерапии. Возможна комбинация цефалоспоринов III, IV генерации с аминогликозидами. При наличии кишечной палочки, помимо цефалоспоринов III генерации, правомерно назначение амоксициллина с клавулановой кислотой. При определении энтеробактера, помимо цефалоспоринов III, IV генерации, назначается ципрофлоксацин. При высевании синегнойной палочки применяются тикарциллин или азлоциллин, что не исключает назначения цефепима, цефтазидима или цефоперазона. Наличие грамположительной флоры требует назначения тикарциллина, ванкомицина, имипенем–циластатина.
Комбинированная терапия основана на сочетании бактерицидных антибиотиков с бактериостатическими. Действие цефалоспориновых или пенициллиновых антибиотиков усиливается воздействием клиндамицина, ванкомицина, имипенем–циластатина на грамположительную флору и аминогликозидов и фторхинолонов на грамотрицательную флору. При возможной легионеллезной пневмонии логично назначение рифампицина.
С учетом тяжести пневмонии, сроков начала (до или после 5 дней пребывания в стационаре) и наличия факторов риска эмпирическое назначение антибиотиков может быть детализировано (табл. 3,4,5,6).

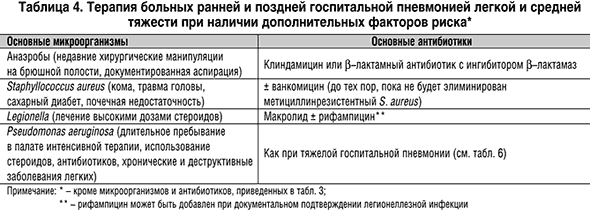

Вопросы иммунотерапии при тяжелом течении госпитальных пневмоний остаются не до конца разрешенными.
Патогенетическая терапия тяжелых пневмоний
Кроме антибактериального лечения, больным тяжелыми пневмониями проводятся другие виды патогенетической терапии.
Иммунозаместительная терапия:
– нативная и/или свежезамороженная плазма 1000–2000 мл за 3 суток;
– внутривенное введение иммуноглобулина 6–10 г/сут. однократно.
Коррекция микроциркуляторных нарушений:
– гепарин 20000 ЕД/сут. внутривенно или подкожно;
– реополиглюкин 400 мл/сут. внутривенно.
Коррекция диспротеинемии:
– альбумин 100–200 мл/сут. (в зависимости от показателей крови);
– ретаболил 1 мл в трое суток, 3 инъекции внутримышечно.
Дезинтоксикационная терапия:
– солевые растворы (физиологический, Рингера и т.д.) 1000–3000 мл внутривенно;
– глюкоза 5% – 400–800 мл/сут. внутривенно;
– гемодез 400 мл/сут. внутривенно.
Растворы вводятся под контролем центрального венозного давления и диуреза.
Кислородотерапия: кислород через маску, катетеры, вспомогательная или искусственная вентиляция легких, в зависимости от степени дыхательной недостаточности.
Кортикостероидная терапия: внутривенное введение преднизолона 60–90 мг или эквивалентные дозы других препаратов ситуационно. Кратность и длительность определяются тяжестью состояния: наличием инфекционно–токсического шока, инфекционно–токсического поражения почек, печени, бронхиальной обструкции и т.д.
Антиоксидантная терапия:
– аскорбиновая кислота – 2 г/сут. внутрь;
– рутин – 2 г/сут. внутрь.
Антиферментные препараты: контрикал и др. 100000 ЕД/сут. на 1–3 суток внутривенно при угрозе абсцедирования.
Бронхолитическая терапия:
– теофиллин 2,4% – 5–10 мл 2 раза сутки внутривенно капельно;
– ипратропиум бромид 2–4 вдоха 4 раза в сутки;
– фенотерол + ипратропиум бромид 2 вдоха 4 раза в сутки;
– кортикостероиды – см. кортикостероидная терапия (выше);
– отхаркивающие (амброксол 100 мг/сут, ацетилцистеин 600 мг/сут.).
Отхаркивающие и бронхолитики при интенсивной терапии вводятся через смеситель при кислородотерапии.
Список литературы
1. A pragmatice guidlines for the managemant of community acquired pneumonia in adults {in Process Citation}. Clin. Inf. Dis.2000. 31:347.
2. Community– acquired pneumonia. Etiology, epidemiology and treatment. Lionel A. Mandel, MD. Chest 1995,81: 357.
3. Clinical Мicrobiology. T.J.J.Inglis.Churchil Livingston.1997.
4. Diagnosis and management of pneumonia and other respiratory infections. Alan Fein et al. Professional Communications, inc.1999.
5. Lecture notes on respiratory diseases. R.A.L. Brevis. Blackwell scientific publications, 1985.
6. Management of adult community–acquired lower respiratory tract infections. Eropian Study on Community Acquired Pneumonia (ESOCAP) committee: Chairmen: G. Huchon, M.Woodhead.1999.
7. Pneumonia. Edited by A. Torres and M.Woodhead. Eropian Respiratory Monograph.1997.
8. Management of Respiratory Tract Infections. Bartlett J. Lippincott Williams et Wilkins.2001.
9. Empiric Treatment of Community–acquired Pneumonia: ATS and IDSA Guidelines.American Thoracic Society–2001.
10. Пневмонии. Чучалин А.Г., Москва, 2002 г.
8-09-2015, 20:20
