Структура и некоторые свойства белка остеопонтина.
В последнее время все большее внимание исследователей привлекают белки-цитокины, вовлеченные в процессы остеогенеза и дентогенеза, а также реконструкции денты и костной ткани. Изучаются молекулярные механизмы действия данных белков, регуляция экспрессии их генов, распределение в различных типах тканей, изыскиваются вещества - ингибиторы или, наоборот, активаторы их биологической активности и т. д.
Причиной такого пристального внимания является не только необходимость получения фундаментальных знаний о структурных основах их биологической активности, но и роль ростовых факторов в развитии целого ряда заболеваний человека. Адгезивные белки и белки-цитокины костной ткани вовлечены в патогенез остеопороза, остеопетроза, развитие первичных и вторичных остеосарком различного происхождения, а также исправление механических повреждений кости и денты, и т.д.
Одной из наиболее распространенных патологий костной ткани является остеопороз - тяжелое заболевание, приводящие к деминерализации и деструкции кости. Только в США на сегодняшний день им страдают более 10 млн. человек, что предопределяет потребность в эффективном лекарственном средстве для терапии остеопороза и предотвращения связанных с ним механических повреждений кости.
В течение последних нескольких лет был разработан и успешно опробован метод лечения остеопороза с помощью умеренных доз препаратов паратиреоидного гормона. Как показали клинические испытания, гормонотерапия ускоряет формирование новой костной ткани, а также увеличивает ее плотность. В то же время, проведенные на модельных животных исследования позволили установить, что остеогенез - активирующие действие паратиреоидного гормона во многом обусловлено активностью остеопонтина (OP) - одного из адгезивных белков костного матрикса, вовлеченного в процесс резорбции кости через одновременное взаимодействие с костной поверхностью и остеокластами.
Костная ткань и дента животных и человека содержит ряд фосфорилированых сиалопротеинов. К ним относятся: BSP (костный сиалопротеин), BAG-75 (кислый костный гликопротеин-75), DMP1 (протеин матрикса денты-1), DSP (сиалопротеин денты), OP и др. Первым из них был открыт и изучен фрагмент костного сиалопротеина (BSP) (Herring G.M., 1972). Позже, после введения ингибитора протеиназ в экстракт ткани кости (Oegema T., et.al., 1975), были описаны свойства полноразмерного белка. Последующее клонирование и определение нуклеотидной последовательности кДНК BSP (Oldbarg A., et al., 1988) позволило определить трансляцией по найденной открытой рамке считывания полную аминокислотную последовательность. Использование отработанных при изучении BSP приемов работы с костной тканью дало в дальнейшем возможность выделить и охарактеризовать большое число костных белков, обладающих адгезивными и цитокинетическими свойствами. Одним из таких белков и является остеопонтин - OP.
Остеопонтин человека был впервые выделен и идентифицирован в 1985 г. (Franzen A., et al., 1985) Позднее была клонирована кДНК OP мыши и определены ее нуклеотидная последовательность, аминокислотная последовательность белка, а впоследствии и полная экзон-интронная организация гена (Miyazaki Y., et al., 1990). Полноразмерный ген OP человека клонировали, используя в качестве гибридизационных зондов меченые фрагменты кДНК OP мыши. Сравнение структурной и функциональной организации двух генов выявило ряд общих свойств. В частности, оба гена включают в свой состав семь экзонов, а их регуляторные области содержат ряд похожих консенсусных последовательностей. В то же время, третий интрон гена OP человека содержит вставку длиной 1,8 тысяч пар оснований. Дальнейшее изучение регуляции экспрессии генов OP мыши и человека, равно как и пути сплайсинга их мРНК в разных линиях клеток и типах тканей позволит в дальнейшем определить функциональное значение особенностей организации генов OP из разных источников (Hijiya N., et al., 1994).
OP - секреторный сиалопротеин, про-пептид которого образуется 314 аминокислотными остатками (а. о.), из которых на долю лидирующей последовательности приходится 16 а. о. OP оказался несколько менее кислым, чем BSP, но его аминокислотная последовательность, как было установлено (Hijiya N., et al., 1994) включает несколько блоков из остатков дикарбоновых аминокислот, причем один общей длиной девять остатков (см. рисунок). Белок O-гликозилирован (Franzen A., et al., 1985) и содержит ряд фосфорилированных остатков серина (Heinegard D., et al., 1989). Сравнение аминокислотной последовательности OP с первичными структурами других костных белков не позволило обнаружить протяженных участков значительной гомологии. В то же время, аминокислотная последовательность OP содержит в своем составе консенсусный RGD-участок. Данная структура отвечает в ряде белков - BSP (Oldbarg A., et al., 1988) и др., за взаимодействие с находящимися на поверхности клеток рецепторами семейства интегринов, и впервые была установлена в отвечающем за связывание клеток домене белка фибронектина (Ruoslahti E. et al., 1987). Интересно также отметить, что, как было обнаружено в процессе выделения, OP способен довольно прочно связываться с гидроксиапатитом (Franzen A., et al., 1985). Это может объясняться его функциями в минерализованной костной ткани.
Следует подчеркнуть, что хотя за прошедшие годы ряд белков костного матрикса был выделен и охарактеризован, в настоящее время имеются всего лишь предположения о возможной функциональной роли некоторых из них. Ни один из этих белков не является уникальным с точки зрения локализации в костной ткани. Все они также присутствуют и в других типах тканей, при этом OP несколько более ограничен в локализации по сравнению с остальными белкам. Так, уровень мРНК OP, высокий в костной ткани, также существенный и в почках. Данный белок, как было показано, часто входит в состав почечных камней и, очень вероятно, влияет на их формирование (Nemir M., et al., 1989). Было, в частности, показано присутствие OP в кальций-фосфатных почечных камнях. Кроме того, обнаружена связь между низким содержанием данного белка в урине пациентов и формированием камней оксалатной природы (Nishio S., et al., 2000). Значительный уровень накопления OP был найден в плаценте и тканях головного мозга (Nomura S., et al., 1988). Ген OP экспрессируется также во многих клеточных линиях, где обнаруживает различные типы экспрессии. Конститутивная экспрессия OP найдена в клетках из костной ткани, почек плаценты, нервных клетках, макрофагах (Patarca R., et al., 1989). В то же время индуцибельный тип наблюдался в T-лимфоцитах, клетках эпидермиса. Усиление экспрессии происходит под воздействием различных агентов: 1,25 дигидроксивитамина D3, основного фактора роста фибробластов (bFGF), фактора некроза опухоли (TNF), интерлейкина-1 (IL-1), липополисахаридов, g-интерферона (g-IFN) (Hijiya N., et al., 1994). Помимо этого, экспрессия гена OP происходит при неопластическом состоянии клетки (Sendger D., et al., 1988; Nemoto H., et al., 2001). Таким образом, регуляция экспрессии гена OP находится под комплексной системой контроля, которая может отличаться у клеток разных типов.
В частности, с целью изучения роли OP в процессах формировании кости, было проведено начальное исследование влияния на уровень накопления OP мРНК в остеобластах из остеосаркомы (линия ROS 17/2.8) различных факторов, влияющих на регуляцию роста и восстановление кости. Было найдено, что 1,25-дигидроксивитамин-D3 в несколько раз повышает как уровень накопления мРНК, так и секрецию зрелого белка из клеток. Эти данные показывают, что синтез OP положительно регулируется витамином D3, т.е. фактором, индуцирующим мобилизацию кальция из кости. По мнению авторов монографии (Heingard D., et. al., 1990), это, скорее всего, связано с индукцией активности остеокластов. Интересно, что по литературным данным ген другого костного сиалопротеина - BSP, подвержен отрицательной регуляции витамином D3, но положительно регулируется глюкокортикоидами (Oldberg A., et al., 1989).
Ввиду того, что белок имеет в своем составе консенсусную RGD-последовательность, а также имеет способность связываться с гидроксиапатитом, можно было предположить, что OP вовлечен в связывание остеокластов на минерализованной поверхности кости (Graig A., et al., 1989). Действительно, позднее было показано связывание остеокластов с OP, нанесенным на поверхность из стекла и пластика (Oldbarg A., et al., 1986). В ряде последующих экспериментов было также обнаружено, что связывание изолированных остеокластов с OP может ингибироваться синтетическим пептидом RGD, но не контрольным RGE, а также моноклональными антителами к фрагменту аминокислотной последовательности OP, содержащей RGD-консенсусный сайт (Bautista D., et al., 1994). Функциональная роль RGD-структуры была дополнительно подтверждена созданием путем сайт-направленного мутагенеза форм OP человека с аминокислотными заменами (Xuan J., et al., 1994). Полученные данные побудили некоторых исследователей попытаться определить тип и субъединичный состав вовлеченного во взаимодействие с OP интегрина остеокластов. Проведенные исследования показали, что только антитела к avb3-интегрину ингибировали связывание клеток с OP. Эти данные показывают, что связывание изолированных остеокластов с OP, по-видимому, опосредуется avb3-интегрином (Bautista D., et al., 1994). Данный тип интегринов является рецептором витронектина и, как было ранее продемонстрировано, локализуется на мембране изолированных остеокласт-подобных гигантских клетках человека. Возможно, что микроокружение на поверхности остеокластов может индуцировать специфическую конформацию avb3-интегрина, которая позволяет ему связываться только с OP, т.е. специфичность клеточного связывания может быть высокоизбирательной (Cheng S., et al., 2001).
Интересно, что в проксимальной области OP за RGD-последовательностью находится сайт расщепления тромбином.
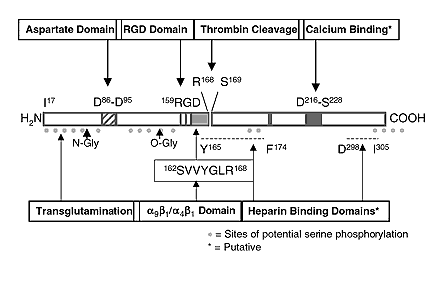
Как показали проведенные за последние несколько лет исследования, происходящее in vivo расщепление OP тромбином имеет существенное физиологическое значение (O'Regan A, Berman J. 2000; Denhardt D., et al., 2001; Yokasaki Y, Sheppard D., 2000; Asou Y., et al., 2001).
В частности, полученные данные позволили убедительно продемонстрировать, что в отличие от нативного OP, его N-терминальный фрагмент, который содержит RGD-домен, поддерживает адгезию линий клеток меланомы. Это предполагает, что некоторые адгезивные свойства OP контролируется через расщепление тромбином. Было также обнаружено, что OP содержит скрытые сайты связывания, которые могут взаимодействовать с отличными от avb3 типами рецепторов. Впоследствии были идентифицированы новые рецепторы интегринового ряда (avb1, avb5, a4b1, a5b1, a8b1, a9b1) (Smith L.L., et al., 1996; Bayless KJ, Davis GE., 2001) и других видов (CD44v6, CD44v7) (Wittig, B.M., et al., 2000; Lin, Y.H. et al. 2000), отвечающие за взаимодействия OP с поверхностью разных типов клеток.
Список литературы:
- Herring G.M. The organic matrix of bone.// The Biochemistry and Physiology of bone., 1972., G.H. Bourne, Ed. V. 1., P. 127 - 189., Academic Press., New York.
- Oegema T., Hascall V., Dziewiatkowski. Isolation and characterization of proteoglycans from the Swarm rat chondrosarcoma.// J.Biol.Chem., 1975.,V.250., P. 6151 - 6159.
- Oldbarg A., Franzen A., Heinegard D. The Primary Structure of a Cell-binding Bone Sialoprotein.// J. Biol. Chem., 1988., V. 263., P. 19430 - 19432.
- Franzen A., Heinegard D. Isolation and characterisation of two sialoproteins present only in bone calcified matrix.// Biochem. J., 1985., V. 232., P. 715 - 724.
- Miyazaki Y., Setoguchi M., Yoshida S., Higuchi Y., Akizuki S., Yamamoto S.// J. Biol. Chem., 1990., V. 265., P.14432 - 14438.
- Hijiya N. , Setoguchi M., Higuchi Y., Akizuki S., Yamamoto S. Cloning and characterization of the human osteopontine gene and its promoter.// Biochem. J.,1994.,V. 303., P. 255 - 262.
- Heinegard D., Hultenby K., Oldberg A., Reinolt F., Wendel M. Macromolecules in bone matrix.// Connect. Tissue Res., 1989., V.21., P. 3 -14.
- Ruoslahti E., Pierschabacher M. New perspectives in cell adhesion: RGD and integrins.// Science, 1987., V.238., P. 491 - 497.
- Nemir M., DeVouge W., Mukherjee B. Normal rat kidney cells secrete both phosphorylated and nonphosphorylated forms of osteopontin showing different physiological properties.//J. Biol. Chem., 1989., V. 164., P.18202 - 18208.
- Nishio S, Hatanaka M, Takeda H, Aoki K, Iseda T, Iwata H, Yokoyama M.Calcium phosphate crystal-associated proteins: alpha2-HS-glycoprotein, prothrombin F1, and osteopontin.// Mol. Urol., 2000, V.4., P. 383 - 390.
- Nomura S., Wills A., Edwards D., Hearth J., Hogan B. Developmental expression of 2ar (osteopontin) and SPARC (osteonectin) RNA as revealed by in situ hybridization.// J. Cell Biol., 1988., V. 106., P. 441 - 450.
- Patarca R., Freeman G., Singh R., Wei F., Durfee T., Blattner F., regner D., Kozak C., Mock B., Morse H., Jerells T., Cantor H. Structural and functional studies of the early T-lymphocyte activation 1 ( Eta-1) gene.// J. Exp. Med., 1989., V. 170., P. 145 - 161.
- Sendger D., Perruzzi C., Gracey C., Papadopoulos A., Tenen D. Secreted phosphoproteins associated with neoplastic transformation. Close homhlogy with plasma proteins cleaved during blood coagulation.// Cancer Res. 1988., V.48., P. 5770 - 5774.
- Nemoto H, Rittling SR, Yoshitake H, Furuya K, Amagasa T, Tsuji K, Nifuji A, Denhardt DT, Noda M. Osteopontin deficiency reduces experimental tumor cell metastasis to bone and soft tissues.// J. Bone Miner Res., 2001., V.16 P. 652 - 659.
- Heingard D., Jirskog-Hed A., Oldberg A., Reinholt F., Weindel M. Bone macromolecules.// Calcium Regulation and Bone Metabolism. Basic and Clinical Asprct., D.V.Cohn, F.H.Gloriex& T.J.Martin, Eds., 1990., V. 10., P. 181 - 187, Excerpta Medica., Elsevier., Amsterdam.
- Oldberg A., Jirskog-Hed B., Axelsson S., Heinegard D. Regulation of bone sialoprotein (BSP) mRNA by steroid hormones. // J. Cell Biol., 1989., V. 109., P. 3183 - 3186.
- Graig A., Smith J., Denhardt D. Osteopontin, a transformation-associated cell adhesion phosphoprotein, is induced by 12-O-tetradecanolphorbol-13-acetat in mouse epidermis.// J. Biol. Chem., 1989., V. 164., P. 9682 - 9689.
- Oldbarg A., Franzen A., Heinegard D. Cloning and sequence analysis of rat bone sialoprotein (osteopontin) cDNA reveals an Arg-Gly-Asp cell-binding sequence.// PNAS USA, 1986., V. 83. P. 8819 - 8823.
- Bautista D, Xuan J., Hota C., Chambers A., Harris J.Inhibition of Arg-Gly-asp (RGD)-mediated Cell Adhesion to osteopontin by a Monoclonal antibogy against Osteopontin.// J. Biol. Chem., 1994., V. 269., P. 23280 - 23285.
- Xuan J., Hota C., Chambers A. Recombinant GCT-human Osteopontin Fusion Protein Is functional in RGD-Depended Cell Adhesion.// J. Cellular Biochemistry, 1994., V.54., P. 247 - 255.
- Cheng S., Lai C., Blystone S., Avioli L. Bone mineralization and osteoblast differentiation are negatively modulated by integrin avb3.// J. Bone Miner Res., 2001., V. 16., P. 277 - 288.
- O'Regan A, Berman J. Osteopontin: a key cytokine in cell-mediated and granulomatous inflammation.// Int. J. Exp. Pathol., 2000, V. 81., P. 373 - 390.
- Denhardt D., Giachelli C., Rittling R. Role of osteopontin in cellular signaling and toxicant injury./Annu. Rev. Pharmacol. Toxicol., 2001, V.41, P.723 - 749.
- Yokasaki Y, Sheppard D. Mapping of the cryptic integrin-binding site in osteopontin suggests a new mechanism by which thrombin can regulate inflammation and tissue repair.//Trends Cardiovasc. Med., 2000., V.10. P.155 - 159.
- Asou Y, Rittling SR, Yoshitake H, Tsuji K, Shinomiya K, Nifuji A, Denhardt DT, Noda M. Osteopontin facilitates angiogenesis, accumulation of osteoclasts, and resorption in ectopic bone.// Endocrinology 2001., V. 142., P. 1325 - 32.
8-09-2015, 20:31
