«С оторванной рукой или ногой лежит такой окоченелый на перевязочном пункте неподвижно. Он не кричит, не вопит, не жалуется, не принимает ни в чём участия и ничего не требует. Тело холодное, лицо бледное, как у трупа; взгляд неподвижен и обращён вдаль; пульс как нитка, едва заметен под пальцем с частыми перемежками. На вопросы окоченелый или вовсе не отвечает, или только про себя чуть слышно шепотом. Дыхание тоже едва приметное. Рана и кожа почти нечувствительны.»
Н.И. Пирогов, 1864 г.
Общие данные
Термин «шок» - собирательное понятие, условный общий термин, которым характеризуют экстремальное состояние жизненно важных функций организма, возникающее в результате воздействия чрезвычайного по силе или продолжительности воздействия раздражителя и выражающееся комплексом патологических сдвигов в деятельности всех физиологических систем, главным образом ЦНС, кровообращения, дыхания, метаболизма, эндокринной системы.
Шок, сам по себе не является диагнозом, нозологической формой, он - только биологическое состояние наивысшей тяжести, последствие какой-либо точной этиологии; он «бурная атака на жизнь».
Краткая история вопроса происхождения термина «шок»
Принято считать, что термин «шок» имеет английское, а так же французское происхождение и означает удар, толчок, потрясение. Он был сознательно введен в медицинскую терминологию в 1832 году английским врачом Джеймсом Латта (впервые применившего внутривенное введение солевого раствора при холере) для обозначения, как писал автор, «травматических депрессий жизненных функций».
Таким образом, впервые слово «шок» применили для описания гиповолемического шока .
Классификация шоковых состояний
Этиопатогенетическая классификация (Тал, Кинней, 1967)
Гиповолемический шок
1) Чистый;
2) В сочетании с сепсисом или сердечной недостаточностью;
Кардиогенный шок
1) Недостаточность эжекционной функции левого желудочка;
2) Недостаточность наполнения левого желудочка;
Септический шок
1) Чистый;
2) В сочетании с сердечной недостаточностью или гиповолемией;
Неврогенный шок (потеря вазомоторного контроля).
Гемодинамическая классификация (Маклин, 1966)
Сердечная недостаточность;
Гиповолемия;
Периферическое переполнение.
Обе классификации используются в зарубежной литературе до настоящего времени и не противоречат друг другу, так как они оценивают одно и то же с разных позиций. К сожалению, обе классификации носят весьма теоретический характер, хотя и достаточно патогенетичны.
Клиническая классификация (по Бунятяну А. А. и соавт, 1984, с изменениями)
Гиповолемический шок;
Травматический шок
1) В результате механических воздействий (раневых, операционных, компрессивных);
2) Ожоговый шок;
3) Электрический шок;
4) Холодовой шок;
Кардиогенный шок;
Септический шок (токсико-инфекционный шок);
Анафилактический шок и анафилактоидные шоки.
Клиническая классификация (по Hardway и Johnson)
Группа шоков, сопровождаемого гипотонией:
1) Холодные кожные покровы
- Объем крови уменьшен (реагирует на трансфузию)
- Объем крови нормальный (слабо реагирует на трансфузию)
2) Теплые кожные покровы
- Спинномозговая анестезия
- Анафилактический шок
- Отравление мышьяком
- Шок, вызываемый сосудорасширителями или ганглиоблокаторами
3) Острая сердечная недостаточность
Группа нормо- или гипертонического шока
1) Компенсированный шок
2) Лечебно субкомпенсированный шок
3) Эпинефриновый шок.
Единая концепция шока
Шок - экстремальное состояние, причины которого многообразны, пусковые механизмы различны, но в любом случае «фокальной точкой функциональных расстройств является периферическое сосудистое ложе», и состояние микроциркуляции при всех видах шока определяет прогноз и исход .
Общую схему патогенеза шокового состояния можно представить так:
- Любой шок - разновидность острого дисстресса, соответственно при нем всегда имеется симпатикотония и активация гипоталамо-гипофизарно-надпочечниковой системы. Медиаторы САС воздействуют на b2 -адренорецепторы миокарда и приводят к тахикардии и усилению сердечного выброса (положительный ино- и хронотропный эффект). Эти же рецепторы в больших количествах содержатся в миоцитах сосудов мышц, головного мозга, коронарных сосудах, сосудах почки. Посредством связанного с рецептором фермента гуанилатциклазы, происходит увеличение внутриклеточного цГМФ, уменьшается содержание цАМФ - уменьшается содержание внутриклеточного Ca++ - расслабление гладкомышечных клеток сосудов - улучшение кровоснабжения мозга, мышц, почек (обеспечение аларма). Так как все катехоламины воздействуют так же на a1 - адренорецепторы, то одновременно происходит сужение сосудов периферии (посредством увеличения цАМФ). Этим достигается «централизация кровообращения» - усиленное кровоснабжение жизненно важных органов, в ущерб периферии.
- Уменьшение притока крови на периферию приводит к развитию метаболического ацидоза.
- Недоокисленные продукты воздействуют на a1 -адренорецепторы пре- и посткапиллярных сфинктеров, вызывая их расширение. Так же вызывают парез капилляров и увеличивают их проницаемость, но так как они в большей степени вызывают расширение прекапиллярных сфинктеров, чем посткапиллярных - патологический застой крови в сосудах периферии - снижение венозного возврата к сердцу - снижение сердечного выброса - усиление гипоксии и метаболического ацидоза на периферии -circulusvitiosus.
- В периферических сосудах развиваются последовательно сгущение крови, сладж-феномен и внутрисосудистое свертывание (ДВС-синдром). Сладж и микротромбооразование еще больше ухудшают перфузию периферических органов и постепенно приводят к развитию ПОН (полиорганная недостаточность).
Острая недостаточность кровообращения и шок
Острая недостаточность кровообращения, осложняющая течение инфекционных болезней, в основном имеет несердечный генез. Она обусловлена развитием периферической циркуляторной недостаточности, классифицируемой как шок . Причем природа шока, развивающегося у инфекционных больных, может быть различной. Это важно подчеркнуть, поскольку задачи и пути выведения больных из шока при разном его генезе неоднозначны. Вместе с тем при всем многообразии причин, вызывающих шок, его развитие всегда свидетельствует о несоответствии между объемом циркулирующей крови и емкостью сосудистого русла. Это несоответствие и определяет нарушение кровоснабжения тканей и критическое уменьшение перфузии тканей, в конечном счете соответствующее развитию шока. При инфекционных болезнях чаще развивается первично-сосудистый или циркуляторный шок (увеличение внутрисосудистой емкости). Относительно реже возникает гиповолемический шок, то есть шок первично обусловленный недостаточностью объема крови (уменьшением внутрисосудистого объема). Эти два типа шока первично–сосудистого и первично-гиповолемического генеза всегда требуют разграничения.
Инфекционно-токсический шок при пневмониях
Заболеваемость пневмонией составляет 10-13,8 на 1000. Среди лиц, старше 50 лет заболеваемость 17 человек на 1000. 4 место среди причин смерти.
Летальность при внебольничной пневмонии оказывается наименьшей (1-3%) у лиц молодого и среднего возраста без сопутствующих заболеваний (ХОБЛ, злокачественные новообразования, алкоголизм, СД, заболевания почек и печени, сердечно-сосудистые заболевания и др.)., а также в случаях тяжёлого течения пневмонии (мультилобарная инфильтрация, вторичная бактериемия, тахипное ³ 30/мин, гипотензия, острая почечная недостаточность) этот показатель достигает 15-30%.
К летальному исходу приводит как правило острая сердечно-сосудистая недостаточность – инфекционно-токсический шок, летальность при котором составляет 30-50%.
ИТШ, развивается при тяжёлых пневмониях, обычно при значительной инфильтрации лёгочной ткани. Он является отражением крайней степени интоксикации, характерной для любой пневмонии. Можно выделить две группы симптомов, которые позволяют заподозрить возможность развития ИТШ у больного с пневмонией:
- Симптомы интоксикационного синдрома – гипертермия более 390 С, тахикардия более 100 в минуту, тахипное более 30 в минуту, изменения сознания (угнетение, реже делирий);
- «Местные» симптомы, свидетельствующие о объёмной и протяжённой инфильтрации лёгочной ткани – поражение более 1 доли или двухсторонняя пневмония. Кроме того, неблагоприятными признаками, свидетельствующие об обширности инфильтрации могут быть следующие физикальные данные:
- Резкое усиление голосового дрожание;
- Абсолютная тупость при перкуссии при отсутствии жидкости;
- Бронхиальное дыхание;
- Звучные хрипы, крепитация.
Ниже приведены наиболее распространенные критерии оценки тяжести пневмонии.
Оценка степени тяжести пневмонии по Никулину К.Г.
| Категория | I | II | III | IV |
| 1. Объем инфильтрата | 1-2 сегмента | Доля или 1-2 сегмента с 2-х сторон | 2 доли или двусторонняя пневмония | 3 и боле долей |
| 2. ЧДД | До 25 | До 30 | До 40 | Более 40 |
| 3. ЧСС | До 90 | До 100 | Более 100 | Более 100 |
| 4. Гипертермия | До 380 | До 390 | Около 400 | Более 400 |
| 5. Синдром интоксикации | Не выражен | Умеренный | Ярко выражен | Резко выражен |
Оценка степени тяжести пневмонии по Дворецкому Л.М., 1996
| Категория | Легкая ст. | Средняя ст. | Тяжёлая ст. |
| Температура | До 380 С | 38-390 С | >390 C |
| ЧДД | До 25 | 25-30 | >30 |
| Цианоз | Отсутствует | Умеренный | Значительный |
| Интоксикация | Отсутствует | Умеренная | Резко выраженная |
| Нарушения сознания | Ясное | Ясное, возможна лёгкая эйфория | Затемненное, возможен бред, галлюцинации |
| Обширность пневмонии по данным R-го исследования | 1-2 сегмента | Большая часть доли, вся доля или несколько сегментов в обоих долях | 2 доли или полисегментарное поражение обоих лёгких |
| Наличие осложнений | - | Экссудативный плеврит с небольшим количеством выпота | Усиление сердечной недостаточности, аритмии и др. |
| Декомпенсация сопутствующих заболеваний | - | Обострение ББ, ИБС, психических заболеваний | Часто |
| Периферическая кровь | Умеренный лейкоцитоз, ускоренное СОЭ | Лейкоцитоз со сдвигом влево до юных форм | Выраженный лейкцитоз, токсическая зернистость нейтрофилов, выраженный свдиг, лимфопения, эозинопения, возможна анемия, значительное ускорение СОЭ |
| Фибриноген, г/л | До 5 | 5-10 | >10 |
Критерии тяжёлого течения пневмонии
| КЛИНИЧЕСКИЕ | ЛАБОРАТОРНЫЕ |
Þ Острая дыхательная недостаточность: - ЧДД >30 в мин.; - Насыщение кислорода <90%; Þ Гипотензия - САД <90 мм.рт.ст.; - ДАД <60 мм.рт.ст.; Þ Билатеральное или многодолевое поражение; Þ Нарушение сознания; Þ Внелёгочный очаг инфекции (менингит, перикардит и др.) |
Þ Лейкопения (<4·109 /л); Þ Гипоксемия - SaO2 <90%; - PO2 <60 мм.рт.ст. Þ Гемоглобин <100 г/л; Þ Гематокрит <30%; Þ ОПН (анурия, креатинин в крови >0,18 ммоль/л, мочевина >15 ммоль/л) |
При наличии хотя бы одного признака из указанных пневмония считается тяжёлой.
Этиология ИТШ при пневмониях
Возбудителями тяжёлой пневмонии чаще всего являются:
- Streptococcus pneumoniae;
- Legionella spp.;
- Staphylococcus aureus;
- Enterobacteriaceae;
Особой формой ИТШ при респираторных заболеваниях является шок, развивающийся при тяжёлом течении гриппа. Из других вирусных инфекций в качестве причин ИТШ следует отметить ветряную и натуральную оспу.
Согласно классическим представлениям, инфекционно-токсический шок является результатом воздействия микробных эндотоксинов (отсюда синоним эндотоксиновый шок) на клеточные мембраны, компоненты свёртывания крови и комплемент. Однако из перечисленных микроорганизмов эндотоксинами обладают лишь представители семейства Entererobacteriaceae. Тем не менее любой из перечисленных микроорганизмов при «благоприятных» условиях может вызвать ИТШ, поскольку способны образовывать экзотоксины, некоторые из которых по свойствам аналогичны эндотоксинами. Однако, грамотрицательная флора чаще вызывает ИТШ (в 70% случаев) по сравнению с грамположительной (30%) и он протекает тяжелее, летальность выше (60-90% при грамотрицательной этиологии и 30-40% при грамположительной).
Экзо- и эндотоксины
Согласно классификации Берджи, царство Procaryotae делят на 4 отдела (а не на два /PhotobacteriaetScotobacteria/, как ранее):
1. Fermicutes (фирмикуты) – бактерии с толстой клеточной стенкой, грамположительные;
2. Gracilicutes (грациликуты) – бактерии с тонкой клеточной стенкой, грамотрицательные;
3. Tenericutes (тенерикуты) – бактерии «мягкие», нежные, без ригидной клеточной стенки, включая микоплазм;
4. Mendosicutes (мендозикуты) – архебактерии, отличаются дефектной клеточной стенкой, особым строением рибосом, рРНК; среди них нет возбудителей инфекционных заболеваний.
Огромное практическое значение среди методик окраски бактерий имеет методика, предложенная в 1884 году Х. Граммом. Все патогенные микроорганизмы до недавнего времени разделяли на грамположительные, окрашиваемые по Грамму в сине-фиолетовый цвет и грамотрицательные, окрашиваемые в красный цвет. Особенности окраски зависят от структуры клеточной стенки бактерии, поэтому более целесообразно разделять бактерии в зависимости от особенностей клеточной стенки, а не от их окраски, связанной с этими особенностями, тем более, что не все бактерии, имеющие «грамотрицательную» клеточную стенку окрашиваются по Грамму в красный цвет и наоборот.
Таким образом, все патогенные микроорганизмы делятся на 2 группы:
| Gracilicutes (грамотрицательные) | Firmicutes ( грамположительные) |
- Спирохеты; - Спириллы; - Палочки; - Вибрионы; - Кампилобактерии; - Риккетсии; - Хламидии; - Нейсерии (менингококки, гонококки) |
- Кокки (стафилококки, стрептококки); - Палочки; - Клостридии; - Бациллы; - Коринебактерии; - Микобактерии; - Бифидобактерии; - Актиномицеты; |
Структура бактериальной клетки
Бактериальная клетка состоит из клеточной стенки, цитоплазматической мембраны, цитоплазмы с включениями и нуклеотида. Дополнительные структуры: капсула, микрокапсула, жгутики, реснички, плазмиды, споры и т.д.
Клеточная стенка – прочная, упругая, придаёт бактериям определённую форму, сдерживает высокое осмотическое давление в бактериальной клетке. Толщина клеточной стенки у грациликут 15-20 нм, у фирмикут – 50 нм (т.е. у фирмикут клеточная стенка в 2-4 раза толще).
В клеточной стенке фирмикут содержится небольшое количество полисахаридов, липидов, белков. Большая часть массы (40-90%) клеточной стенки этих микроорганизмов составляет пептидогликан (муреин, мукопептид), ковалентно связанный с тейхоевыми кислотами (от греч. teichos – стенка), молекулы которых представляют собой цепи из 8-50 остатков глицерола и рибитола, соединенных фосфатными мостиками.
Пептидогликан представлен параллельно распложенными молекулами гликана, состоящего из остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, соединенных гликозидной связью, типа b (1-4). Лизоцим, являясь ацетилмурамидазой, разрывает эти связи.
Гликановые молекулы соединены пептидной связью, поэтому этот полимер назван пептидогликан.
Элементы пептидогликана являются отличительными особенностями бактерий и отсутствуют у человека.
Способность фирмикут при окраске по Грамму удерживать генциановый виолетовый в комплексе с йодом (сине-фиолетовая окраска бактерий) связана со свойством многослойного пептидогликана взаимодействовать с красителем. Кроме того, последующая обработка спиртом вызывает сжимание пор в пептидогликане и задержку красителя в клеточной стенке.
В клеточной стенке грациликут пептидогликана содержится меньше (5-10%). В состав их клеточной стенки входит наружная мембрана, связывающаяся посредством липопротеина с подлежащим слоем пептидогликана.
Наружная мембрана представляет собой волнообразную трёхслойную структуру, сходную с внутренней мембраной, которую называют цитоплазматической. Основным компонентом этих мембран служит билипидный слой.
Наружная мембрана является ассиметричной мозаичной структурой, представленной липополисахаридами, фосфолипидами и белками.
С её внешней стороны расположен липополисахарид, состоящий из 3-х компонентов:
- Липид А;
- Стержневая часть или ядро;
- О-специфическая часть (образована повторяющимися олигосахаридными последовательностями).
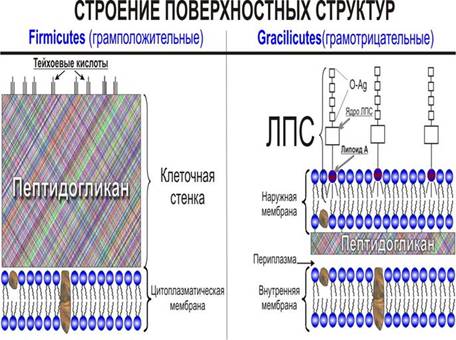 ЛПС «заякорён» в наружной мембране липоидом А, обуславливающем токсичность ЛПС и отождествляемому с эндотоксином. О-антиген определяет серогруппу, серовар бактерии.
ЛПС «заякорён» в наружной мембране липоидом А, обуславливающем токсичность ЛПС и отождествляемому с эндотоксином. О-антиген определяет серогруппу, серовар бактерии.
Экзотоксины
Экзотоксины – белки, представляющие биофункциональную структуру, т.к. они имеют транспортную группу, которая взаимодействует со специфическим рецептором клетки и токсическую группу (активатор), которая проникает внутрь клетки и блокирует жизненно важные процессы.
Экзотоксины делят на 3 класса:
- Класс А. Токсины, секретирующиеся во внешнюю среду (гистотоксин Corynebacteriumdiphteriae; отёчный, летальный токсин Bacillusanthracis);
- Класс В. Токсины, частично секретируемые и частично связанные с микробной клеткой (тетаноспазмин Clostridiumtetani, нейротоксин Clostridiumbotulinum);
- Класс С. Токсины, связанные с микробной клеткой и попадающие в окружающую среду при аутолизе клетки (цито-, энтеро-, нейротоксин Shygelladysenteriae, «мышиный» токсин Yersiniapestis).
Механизм действия белковых токсинов сводится к повышению проницаемости мембран эритроцитов, лейкоцитов и других клеток (мембранотоксины) или к блокаде синтеза белка и других биохимических процессов в клетках (цито-, энтеро- и нейротоксины), либо нарушению взаимосвязи и взаимодействия клеток.
Эндотоксины
Эндотоксины – белково-липополисахаридные комплексы клеточной стенки грациликут, которые выделяются в окружающую среду при лизисе бактерий.
Эндотоксины термостабильны, менее ядовиты, чем экзотоксины, действуют быстро, но не обладают специфичностью действия, малочувствительны к химическим веществам, не переходят в анатоксин.
Антитела, образующиеся к О-специфическим цепям ЛПС, не нейтрализуют их токсическое действие.
Основной точной приложения действия эндотоксинов являются макрофаги, которые в ответ на их действие выделяют эндогенные пирогенны. Кроме того, эндотоксины способны активировать комплемент по альтернативному пути.
Эндотоксиновый шок наиболее демонстративен при менингококковой инфекции. Характерным является появление симптомов шока или усиление их после применения бактерицидных антибиотиков, что связано с интенсивным бактериолизом и выбросом эндотоксинов. Данная реакция встречается и при другой этиологии ИТШ и также при инфекциях, протекающих без явлений шока. Например, с этой реакцией сталкиваются венерологи при лечении вторичного свежего сифилиса. После первых инъекций пенициллина у больных отмечается повышение температуры тела и усиление воспаления в области сифилид – розеолы приобретают более насыщенный розово-красный цвет, становятся хорошо видны, как бы «подкрашиваются». Это связано с интенсивным лизисом бледной спирохеты и усилением иммунных реакций на продукты распада.
Данный тип реакций называется реакцией обострения Герксгеймера-Яриша-Лукашевича или реакцией бактериолиза. Он подтверждает участие в патогенезе шока продуктов распада бактериальных клеток (в случае менингококковой инфекции – менингококкового эндотоксина).
Таким образом, в некоторых случаях при развитии ИТШ и высоком риске участия грациликут в качестве этиологического фактора, предпочтение может быть отдано не бактерицидным, а бактериостатическим антибиотикам.
Патогенез
Инфекционно-токсический шок (син. циркуляторный, септический, грампозитивный, грамнегативный, эндотоксиновый, экзотоксиновый) - развивается в результате воздействия эндотоксинов и бактериальных продуктов на клеточные мембраны, компоненты свертывания крови и комплемент, что приводит к повышению свертываемости, повреждению клеток и нарушению кровотока, особенно микроциркуляции.
Система комплемента состоит не менее чем из 20 различных самоустанавливающихся протеинов и может быть активирована каким-либо одним из по меньшей мере двух пусковых факторов. Во время активации ранее синтезированные биологически активные протеины превращаются в гуморальные медиаторы воспаления и альтерации тканей. Активация комплемента происходит ступенчато, наподобие каскада свертывания крови. Образование полного комплемента приводит к лизису мембраны клеток бактерий, эритроцитов и других тканей. Высвободившиеся во время активации комплемента фрагменты пептидов активируют другие клеточные и гуморальные эффекторные системы. Известны два пути активации системы комплемента: классический и альтернативный. Альтернативная активация (называемая также пропердиновой) может произойти под влиянием неиммунологических факторов, независимо от антител. В литературе имеются данные об активации комплемента липополисахаридами (эндотоксины). Активация комплемента приводит к образованию низкомолекулярных пептидов - факторов комплемента С3,С4 и С5, опосредующих клеточные и гуморальные реакции. Фрагменты С3а, С4а и С5а называют анафилотоксинами. Они стимулируют высвобождение гистамина из тучных клеток и базофилов, вызывают сокращение гладких мышц и увеличивают проницаемость сосудов. Считается, что фрагмент С2 обладает кининовой активностью, вызывая увеличение проницаемости сосудов. Фрагмент С5а, взаимодействуя со специфическими высокоаффинными рецепторами гранулоцитов и тромбоцитов, вызывает агрегацию клеток, усиление прилипания, хемотаксис и активацию клеток. Активированные таким образом нейтрофилы высвобождают метаболиты арахидоновой кислоты, бескислородные радикалы и лизосомальные ферменты, вызывающие воспалительные изменения в тканях и увеличивающие проницаемость капилляров. Данный механизм может иметь определенное значение в возникновении дыхательной недостаточности и вазодилатации при септическом состоянии, вызванном грамотрицательными микроорганизмами.
Литературные данные, полученные в последнее время свидетельствуют также о том, что под влиянием эндотоксинов и других бактериальных продуктов выделяются эндогенные цитокины, основными мишенями для которых являются лейкоциты, эндотелий и сердце. Появляющиеся медиаторы воспаления и сами эндогенные цитокины оказывают большое воздействие на вазомоторный тонус, проницаемость мелких сосудов и агрегацию лейкоцитов и тромбоцитов. Происходит перестройка в терминальном отделе системы кровообращения. В результате этого возникает утрата тонуса как сосудов сопротивления (артериальных), так и объемных (венозных). Кровь может скапливаться в капиллярном русле, а белки плазмы пропотевают в интерстициальную жидкость. В венозной системе также отмечается депонирование крови. В результате стимуляции b-рецепторов открываются артериовенозные шунты конечной части кровотока.
Достаточно важное значение в патогенезе инфекционно-токсического шока в настоящее время придается также образованию в организме нитратов. При воспалительной реакции в организме ключевую роль в образовании нитратов играют макрофаги. Специфический фермент макрофагов - NO-синтаза (макрофагальная, которая локализуется в макрофагах, миокарде и гладкой мускулатуре) превращает аргинин в NO, из которого затем могут образовываться нитриты и нитраты. Главная функция NO, который синтезируется макрофагами, состоит в обеспечении их цитотоксического действия. При активации бактериальными эндотоксинами или Т-лимфоцитами макрофаги усиливают синтез NО-синтазы, которая превращает аргинин в
8-09-2015, 20:45
