Поскольку наиболее частым поводом к гемотрансфузии является кровопотеря, то целесообразно рассмотреть в первую очередь её. Это важно сделать ещё и потому, что в последние годы в наших представлениях о функциональных сдвигах при кровопотере и об опасности этих сдвигов произошли некоторые перемены.
Прежде чем обсудить функциональные изменения в организме при кровопотере, рассмотрим кровь как систему организма.
Кровь как система
Кровь не просто транспортная среда, объединяющая различные органы и ткани в цельный организм. Помимо транспортировки газов, биоактивных веществ, являющихся квантами информации и управления, кровь выполняет многие компенсаторные функции, иммунную защиту и др.
Функции системы крови и примыкающей к ней в прямом и переносном смысле системы лимфы можно систематизировать следующим образом.
Транспортная функция крови - важнейшая, но далеко не единственная среди многих задач, которые выполняет кровь. Благодаря транспортной функции крови совокупность тесно сколоченных органов превращается в организм, качественно новую форму. Кровь транспортирует:
а) газы между лёгкими и прочими органами и тканями;
б) энергетические вещества и продукты метаболизма клеток, подлежащие передаче в другие органы, чтобы поддерживать функции этих органов или подвергнуться в них деструкции;
в) гормоны, ферменты, кинины, цитокины, простагландины и другие биологически активные вещества, предназначенные для иммунной защиты организма, для регуляции метаболизма в каком-либо органе или уже выполнившие свою регуляторную функцию и подлежащие удалению из тканей.
Таким образом, с помощью своей транспортной функции система крови осуществляет массообмен веществ между всеми органами и тканями организма.
Буферная функция крови нередко приравнивается к транспортной, хотя в действительности это не совсем так. Кровь имеет в своём составе мощные буферные системы поддержания кислотно-основного, электролитного и осмотического баланса. Не просто передача кислых или щелочных продуктов и различных ионов из одного места в другое, но активное изменение рН среды (белковый, гемоглобиновый и другие буферы), смещение электролитов между плазмой, тканевой жидкостью и клетками, обеспечивающее возможность передачи информации в организме методом деполяризации и реполяризации клеток, поддержание осмотического баланса немедленной продукцией или, наоборот, деструкцией осмотически активных ионов - вот схематическое, далеко не полное изложение буферирующей функции крови.
Иммунная функция крови заключается в продукции защитных антител, фагоцитов, цитокинов, биофизической блокаде инородных микроорганизмов. Надо ли удивляться, что септическое состояние может оказаться закономерным следствием геморрагического шока?
Самосохраняющая функция крови предназначена для поддержания крови в жидком состоянии, чтобы она могла выполнять свои остальные функции и вместе с тем не вытечь из сосудистого русла, если его целость где-то нарушится. Благодаря этому кровь с её сложной агрегатной структурой всегда сохраняет текучесть при разной скорости кровотока в различных разделах системы кровообращения, не вытекает из повреждённого сосуда, но и не образует тромбы и эмболы при здоровых сосудистых стенках.
Перечисленные функции крови делают её равноправным участником жизненных процессов в организме, и без нормального функционирования крови невозможна работа ни одной системы организма - дыхания, детоксикации, метаболизма и т.п.
Подобно всем органам и системам организма кровь генетически специфична, её клеточный и биохимический состав постоянно самовоспроизводятся. Следовательно, кровь столь же “родная” и незаменимая чужеродными тканями система организма, как и все его прочие системы и органы.
Кровь, как и другие жизненно важные органы и системы, полифункциональна. Поэтому при её повреждении, сокращении её объёма не может быть изолированного повреждения какой-то одной из функций крови. Следовательно, искусственная нормализация только газотранспортной функции крови - это лучше, чем ничего, но отнюдь не полная компенсация всех функций крови.
Подобно прочим системам организма, кровь имеет собственные механизмы аутокомпенсации, а также компенсаторные механизмы, относящиеся к другим системам. Повреждение или сокращение объёма крови, не компенсируемое её собственными механизмами, ведёт к неизбежному изменению функций дыхания, сердечно-сосудистой системы, метаболизма и т.п., направленному на компенсацию кровопотери.
Кровопотеря
Первичные реакции организма на острую кровопотерю зависят и от скорости, с которой сокращается объём крови, и от объёма кровопотери, и от исходного состояния организма.
Компенсаторные реакции
Компенсаторные реакции, начинающиеся в условиях ауторегуляции, предназначены для немедленного восстановления объёма и вслед за этим - качества крови. Компенсаторные механизмы включаются во всех функциональных системах организма, начинаясь с самой системы крови.
Система крови. В условиях, когда сократились количества гемоглобина, изменяется форма кривой диссоциации оксигемоглобина, благодаря чему эффективность передачи 02 тканям возрастает. Известно, что достаточная экстракция кислорода тканями сохраняется даже при гематокрите 15%.
Одновременно включаются механизмы эритропоэза, и в кровоток немедленно поступают новые, в том числе недостаточно зрелые эритроциты и другие клетки крови.
Свёртывающая система крови реагирует гиперкоагуляцией, чтобы быстрее остановить кровотечение, и если эта компенсаторная гиперкоагуляция не прекращается, это может вести (и, как правило, ведёт) к возникновению синдрома рассеянного внутрисосудистого свёртывания, благодаря чему кровотечение усиливается.
Этиология, патогенез и интенсивная терапия этого синдрома в данной работе не рассматриваются, но возможность его возникновения всегда должна учитываться в выработке тактики ведения больных с кровопотерей.
Восстановление объёма крови - это немедленная реакция организма, осуществляемая через гормональную и нервную регуляцию.
При далеко зашедшей кровопотере (геморрагическом шоке) кровь как орган повреждается: нарушается её транспортная функция, страдают системы свёртывания, противосвёртывания и фибринолиза (возникает коагулопатия), нарушается функция ретикулоэндотелиальной системы, иммунной защиты, буферирования и др.
Система кровообращения. Связанная с кропотерей внезапная гиповолемия ведёт к миграции внеклеточной жидкости в сосудистое русло. Физиологический механизм этой миграции заключается в спазме артериол, снижении гидростатического капиллярного давления и переходе перикапиллярной жидкости в капилляр. В первые 5 мин. после кровопотери в сосуды может перейти количество жидкости, соответствующее 10-15% нормального ОЦК.
Повышается секреция антидиуретического гормона гипофиза и альдостерона, которые увеличивают реабсорбцию воды в почечных канальцах, если гломерулярная фильтрация не слишком резко нарушена. Благодаря этому ОЦК перестаёт снижаться или даже увеличивается. Рефлекс, обеспечивающий этот механизм, начинается с волюмрецепторов сердца и крупных сосудов и замыкается через гипоталамус в гипофизе и надпочечниках (рис. 1).
Снижение сердечного выброса ведёт к повышению сосудистого сопротивления в ряде органов и тканей, чтобы направить основной поток крови к мозгу и миокарду. Эта рефлекторная реакция начинается с афферентных нейронов, включающихся в рефлекс с барорецепторов, стимулируемых снижением среднего артериального и пульсового давления. В реакцию вовлекаются и рефлексы с хеморецепторов, стимулируемых снижением локального кровотока и изменением РаО2 и РА СО2 . В первую очередь реагируют сосуды-ёмкости - вены, содержащие около 2/3 ОЦК, благодаря чему запустевание вен - один из важных признаков, требующих активного вмешательства при кровопотере.
Снижение артериального давления может быть приспособительной реакцией организма, направленной на остановку кровотечения. Ретивое применение вазопрессоров на фоне не остановленного кровотечения ради достижения норматива 120/70 мм рт.ст. - это нередкое, к сожалению, последствие заинструктированности врачебного мышления (если такое слово сюда подходит).
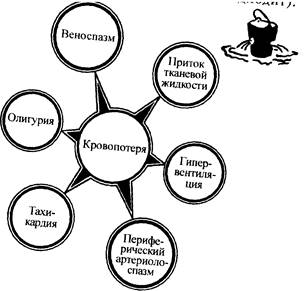
Рис. I. Первичные функциональные сдвиги при кровопотере, направленные на компенсацию сниженного ОЦК.
Если сердечный выброс продолжает снижаться, возникает спазм артериол, предназначенный для централизации кровотока. Однако артериолоспазм ведёт к снижению объёмной скорости кровотока в капиллярах, где вследствие изменения реологии крови происходят агрегация клеток и явления сладжа. Заканчивается это секвестрированием крови в поражённых капиллярах, что ещё больше сокращает ОЦК, нарушает венозный возврат и усиливает гиповолемию.
Стимуляция симпатико-адреналовой активности при гиповолемии не только усиливает периферическое сосудистое сопротивление, но и учащает сердечный ритм, увеличивает силу сердечных сокращений, повышает потребность в кислороде в связи с ростом основного обмена.
В оценке физиологических эффектов гиповолемии следует иметь в виду, что снижение ОЦК на 10% не проявляется ничем, кроме некоторой тахикардии и сокращения сосудов-ёмкостей. Потеря 15% ОЦК ведёт к умеренным реологическим расстройствам, компенсируемым с помощью притока в сосудистое русло тканевой жидкости в течение ближайших 2-3 ч. Гиповолемия при сокращении ОЦК на 20% снижает сердечный выброс и создаёт порочный реологический круг [3].
Система дыхания. Происходит изменение газообмена, носящее разнообразный характер. Вначале приспособительная гипервентиляция, направленная на увеличение венозного возврата присасывающим действием грудной клетки, ведёт к респираторному алкалозу. Насыщение гемоглобина кислородом и содержание кислорода в артериальной крови при этом возрастают незначительно.
Поскольку при гиповолемии кровоток в большинстве органов снижен, а потребность их в кислороде не изменена или даже повышена (стимуляция симпатической системы), венозная кровь, оттекающая от таких органов, содержит мало кислорода и артерио-венозное различие у гипоксического органа увеличено. Таким образом, снижение содержания кислорода в смешанной венозной крови при гиповолемии свидетельствует о том, что больной страдает от гипоксии, даже если содержание кислорода в артериальной крови будет удовлетворительным.
Но и нормальное содержание кислорода в смешанной венозной крови при кровопотере не означает, что гипоксии нет. Просто при крайних степенях гиповолемии капилляры многих тканей могут быть полностью выключены из микроциркуляции и тяжелейшая гипоксия этих тканей не находит отражения в цифрах общего содержания кислорода в смешанной венозной крови.
Подчёркиваем, что в большинстве случаев кровопотери, в том числе массивной (свыше 30% ОЦК), кислородное голодание тканей происходит не столько из-за гемической гипоксии, сколько из-за циркуляторной. Следовательно,первая и главная задача состоит не в том, чтобы добавить гемоглобин, а в том, чтобы нормализовать микроциркуляцию.
Кровопотеря, как и любая гиповолемия всегда повреждает лёгкие, поскольку лёгочный капиллярный фильтр забивается агрессивными медиаторами и метаболитами, приходящими из тканевых систем микроциркуляции. Вместе с ними из тканей поступают агрегаты, закупоривающие лёгочный капиллярный фильтр, и этот совместный удар физиологических следствий гиповолемии по лёгким ведёт к синдрому острого повреждения лёгкого (бывший РДСВ), суть которого состоит в интерстициальном отёке, выраженном альвеолярном шунте, нарушении альвеолокапиллярной диффузии, снижении растяжимости лёгких, увеличивающей кислородную цену дыхания и др. - см. [6]
Взаимозависимость кровообращения и дыхания при гииоволемии более сложна, чем отмечено здесь. Гипервентиляция как приспособительная реакция гиповолемии, направленная на увеличение венозного возврата, сопровождается различным действием вдоха (а также выдоха) на большой и малый круг кровообращения. Так, при вдохе наполнение правого желудочка, лёгочных сосудов, а также правожелудочковый ударный объём увеличиваются, тогда как для левого желудочка те же показатели снижаются. Поскольку на каждый вдох приходится несколько сокращений сердца, давление в аорте и лёгочной артерии во время вдоха меняется в противоположных направлениях. Барорецепторы и рецепторы растяжения лёгких вызывают учащение или замедление сердечного ритма при каждом вдохе.
Такие физиологические взаимоотношения не имеют клинических проявлений в условиях здоровья, но при кровопотере, перикардите, увеличении эластического или неэластического сопротивления лёгких гемодинамические различия при каждом вдохе и выдохе становятся совершенно отчётливыми, apulsusparadoxus, если его искать, обнаруживается почти всегда.
Прочие системы. Кровопотеря сопровождается поражением органного кровотока, в связи с чем в первую очередь нарушается функция почек и печени. Недостаточность ЦНС наступает в последнюю очередь, т.к. централизация кровотока при гиповолемии позволяет довольно долго поддерживать адекватное кровоснабжение мозга.
Метаболизм. Сокращение тканевого кровотока ведёт к нарушению обмена, который из-за недостатка кислорода становится анаэробным. Помимо того, что при этом накапливается молочная кислота, анаэробный гликолиз даёт в 15 раз меньше энергии, чем аэробный. Возникает метаболический ацидоз, который вредно влияет в первую очередь на саму систему кровообращения. Он угнетает миокард, снижает его реактивность на симпатическую стимуляцию и способствует нарастанию гиповолемии, что в свою очередь усугубляет нарушения в системе микроциркуляции. Ацидоз смещает кривую диссоциации оксигемоглобина вниз и вправо, в связи с чем лёгочная капиллярная кровь получает меньше кислорода, чем при нормальном рН. По той же причине в тканях отдача кислорода кровью облегчается. Если преобладает лёгочный эффект, ацидоз ведёт к тяжёлой артериальной и венозной гипоксемии, а если тканевый, то венозная гипоксемия может быть менее выраженной, хотя артериальная сохраняется на прежнем уровне.
Ацидоз увеличивает проницаемость мембран, транссудация жидкости из сосудистого русла возрастает. вследствие чего ОЦК сокращается ещё больше. По той же причине меняется уровень электролитов и гемодинамика страдает из-за дополнительного нарушения сократимости миокарда.
Геморрагический шок
На поздних стадиях массивной кровопотери возникаетгеморрагический шок, по своей сути являющийся полиорганной недостаточностью (ПОН), пусковым механизмом которой стала кровопотеря. Компоненты ПОН при геморрагическом шоке можно систематизировать так.
Во-первых, возникаетгиповолемия с нарушением реологических свойств крови и её секвестрацией в капиллярных системах. Из-за секвестрации крови при геморрагическом шоке исходный ОЦК 5 л после кровопотери 1 л окажется равным не 4 л, а лишь 3-3,5 л, потому что какой-то объём крови секвестрируется в капиллярных системах.
Во-вторых, развиваются генерализованные расстройстваметаболизма - нарушаются окислительно-восстановительные процессы, появляется метаболический ацидоз, изменяются электролитный состав тканей, онкотическое давление и т.д.
В-третьих, ишемия органов приводит к органным расстройствам - почечной, печёночной, лёгочной (подчёркиваем, лёгочной, а не просто дыхательной недостаточности!), нарушению функций миокарда, кишечника и т.д.
В-четвёртых, обостряются или появляются вновь инфекционные болезни игнойно-септические поражения и, наконец, в-пятых, возникает коагулопатия по типу синдрома рассеянного внутрисосудистого свёртывания (РВС*).
Часть этих патологических эффектов даёт некоторое представление о сложности танатогенеза геморрагического шока (рис. 2).
Мы сформулировали бы определение геморрагического шока так:
Геморрагический шок - это полиорганная недостаточность, возникшая вследствие невозмещённой или несвоевременно возмещённой массивной кровопотери.
* Хотя аббревиатура РВС может напомнить реввоенсоветы эпохи революции и гражданской войны, мы предпочитаем это название, а не более распространённое синдром диссемчнировинного внутрисосудистого свёртывания (ДВС). Тогда уж лучше сделать все слова заимствованными из английского языка - диссеминированная интраваскулярная коагуляция - ДИК.
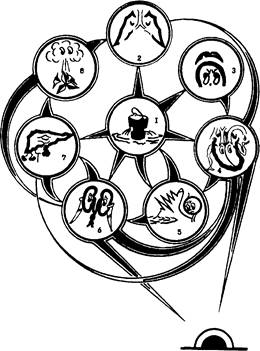
Рис. 2. Физиологические механизмы геморрагического шока. В результате кровопотери (1) возникают острая дыхательная недостаточность по типу острого лёгочного повреждения (2), надпочечниковая (3), миокардиальная (4) недостаточность, коагулопатия (5), острая почечная недостаточность (6), острая печёночная недостаточность (7) и иммуно-септические расстройства (8).
Принципы интенсивной терапии
Поскольку геморрагический шок - это полиорганная недостаточность, принципиально новая патология, при которой кровопотеря была лишь пусковым механизмом, то и интенсивная терапия его должна проходить по стратегии ведения больных с ПОН - см. [5].
Если геморрагический шок - это следствие невозмещённой или несвоевременно возмещённой кровопотери, то, следовательно, своевременное возмещение кровопотери - лучшее средство профилактики геморрагического шока, но не интенсивной терапии, когда он уже развился. В этом случае приходится не столько возмещать кровопотерю (это надо было делать раньше), сколько лечить расстройства, связанные с нарушением функций всего организма, возникшие потому, что кровопотеря не была своевременно возмещена.
Мерами интенсивной терапии геморрагического шока являются восполнение ОЦК, коррекция метаболизма, лечение или профилактика органных расстройств, коагулопатии и септических осложнений.
Восполнение ОЦК
Геморрагический шок есть следствие острой кровопотери, потому что при хронической кровопотере возникает анемия с сопутствующими ей осложнениями, а не геморрагический шок. При восполнении острой кровопотери первостепенная задача - нормализация объёма, а затем уже и качества крови. Обсуждая этот раздел интенсивной терапии геморрагического шока, мы должны прежде всего рассмотреть иерархию инфузии и оценить что, сколько и в какой последовательности вливать в сосудистое русло.
Иерархия инфузии
В интенсивной терапии инфузируемые растворы должны всегда сначала увеличивать объём циркулирующей крови, а затем восстановить функции крови - транспортную, буферирующую, иммунную, а также самосохраняющую, потому что и сама кровопотеря, и её возмещение всегда нарушают эту функцию.
Следует начинать инфузии с кристаллоидных растворов, среди которых незаслуженно мало используется гипертонический раствор (7,5%) хлористого натрия. Физиологический (0,9%) раствор быстро уходит в ткани (в начале это полезно, потому что восстанавливается тканевой сектор жидкости). Но 1 л изотонического раствора Рингера или NaCl увеличивают ОЦК лишь на 300 мл, тогда как 250 мл 7,5% раствора NaCl увеличивают его на 1000 мл за счёт привлечения в сосудистое русло тканевой жидкости.
Так же действует и 25% раствор альбумина, увеличивая ОЦК в 4 раза сравнительно с влитым объёмом альбумина.
Альбумин относится к коллоидным растворам и его недостаток - дороговизна. Другими коллоидными растворами являются декстраны (полиглюкин и реополиглюкин) и препараты гидроксиэтилкрахмала. Главное достоинство этих препаратов в сравнении с кристаллоидами - более продолжительная циркуляция в сосудистом русле, главный недостаток - нарушение свёртывающих свойств крови при переливании больших количеств. Тем не менее, коллоидные и кристаллоидные растворы считаются весьма достойной альтернативой гемотрансфузии в последние годы, включая 1999 г. [18].
Всякая кровопотеря неизбежно сопровождается нарушением самосохраняющей функции крови, и поэтому элементы синдрома РВС наблюдаются при любой кровопотере.
По этой причине при появлении признаков РВС необходимо достаточно рано инфузировать свежезамороженную плазму (СЗП), которая нужна не столько для увеличения ОЦК, сколько для нормализации факторов свёртывания крови. В ней их содержится даже больше, чем в нативной плазме, потому, возможно, что в процессе замораживания стимулируется высвобождение этих факторов из клеток крови.
Кровопотеря меньше 30% ОЦК не требует, как правило, трансфузии крови, потому что транспорт и утилизация кислорода бывают вполне достаточными при уровнях гемоглобина, превышающих 6-7 гр%. Это происходит благодаря компенсаторным реакциям системы кровообращения, метаболизма и самой крови, в которой меняется диссоциация кривой оксигемоглобина, как это рассмотрено выше.
При массивной кровопотере (свыше 30% ОЦК) может потребоваться трансфузия эритроцитарной массы, соотношение которой с СЗП должно быть около 1:3 (а не наоборот).
При выраженной тромбоцитопении (ниже 50-60 тыс/мкл), связанной, как правило, с РВС, может потребоваться трансфузия тромбоцитов.
Сегодня считается, что для трансфузии цельной крови в связи с кровопотерей показаний нет. При вынужденном отказе от гемотрансфузии и недостаточном массообмене 02 при массивной кровопотере следует использовать инфузию перфторана, обеспечивающего достаточный транспорт газов крови, и, возможно, улучшающего микроциркуляцию. Он не замещает все функции крови как органа (см. главу 6).
Алгоритм интенсивной терапии
Едва ли можно создать жёсткую инструкцию по
8-09-2015, 22:14
