РЕФЕРАТ
НА ТЕМУ: ПРЕДСТАВЛЕНИЯ О КРОВЕТВОРЕНИИ , ФУНКЦИИ КЛЕТОК КРОВИ. ОСТРАЯ НЕДОСТАТОЧНОСТЬ КОСТНОГО МОЗГА
2009
СОВРЕМЕННЫЕ ПРЕДСТАВЛЕНИЯ О КРОВЕТВОРЕНИИ
Кровь является внутренней средой организма с определенным морфологическим составом и многообразными функциями. Условно ее делят на две части: клетки (эритроциты, лейкоциты и тромбоциты) и плазму, в состав которой входят белки, углеводы, жиры, ферменты, гормоны, витамины и другие вещества.
Образование клеток крови происходит в кроветворных органах (красном костном мозге, лимфатических узлах и селезенке).
По истечении срока жизни клетки крови разрушаются в системе мононуклеарных фагоцитов. В физиологических условиях процессы кроветворения и кроворазрушения находятся в строгой координации, регулируемой сложными путями (гуморальным, гормональным, нервным), что обеспечивает постоянство клеточного состава крови. Г. Ф. Ланг ввел понятие о системе крови, включающей периферическую кровь, органы кроветворения и кроворазрушения, а также нейрогуморальный аппарат их регуляции.
В основе современных представлений о кроветворении лежит унитарная теория, основные положения которой разработаны А. А. Максимовым, А. Н. Крюковым и др. Исследования последних лет подтвердили гипотезу А. А. Максимова о существовании единой полипотентной кроветворной стволовой клетки. Решающую роль сыграло использование разработанного Тиллом и Мак-Каллоком (1961) метода клонирования кроветворных клеток в селезенку смертельно облученных животных. После внутривенного введения костномозговых клеток здоровых мышей смертельно облученным в селезенке последних возникают кроветворные колонии эритроидного, гранулоцитарного или мегакариоцитарного типа. При повторной трансплантации клеток одной из этих колоний вновь образуются колонии всех трех типов. Результаты эксперимента указывают на наличие в кроветворных органах элементов, обладающих способностью к самоподдержанию, пролиферации и дифференциации во всех направлениях кроветворения, т. е. имеющих черты, характерные для стволовых кроветворных клеток,
В дальнейшем было установлено существование двух популяций стволовых клеток — пролиферирующего пула и пула, состоящего из клеток, находящихся вне митотического цикла, в стадии покоя (G0 ). Последняя популяция составляет основную массу (80—90 %) стволовых клеток. Пролиферативная активность и направление дифференциации стволовых клеток осуществляются клетками стромы, создающими их микроокружение. Одним из основных элементов микроокружения являются ретикулярные, эндотелиальные клетки, фибробласты, остеобласты и др. Клетки стромы оказывают индуктивное влияние на стволовые клетки благодаря непосредственному межклеточному взаимодействию и путем выработки коротко-дистантных гуморальных факторов. Все элементы, составляющие кроветворное микроокружение, имеют свою стволовую клетку, способную к самоподдержанию и дифференцировке в любые элементы микроокружения.
Согласно схеме кроветворения, предложенной И. Л. Чертковым и А. И. Воробьевым в 1973 г. и модифицированной в 1981 г. (рис. 56), все кроветворные клетки делятся на шесть классов.
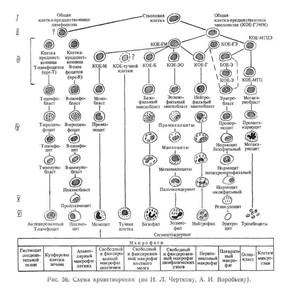
Первый класс составляют полипотентные клетки-предшественницы, к которым относятся стволовые кроветворные клетки.
Второй класс представлен частично детерминированными полипотентными клетками — общей предшественницей (КОЕ-ГЭММ) трех рядов миелопоэза (эритроидного, гранулоцитарного и мегакариоцитарного) и, пока еще гипотетичной, предшественницей двух клеточных разновидностей лимфопоэза.
Третий класс—класс унипотентных клеток-предшественниц — включает в себя несколько типов клеток. Это — клетки-предшественницы Т- и В-лимфоцитов (пре-Т и пре-В); клетка-предшественница гранулоцитомо-ноцитопоэза (КОЕ-ГМ), способная дифференцироваться в моноциты — макрофаги (ряд КОЕ-М) и в гранулоциты: базофильные (ряд КОЕ-Б), эозинофильные (ацидофильные) (ряд КОЕ-ЭО), нейтрофильные (ряд КОЕ-Г); эритроцитарные клетки предшественницы: гранудоцитарно-эритроцитарная (КОЕ-ГЭ), бурстобразуюшая (БОЕ-Э), подразделяемая на незрелую и зрелую, эритроид-ная колониеобразуюшая единица КОЕ-Э); предшественницы мегакаэиоцитов (КОЕ-МГЦЭ и КОЕ-МГЦ).
Источником образования моноцитов и эозинофильных гранулоцитов, кроме гранулоцитарно-моноцитарной клетки, могут быть самостоятельные клетки-предшественницы, а нейтрофильных гранулоцитов — самостоятельная гранулоцитарная клетка-предшественница (КОЕ-Г) и смешанная гранулоцитарно-эритроцитарная клетка-предшественница (КОЕ-ГЭ).
Предполагается также существование помимо общей гранулоцитарно-моноцитарной клетки-предшественницы самостоятельных предшественниц базофильных гранулоцитов и тучных клеток (тканевых базофилов).
Как видно из представленной схемы, третий класс клеток-предшественниц (поэтинчувствительных клеток) разделен на два подкласса: клеток, способных к дифференцировке в направлении двух ростков, и клеток, дифференцирующихся лишь в одном направлении.
Клетки, входящие в первые три класса, относятся к группе морфологически недифференцируемых, в них не выявлены также и специфические цитохимические признаки.
Четвертый класс составляют морфологически распознаваемые пролиферирующие клетки; пятый — созревающие клетки различных рядов и шестой — зрелые клетки.
Из соответствующих костномозговых предшественниц развиваются две популяции лимфоцитов, неактивных до прохождения через один из органов иммуногенеза — вилочковую железу (тимус) или сумку (bursa) Фабриция у птиц и ее аналоги у млекопитающих (костный мозг и Др.). Т-лимфоциты (тимусзависимые) и В-лимфоциты (тимуснезависимые) являются иммунокомпетентными и поступают в периферические лимфоидкые органы. На дифференциацию Т-лимфоцитов в вилочковой железе оказывают влияние эпителиальное микроокружение и гормоны вилочковой железы.
В результате дифференцированного влияния центральных органов иммунитета Т- и В-лимфоциты приобретают специфические для каждой популяции клеток свойства (маркерные антигены и поверхностные рецепторы), которые и обусловливают специфику их функций.
Так, Т-лимфоциты участвуют в реакциях клеточного иммунитета, осуществляют иммунный надзор за генетическим постоянством организма, а В-лимфоциты ответственны за реакции гуморального иммунитета, способны образовывать антитела. Обе популяции лимфоцитов взаимодействуют друг е другом. Т-лимфоциты. воздействуя на В-лимфоциты, повышают их способность к антителообразованию.
Клетка — предшественница В-лимфоцитов является исходным звеном гистогенеза плазматических клеток.
Как видно из представленной схемы кроветворения, первой морфологически распознаваемой клеткой гранулоцитопоэза является миелобласт, за ним следуют пролиферирующие элементы — промиелоцит и миелоцит, затем созревающие клетки — метамиелоцит и палочкоядерный гранулоцит, заканчивается ряд зрелыми клетками — сегментоядерными гранулоцитами.
Клетки моноцитарного ряда, обладающие способностью к фагоцитозу (в том числе иммунному), пиноцитозу и свойством прочно прилипать к поверхности стекла, объединены в систему мононуклеарных фагоцитов (СМФ).
Элементы этого ряда имеют костно-мозговое происхождение, общего с гранулоцитами предшественника (колониеобразующую клетку КОЕ — ГМ), проходят в своем развитии стадии монобласта, промоноцита и моноцита. Моноциты представляют собой подвижный пул относительно незрелых клеток, которые, попадая с током крови или лимфы в различные органы и ткани, превращаются в макрофаги, способные к фагоцитозу.
В настоящее время в СМФ не включают ретикулярные и эндотелиальные клетки, а также фибробласты, так как они не способны к иммунному фагоцитозу, не являются «профессиональными» фагоцитирующими элементами, фагоцитируют факультативно; кроме того, не доказано их происхождение из монобластов.
Этапы эритроците-, тромбоцитои лимфоцитопоэза — см. рис. 56.
Плазматическая клетка развивается из плазмобласта через стадию проплазмоцита.
ФУНКЦИИ КЛЕТОК КРОВИ
Эритроциты помимо основной, дыхательной, функции активно участвуют в регуляции кислотно-основного равновесия организма, адсорбции токсинов и антител, а также в ряде ферментативных процессов.
В сложной регуляции эритроцитопоэза ведущее значение придается гуморальным влияниям, связанным с изменением насыщения крови кислородом. Большую роль в этом процессе играют эритропоэтины, которые воздействуют на стволовые клетки, направляя их дифференциацию в сторону эритроидного ряда. Содержание эритропоэтинов повышается при гипоксии, анемии, особенно при острой кровопотере и гемолизе. Антагонистом эритропоэтина является обнаруженный в крови и моче ингибитор эритропоэза. Взаимодействием эритропоэтина и его ингибитора обеспечивается гомеостаз массы циркулирующих эритроцитов.
В организме человека ежедневно разрушается около 1 % эритроцитов (по истечении срока их жизни, составляющего около 120 дней) и такое же количество их вырабатывается за сутки в костном мозге. Недостающее количество эритроцитов в периферической крови пополняется за счет зрелых эритроцитов и отчасти ретикулоцитов, поступающих из костного мозга, что регулируется вегетативной нервной системой.
Основная функция лейкоцитов — фагоцитарная — осуществляется главным образом нейтрофильными гранулоцитами. Они являются функционально-активными клетками, обладают фагоцитарной способностью, участвуют в процессах регенерации тканей. Способность к самостоятельному движению обеспечивает выход их из сосудистого русла в очаг повреждения тканей. Функциональная активность гранулоцитов связана с наличием в них окислительных ферментов, щелочной фосфатазы и других веществ (гликогена, липидов, белков).
Для эозинофильных (ацидофильных) гранулоцитов характерна дезинтоксикационная функция, особенно антигистаминная. Они принимают активное участие в аллергических реакциях, обычно сопровождающихся образованием значительного количества гистамина.
Функция базофильных гранулоцитов мало изучена. Благодаря значительному содержанию в них гистамина и гепарина они играют определенную роль в аллергических процессах и в антисвертывающей системе крови.
Основная функция моноцитов и других клеток, входящих в СМФ,— фагоцитоз.
Лимфоциты принимают активное участие в осуществлении реакций гуморального (В-лимфоциты) и клеточного (Т-лимфоциты) иммунитета. Большие лимфоциты выполняют также фагоцитарную функцию. Т-лимфоциты отличаются большей продолжительностью жизни, чем В-лимфоциты, и обладают более выраженной способностью к рециркуляции, В зависимости от характера и степени-участия в иммунных реакциях количественные соотношения Т- и В-лимфоцитов в органах и тканях различны: в лимфатических узлах соответственно 65—70 и 30—35 %, в селезенке — 30 и 70 %, в периферической крови — 80 и 20 %.
В настоящее время подтверждены данные о наличии в крови так называемых нулевых лимфоцитов, несодержащих специфических для Т- и В-лимфоцитов маркеров.
Все Т-лимфоциты способны распознавать антиген. По своим функциональным возможностям Т-лимфоциты подразделяются на хелперы, киллеры и супрессоры. Т-хелперы (помощники), не участвуя непосредственно в реакции с антигеном, осуществляют стимуляцию других клеток. Среди них различают хелперы Т-Т — помощники других (эффекторных) Т-лимфоцитов и хелперы Т-В — помощники В-лимфоцитов. Последние дают сигнал В-лимфоцитам к началу дифференцировки. Т-киллеры (убийцы) уничтожают чужеродные клетки, активно прикрепляясь к ним. Т-су-прессоры осуществляют регуляцию иммунного ответа, определяя его объем, своевременность прекращения иммунологической реакции и подавляя ответ на антиген, создают, таким образом, состояние иммунологической толерантности (ареактивности). Дефицит Т-супрессоров приводит к аутоиммунным нарушениям в связи с выходом из-под их контроля некоторых клонов В-лимфоцитов, вырабатывающих аутоантитела.
Плазматические клетки участвуют в иммунных реакциях, являются одним из источников образования антител (иммуноглобулинов).
Продолжительность жизни различных видов лейкоцитов неодинакова. У эозинофильных гранулоцитов она колеблется от нескольких часов до 6—10 дней, у нейтрофильных равна 12—14, у лимфоцитов — приблизительно 100 дням.
Регуляция лейкопоэза очень сложна и до конца еще не изучена. Не выявлен основной фактор, влияющий на пролиферацию и дифференциацию лейкоцитов. Большое значение в этих процессах придается нейрогуморальным факторам, витаминам, гормонам и особенно нуклеиновым кислотам.
В настоящее время доказано существование гуморальных стимуляторов лейкопоэза — лейкопоэтинов и их ингибиторов. Теоретически допускается наличие гуморальных регуляторов для каждого вида лейкоцитов.
Одной из основных физиологических функций тромбоцитов является участие их в процессе свертывания крови. Занимая в сосудах краевое положение, они создают преграду для прохождения эритроцитов через стенку капилляров. При этом большую роль играет так называемая ангиотрофическая функция кровяных пластинок, заключающаяся в их способности поддерживать нормальную структуру и функцию стенок микрососудов путем «подкормки» эндотелиальных клеток. Смыкаясь с эндотелиальными клетками, тромбоциты «изливают» в них свое содержимое. Лишение клеток эндотелия этой «подкормки» вызывает быструю их дистрофию, что приводит к повышению ломкости и проницаемости сосудистой стенки и выходу путем диапедиза эритроцитов за пределы капилляра. В результате образуются мелкие кровоизлияния — петехии.
Как показали электронно-микроскопические исследования, в периферической части тромбоцита (гиаломере) имеется множество волоконец, образующих псевдоподии, которые способствуют прилипанию тромбоцитов к сосудистой стенке и друг к другу, фиксации в сети фибрина и т. д. При нарушении целостности стенки сосудов происходит повреждение и тромбоцитов с выделением тромбопластина, и других гемокоагулирующих факторов, источником которых является центральная часть тромбоцита (грануломер). В результате адгезии и агрегации тромбоцитов образуется первичная тромбоцитарная пробка. Тромбоциты выделяют также серотонин, повышающий сосудистый тонус, ретрактозим, влияющий на ретракцию кровяного сгустка, и ряд пластиночных факторов, участвующих в свертывании крови. Имеются данные об ингибирующем влиянии тромбоцитов на фибринолиз. Кроме того, тромбоциты способны адсорбировать гистамин, они являются также переносчиками антител. Продолжительность жизни тромбоцитов — 8—12 дней.
До последнего времени считали, что кровоточивость возможна только при уменьшении количества тромбоцитов ниже критических цифр — 30— 35 Г/л. Однако нередко, несмотря на резкую тромбоцитопению, геморрагических проявлений нет и наоборот — выраженная кровоточивость возможна на фоне нормального и даже резко повышенного количества тромбоцитов. Механизм развития кровоточивости при тромбоцитопеническом состоянии связан не только с изменением количества тромбоцитов, но и с их функциональной неполноценностью.
Регуляция тромбоцитопоэза осуществляется путем гуморального воздействия стимулирующих (тромбоцитопоэтины) и ингибирующих (тромбоцитопенины) факторов, вырабатываемых селезенкой и находящихся в определенной взаимосвязи. В табл. 21 приведены нормы периферической крови и клеточного состава костного мозга.

Острая недостаточность костного мозга
Острая недостаточность костного мозга представляет собой быстро развивающуюся (в течение нескольких дней или недель) остановку кроветворения. Такое состояние гемопоэза может возникнуть после воздействия на организм различных факторов — общего облучения, цитостатических препаратов, некоторых лекарственных средств, промышленных и пищевых ядов. Миелотоксические агенты при этом влияют на стволовую клетку, подавляя ее дальнейшее развитие.
Клиника. Основными признаками острой недостаточности костного мозга являются его опустошение и развитие анемии, лейкопении, тромбоцитопении. Наличие этих симптомов определяет всю клиническую картину заболевания (инфекционные процессы, кровоточивость, гипоксия). Самое тяжелое проявление острой недостаточности костного мозга — миелотоксический агранулоцитоз, приводящий к инфекционным осложнениям, которые развиваются при снижении количества гранулоцитов до 0,5—0,75 Г/л,
Чаще всего наблюдаются ангина, язвенно-некротические изменения в глотке, как правило, без воспалительного демаркационного вала вокруг и без реакции регионарных лимфатических узлов. На втором месте по частоте стоит пневмония, клиника которой отличается скудной физической и рентгенологической симптоматикой в связи с отсутствием в крови и тканях нейтрофильных гранулоцитов. Притупление перкуторного звука едва заметно, выслушивается лишь легкая крепитация на ограниченном участке. Реже наблюдаются инфекционные поражения кожи и мягких тканей (фурункулы, абсцессы, рожа и др.). На второй-третьей неделе, если уровень гранулоцитов остается низким, развивается септикопиемия с очагами инфекции в различных органах, недостаточность почек и печени.
Геморрагический диатез обусловлен прежде всего тромбоцитопенией. Кровоточивость возникает обычно при снижении количества тромбоцитов до 20—30 Г/л. Отмечается также повышение проницаемости и снижение резистентности стенки сосудов. В отдельных случаях в патогенезе кровоточивости играет роль дефицит прокоагулянтов или избыток антикоагулянтов.
В связи с гранулоцитопенией, тромбоцитопенией, сопровождающейся кровоточивостью, и цитостатическим воздействием агентов, вызвавших острую недостаточность костного мозга, на клетки слизистой оболочки пищевого канала развивается некротическая энтеропатия (язвенно-некротические изменения в пищеводе, кишках). Некротическая энтеропатия проявляется болью в животе, вздутием, урчанием, жидким стулом.
Анемия при острой недостаточности костного мозга развивается не сразу, так как миелотоксические агенты, воздействуя на костный мозг, практически не разрушают эритроциты в периферической крови. Значительная убыль эритроцитов и гемоглобина, вызывающая гипоксию, возникает спустя 3—4 недели от начала заболевания. Больные ощущают при этом одышку, шум в голове, головокружение, наблюдаются обморочные состояния.
Прогноз. При острой недостаточности костного мозга миелотоксического генеза спонтанное восстановление гемопоэза принципиально возможно и зависит от продолжительности жизни больных в условиях риска смертельных осложнений во время периода миелодепрессии. Поэтому важное значение имеет профилактика осложнений, особенно инфекционных.
Профилактика осложнений сводится к предупреждению экзогенных и эндогенных инфекций (изоляция больных в боксы и изоляторы с асептическими условиями, обработка кожи, видимых слизистых оболочек, подавление активности кишечной флоры антибактериальными препаратами, исключение подкожных и внутримышечных инъекций, введение лекарственных средств только внутривенно через катетер).
Лечение. Введение антибиотиков широкого спектра действия (гентамицина, цефалоридина — цепорина, канамицина, карбенициллина, оксациллина, метициллина и др.) в максимальных дозах, лучше в комбинации (например, цепорин с ампициллином, оксациллином или метициллином, или с двумя из вышеуказанных антибиотиков) с учетом чувствительности флоры к антибактериальным препаратам. Назначают большие дозы леворина или нистатина (до 5 000 000 ЕД и выше). В случае недостаточного эффекта противовоспалительную терапию усиливают препаратами направленного действия (антистафилококковой плазмой, антистафилококковым гаммаглобулином, гипериммунной плазмой против кишечной палочки, переливанием лейкоцитной массы и др.).
При язвенно-некротических процессах в полости рта назначают полоскание 2 % раствором натрия гидрокарбоната (питьевой соды) или 0,5 % раствором новокаина, ванночки и аппликации со слабыми антисептиками (1 % раствором перекиси водорода, 0,25 % раствором хлорамина, фурацилином (1 :5000), 10% раствором прополиса и др.). При диарее, вызванной некротической энтеропатией, применяют порошки, содержащие по 0,5 г дерматола, висмута и мела. В ряде случаев назначают парентеральное питание, введение солевых растворов (изотонического раствора натрия хлорида, глюкозы, раствора Рингера). При тромбоцитопенической кровоточивости наиболее эффективно переливание тромбоцитной массы. Местно применяют гемостатическую губку, тромбин, гемофобин, препараты оксицеллюлозы. Для купирования анемии назначают переливания тщательно подобранной эритроцитной массы. Трансплантация костного мозга показана в тех случаях, когда спонтанное восстановление кроветворения невозможно.
Использованная литература
1. Внутренние болезни / Под. ред. проф. Г. И. Бурчинского. ― 4-е изд., перераб. и доп. ― К.: Вища шк. Головное изд-во, 2000. ― 656 с.
8-09-2015, 22:51
