РЕФЕРАТ
НА ТЕМУ: РОЛЬ НЕРВНОЙ СИСТЕМЫ В ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ
2009г.
РОЛЬ НЕРВНОЙ СИСТЕМЫ В ВОСПАЛИТЕЛЬНОЙ РЕАКЦИИ
Туберкулезные микобактерии, попав в организм, тотчас же вызывают реакцию, развивающуюся в значительной мере под влиянием нервной системы. Осевшие туберкулезные палочки раздражают чувствительные окончания интерорецепторного аппарата, что вызывает рефлекторное расширение прилегающей к месту раздражения капиллярной кровеносной сети и развитие гиперемии со всеми последующими, весьма сложными изменениями морфологического и обменного характера, обусловленными особенностями иннервации и спецификой обмена веществ данной ткани. Первичный рефлекторный процесс представлен нервной дугой, замыкающейся в симпатических узлах, спинном мозгу, продолговатом мозгу или гипоталамической области, и находится под контролем корковых центров, которые обусловливают сложную координирующую динамику возбуждения и торможения.
Перераздражение клеток коры мозга и рецепторного аппарата очага воспаления сопровождается нарушением нормальных физиологическихпроцессов и развитием изменений дистрофического характера. Этому же способствуют и возникающие при хроническом туберкулезе дегенеративные изменения в нервных волокнах, что обнаружено в блуждающем нерве и его ядрах (В. Г. Штефко). Степень тяжести воспалительных изменений зависит от ряда причин, первое место среди которых занимают функциональные особенности нервной системы, ее чувствительность к токсину, сила раздражения, обусловленная количеством проникших бактерий, и способность их к размножению в условиях той или другой ткани.
В дальнейшем при неблагоприятном течении воспалительной реакции распространение процесса, сопровождающееся увеличением зоны токсического раздражения рецепторного аппарата, еще более отягощает течение туберкулеза за счет не только перераздражения центральной нервной системы, но и непосредственного угнетения физиологических процессов ее токсинами. Такое положение, длительно существующее, может часто привести к необратимым изменениям.
В последнее время широко проводятся основанные на учении И. П. Павлова исследования по терапии инфекционных заболеваний путем уменьшения процессов возбуждения в центральной нервной системе усилением торможения. Исследования в этом направлении указывают на возможность эффекта от таких мероприятий и при туберкулезной инфекции.
Наши опыты показывают, что воспалительная реакция на туберкулезную инфекцию в брюшной полости морских свинок несколько уменьшается при кормлении их малыми количествами бромистого натрия в течение нескольких дней до заражения и после него. Однако надо считать, что для успешной разработки этого направления необходимы серьезные исследования тонких клеточных процессов, обусловливающих реакции возбуждения и торможения в клетках центральной нервной системы.
Морфологические изменения воспалительной реакции при туберкулезе хорошо изучены. Исследования показывают, что клеточная реакция на месте оседания туберкулезных микобактерий возникает уже с момента их проникновения в ту или другую ткань.
Реакция в разных тканях на туберкулезные микобактерий несколько различна, будучи обусловлена их специфическими особенностями (характером васкуляризации, спецификой обмена и т. п.). В отдельных случаях это имеет настолько выраженный характер, что при небольшом количестве бактерий или небольшой их вирулентности туберкулезный процесс в некоторых органах не развивается. Исследования показали, что внутривенное заражение животных, обеспечивающее равномерное «обсеменение» всего организма, дает, однако, различную пораженность органов туберкулезом — наиболее бывают поражены легкие и лимфатические внутригрудные узлы (3. А. Лебедева).
В развитии воспаления установлена большая роль клеток соединительной ткани (по другим авторам, ретикуло-эндотелиальной, активной мезенхимы). Клетки этой ткани, составляя основу всех органов и эндотелиально-капиллярный барьер и принимая участие в обменных процессах организма и кроветворении, обладают, кроме того, тремя исключительно важными в иммунологическом отношении свойствами — способностью к фагоцитозу, бактериолизу и морфологическим превращениям.
По И. И. Мечникову, исход инфекции — встречи организма с микробом — определяется Функциональной активностью этой ткани и в особенности активностью бактериолиза. Последнее обстоятельство в отношении ряда бактерий является решающим; однако по отношениюк туберкулезным палочкам, обладающим исключительно большой резистентностью, разрушение их в полной мере наблюдается не у всех животных. Ярким примером полного лизиса туберкулезных палочек, обусловливающего полный иммунитет, является гусеница пчелиной моли в фагоцитах которой наблюдается полное разрушение захваченных ими бактерий (С. И. Метальников).
У других животных с менее выраженной силой внутриклеточных ферментативных процессов, по И. И. Мечникову, обусловливающих пищеварительную функцию клеток, разрушение бактерий происходит слабее, но влияние фагоцитоза не остается бесследным и в этих случаях. Туберкулезные микобактерии, пробывшие некоторое время в фагоцитах, если заметно и не разрушаются, то все же, как показали наши опыты, значительно ослабляются. Мы наблюдали, что реакция этой ткани на туберкулезные микобактерии у животных, резистентных к туберкулезу (например, у крыс), складывается выгоднее, чем у животных, чувствительных к нему (у морских свинок). Так, при введении туберкулезных микобактерии крысам в брюшную полость развивающийся экссудат содержит значительно больше клеточных элементов. Преобладают наиболее стойкие к токсинам и наиболее способные к их разрушению лимфомоноцитарные элементы; появляются они скорее, чем у чувствительных к туберкулезу животных. Способность к фагоцитозу и бактериолизу у них также значительно больше, чем у морских свинок. Клинические наблюдения показали более высокую фагоцитарную активность лейкоцитов у больных с доброкачественным течением туберкулеза (Г. Е. Платонов, 3. Н. Шаврова, Μ. Μ. Плисецкий и др.).
Наши опыты показывают, что воспалительная реакция при заражении животных вирулентным, сильно токсическим штаммом туберкулезных микобактерии отличается от таковой при апатогенном штамме; это особенно выражается в низкой фагоцитарной и бактериолитической деятельности клеток экссудата. При этом клетки, захватившие микобактерии туберкулеза, скоро подвергаются дегенеративным изменениям и погибают. Полиморфноядерные лейкоциты (микрофаги) оказываются более чувствительными к туберкулезному токсину, погибая уже через 24 часа; более устойчивы в этом отношении моноцитарные и эпителиоидные клетки. Устойчивость клеток к бактерийным токсинам находится в связи с активностью их внутриклеточных ферментов.
Значение этого фактора подтверждается и наблюдениями над культурой ткани, показавшими, что лейкоциты больных фиброзными формами туберкулеза обладают повышенной стойкостью к туберкулезному токсину.
При образовании бугорков отмечается ряд последовательных изменений, механизм смены которых до настоящего времени еще полностью не разгадан; несомненно, решающее значение в этой смене имеет реактивность нервной системы и чувствительность к сложным веществам, образующимся в очаге воспалительной реакции.
Процесс начинается с появления инфильтрата в гиперемированном участке ткани за счет иммиграции лейкоцитов через стенку капилляров с развитием в той или иной степени фагоцитоза и бактериолиза.
Через 1—2 дня лейкоциты претерпевают дегенеративные изменения, а на 3-й день в образовании воспалительного инфильтрата принимают участие клеточные элементы, образующиеся за счет пролиферации местных соединительнотканных элементов: лимфоциты, моноциты, эпителиоидные клетки и т. п. Такие превращения наблюдаются и в культуре ткани, зараженной туберкулезом (А. А. Максимов, А. Д. Тимофеевский и др.).
Место оседания туберкулезных микобактерий окружается клетками мононуклеарного типа с образованием гигантских клеток. Несколько позже этот крупноклеточный инфильтрат окружается слоем лимфоцитов и молодых фибробластов. Образовавшийся таким образом «туберкулезный фолликул» подвергается обычно в центре коагуляционному некрозу с распадом на глыбки белкового вещества из распадающихся ядер и протоплазмы лейкоцитов.
Воспалительная реакция на туберкулезные микобактерий протекает в основном по экссудативному или продуктивно-фиброзному типу. Это определяется, видимо, специфической чувствительностью нервной системы и наличием в последнем случае в клетках ферментов, обеспечивающих достаточно полное разрушение туберкулезных микобактерий.
Установлено, что фосфатиды туберкулезных микобактерий вызывают типичные морфологические туберкулезные изменения в организме с эпителиоидными и гигантскими клетками, а жировосковая их фракция — казеозные изменения. Естественно предположить, что при наличии в тканях соответствующих ферментов, обладающих большой активностью разрушения этих веществ, это должно привести к уменьшению развития изменений, вызываемых этими веществами.
В связи с этим как для понимания различных морфологических проявлений развития воспалительной реакции организма на туберкулезную инфекцию, так и для выяснения факторов заживления исследование ферментативных реакций является при этом существенным средством.
Рассмотрение материалов, посвященных изучению иммунитета, показывает, что среди разных факторов, обусловливающих ту или иную сопротивляемость макроорганизма инфекции, огромное значение имеют ферментативные процессы, от активности которых зависит функциональное состояние всех органов и организма в целом.
Самые сильные токсины — столбнячный, змеиный, дифтерийный и др. легко обезвреживаются ферментами: так, введение их через рот не вызывает смертельных явлений, возникающих при введении в ток крови, где ферменты менее, активны. Фагоцитированные бактерии являются для клеток питательным субстратом, подвергающимся ферментативному расщеплению. От интенсивности клеточных ферментов и соответствия их «набора» составным частям бактерий зависит судьба микроба — либо микроб погибает, либо остается невредимым, и начинает преобладать процесс его деятельности — размножение. Образующиеся токсины, как показали наши опыты, угнетают основные физиологические процессы макроорганизма.
На характер и исход «защитных» реакций организма при туберкулезе оказывают значительное влияние ферменты, расщепляющие специфические жиры и фосфатиды туберкулезных бактерий, под действием которых образуется собственно специфическая ткань (эпителиоидные, гигантские клетки, казеоз и т. п.).
Малая устойчивость к туберкулезу у некоторых животных отчасти объясняется отсутствием у них специфических липаз и фосфатов, способных расщеплять необычные жировоски и фосфатиды туберкулезных микобактерий.
Наибольшее значение имеют окислительные ферменты, так как, помимо питания организма, они принимают решающее участие в основных процессах иммунитета—в бактериолизе и разрушении токсинов (А. Н. Бах и В. А. Энгельгардт).
Решающую роль оксидаз в. разрушении туберкулезных палочекдоказал Н. Ф. Гамалея и подтвердили наши опыты.
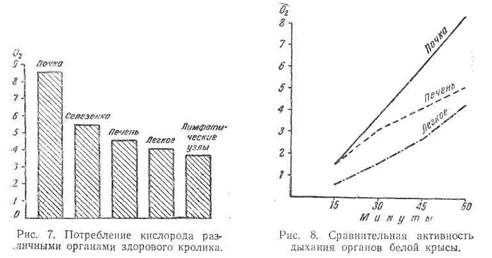
Мы смогли обнаружить чрезвычайно интересный и парадоксальный факт, что легкие, «купающиеся» в кислороде вдыхаемого воздуха, обладают наравне с лимфатическими узлами, самой низкой активностью окислительно-восстановительных процессов, в чем и кроется, повидимому, одна из причин пораженное легких туберкулезом (рис, 7).
Этому способствует и малая активность других ферментов в них — каталазы, липазы и протеолитических ферментов.
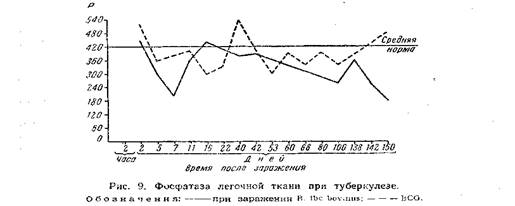
Окислительные процессы в легких уступают таковым в других органах и по скорости течения, как показывают приведенные ниже данные (рис. 8).
На диаграмме весьма убедительно выделяется наименьшая активность дыхания легочной ткани как по величине, так и по скорости его в почечной ткани максимум поглощения кислорода почти вдвое выше чем легких, уже через 15—20 минут.
Это имеет большое иммунобиологическое значение, так как определяет скорость разрушения бактерийных токсинов, чем предотвращается их вредящее действие на ткани. Такое же явление обнаружено и по отношению к другим, не менее важным в иммунологическом и физиологическом отношении ферментам — фосфатазе и дезаминазам.
При исследовании ферментов, расщепляющих фосфатиды, оказалось, что фосфатаза легких мышей действует быстрее, чем фосфатазы кролика и морской свинки (по отношению к моно- и диэстеразам).
Выявилась и другая важная особенность. Оказалось, что легкие морских свинок и мышей содержат довольно много лецитиназы (и фосфатазы), но активность этих ферментов у свинок угнетается присутствием даже небольших количеств жирных кислот туберкулезных палочек, что не наблюдается у мышей, эти энзимы легких кролика занимают промежуточное место. Легкие мышей, в отличие от легких морских свинок, содержат фермент, расщепляющий фосфатиды туберкулезных палочек, способствуя тем самым их разрушению.
Весьма интересны данные, характеризующие с ферментативной стороны лимфатические узлы как ткань, на фоне которой начинается туберкулез. По ряду ферментативных показателей лимфатические узлы являются малоактивными, приближаясь к легким (Г. Е. Платонов). Видимо, этим и объясняется неполнота бактериолиза в них, что делает возможным длительное пребывание в них палочек и распространение инфекции. Так, по интенсивности окислительных процессов, приближаясь к легким, лимфатические узлы в 2—3 раза слабее, чем почки (органа с большей резистентностью к туберкулезу). Оказалась менее активной, чем в легких, и липаза, хотя можно было предполагать обратное, учитывая литературные данные о липолитической активности лимфоцитов, составляющих основную массу (до 70—90%) клеточного состава лимфатических узлов.
В связи с таким значением ферментативных процессов в сопротивляемости организма представляет значительный интерес исследование их в тканях во время воспалительной реакции при туберкулезе.
Ряд таких проведенных нами опытов по исследованию развития туберкулезной инфекции в легких и лимфатических узлах в динамике, начиная с первых часов, позволяет не только установить наличие значительных нарушений в них, но и выявить определенную закономерность фазовость этих изменений.
Первая фаза воспалительной реакции при туберкулезе характеризуется значительным угнетением ферментативных процессов. В морфологическом отношении она отличается в основном лимфоидным характером, что особенно ясно наблюдается в наших опытах по исследованию динамики развития реакции лимфатических узлов на туберкулезную инфекцию. Длительность этой фазы, как и последующих, вариирует в зависимости от ткани, токсических свойств туберкулезных бактерий и их количества. В это время особенно наблюдается снижение окислительных процессов и фосфатазы по сравнению с нормой, что начинается с первых часов инфекции и вызывается токсинами туберкулезных палочек и продуктами их распада. В лимфатических узлах через 2 дня после заражения распавшиеся туберкулезные палочки при окраске гематоксилин-эозином представлены в виде желтобурого пигмента — меланина. В легких явления разрушения туберкулезных палочек наблюдаются позже — на 8-й день и позже.
Однако лизис туберкулезных микобактерий не всегда приводит к их полному разрушению. При гибели клеток и накоплении продуктов рас пада, благоприятствующих их развитию, появляются вновь хорошо окрашивающиеся фуксином типичные туберкулезные микобактерий.
Угнетение дыхания в первую фазу реакции организма на инфекцию объясняется, как показали наши опыты, действием туберкулезных токсинов. Можно предполагать, что такое свойство туберкулезных токсинов является и причиной пролиферации соединительнотканных элементов, принимающих участие в образовании бугорка, как выражение компенсаторной реакции этой ткани на асфиксию, развивающуюся в участках ткани с осевшими туберкулезными микобактериями. Одновременно развивающийся высокий гликолиз при пониженных окислительных процессах в этой стадии развития бугорка способствует накоплению молочной кислоты в тканях — ацидозу.
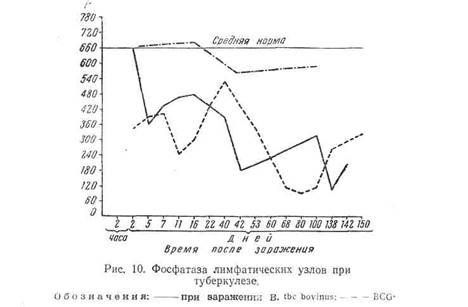
Асфиктическое и ацидотическое состояние в бугорке вызывают гибель фагоцитов и тканевых клеток, прилегающих к центрам формирующихся бугорков. Это подтверждается и рядом гистологических исследований, показывающих наличие дегенеративных изменений в фагоцитах уже на 3-й день (ядро утрачивает структуру, бледно красится и т. д.), С первых же дней заражения и до конца болезни снижается фосфатаза легких, особенно при вирулентном штамме (рис. 9).
Особенно значительное угнетение фосфатазы наблюдается в лимфа тических узлах средостения, начиная с первых же часов заражения кроликов и далее до конца — через 150 дней, когда наблюдалось уже большое разрушение (рис. 10). Обращает внимание лишь небольшое уменьшение активности фосфатазы в опыте при очень малой дозе апатогенного штамма BCG.
Все это характеризует первую фазу развития бугорка, длящуюся от 12 до 15 дней, причем переход в следующую, вторую, фазу зависит от итога ферментативных процессов в этот начальный период; при благоприятном комплексе ферментативных процессов происходит полное разрушение бактерий и восстановление нормальной жизни инфицированного участка.
Это имеет место или при весьма активных ферментах ткани, или при слабом угнетении дыхания токсинами, например, при малой патогенности микроба (особо вирулентные микробы, как показывают наши опыты, вызывают сильное угнетение дыхания).
При весьма высокой индивидуальной или видовой активности клеточных ферментов токсины быстро разрушаются, чем купируется и их патогенное, туберкулообразующее действие. Такое объяснение подтверждается и опытами сравнительного изучения влияния туберкулезных токсинов на дыхание различных органов. Оказалось, что токсин, сильно угнетающий дыхание клеток легких, меньше угнетает дыхание сильных в ферментативном отношении клеток печени (Η. Ε. Прокопенко, Г. Е. Платонов и 3. С. Васильева). При малоактивных клеточных ферментах микобактерии и их токсины не разрушаются и вызывают долго длящуюся воспалительную реакцию с последующим разрушением тканей.
Снижение окислительных процессов и фосфатазы в первой фазе реакции ведет к ослаблению разрушения туберкулезных микобактерии и их продуктов, в частности их липоидной фракции, накопление которой, вероятно, и вызывает переход лимфоидной фазы в эпителиоидную. Способность липидов туберкулезных микобактерии вызывать образование эпителиоидных клеток доказана рядом современных опытов.
Первая, лимфоидная, фаза в случае функционально-ферментативной недостаточности (т. е. при неспособности разрушать туберкулезные микобактерии и их липиды до конца) переходит в эпителиоидную с формированием некротических очагов с новыми условиями среды как для бактерий, так и для клеточных процессов.
Чаще всего первая фаза при большой вирулентности микобактерии, при сильном угнетении дыхания и связанном с ним большом гликолизе переходит во вторую фазу развития бугорка с уже значительными клеточными нарушениями в органе. Во второй фазе в лимфатических узлах особенно ясно выступает эпителиоидный характер клеточной реакции.
Вторая фаза характеризуется усилением тканевого дыхания, гликолиза и фосфатазы и начинается с момента полного развития бугорка и всасывания из него в окружающую ткань продуктов начального аутолиза клеток бугорка, погибших в первую фазу его развития.
Усиление окислительных процессов в туберкулезной ткани происходит как за счет стимулирования этих процессов продуктами распада и образующимися метаболитами, что доказано нашими опытами, так и за счет значительной пролиферации под их же влиянием сильно дышащих и сильно гликолизирующих соединительнотканных элементов, составляющих ткань бугорка.
Наступающее усиление окислительных процессов вначале удовлетворяется за счет усиленного подвоза кислорода кровью по расширенным сосудам. Но скоро усиление обмена приводит к увеличению проницаемости капиллярной стенки, что способствует проникновению белков плазмы в межклеточные пространства и как бы блокирует клетки воспалительного участка органа от проникновения кислорода, питательных веществ и препятствует выведению метаболитов, так как в белковой среде диффузионные процессы протекают слабее. Плохая васкуляризация бугорка также способствует кислородному голоданию.
Повышение в этот период темпа окислительных процессов при отставании притока кислорода вызывает в конце концов понижение окисления, сопровождающееся накоплением в бугорке недоокисленных промежуточных продуктов обмена. Возникшие условия благоприятствуют развитию аноксемического состояния и аноксибиотических процессов — усилению гликолиза и образованию молочной кислоты.
Накопление кислых продуктов, для нейтрализации которых путем окисления не хватает кислорода, увеличивается из-за нарушения нейтрализации их путем использования щелочных резервов плазмы вследствие трудности диффузии через богатый белками экссудат. Возникает, таким образом, местный ацидоз, который еще более осложняет развитие туберкулезного очага
8-09-2015, 23:00
