Механизм Т-киллинга клеток, инфицированных вирусом, включает в себя следующие стадии:
1) специфический контакт с мембраной клетки-жертвы;
2) активация ферментативных систем на участке контакта;
3) повышение проницаемости клеточной мембраны;
4) осмотическое набухание клетки;
5) разрыв мембраны и выход содержимого во внеклеточную среду.
Т-киллеры являются более успешными эффекторами, чем макрофаги и полиморфно-ядерные лейкоциты. Полагают, что Т-киллеры вместе с интерферонами оставляют основные силы иммунитета, которые обеспечивают нейтрализацию вируса и, соответственно, клиническое выздоровление больного при острой первичной вирусной инфекции. Численность Т-киллеров постепенно снижается в течение нескольких недель после клинического выздоровления, но Т-клон памяти сохраняется пожизненно.
· Гуморальный специфический иммунный ответ.
Гуморальная специфическая защита организуется системой В-лимфоци-тов при участии регуляторных механизмов Т-клеточного иммунитета: Т-хел-перы, активированные макрофагами, синтезируют и секретируют факторы для активации, пролиферации и дифференциации В-лимфоцитов, которые, в свою очередь, продуцируют антитела.
Антителами называют иммуноглобулины (гликопротеины) с известной антигенной специфичностью. В зависимости от строения различают пять классов имуноглобулинов: G, A, M, D, E.
Антитела —главное иммунное средство воздействия на вирионы, находящиеся вне клетки. На оболочку вируса они воздействуют следующим образом:
· соединяются с антигенами оболочки вируса, блокируя их активные участки;
· провоцируют агглютинацию и агломерацию вирионов;
· в сотрудничестве с комплементом повреждают оболочку вириона.
Все перечисленные эффекты снижают вероятность заражения клеток хозяина ВПГ.
Комплекс «антитело + комплемент» участвует в процессе цитолиза, являясь связующим звеном между зараженной клеткой и Fс-рецепторами клеток-эффекторов. Вирусы, высвобожденные из клетки в результате цитолиза, нейтрализуются антителами.
Антитела играют иммуномодулирующую роль, стимулируя выработку интерферона лимфоцитами.
На выработку антител требуется значительное время, поэтому часто клиническое разрешение острой инфекции наступает до того, как в крови обнаруживается высокий титр антител. IgM появляются в крови в течение первых 1–3 недель после заражения, затем появляются IgG (составляют до 80 % количества антител!), IgА выявляются через 2–3 недели. Значение антител четко проявляется при повторной инфекции или рецидиве: они не могут полностью контролировать инфекцию, но, как предполагают, ограничивают ее частоту и интенсивность.
Титр антител после клинического выздоровления постепенно снижается, но, при сохранении достаточного уровня В-клеток памяти, приобретенный гуморальный иммунитет может быть пожизненным. Антитела IgА и IgG поровну распределены между плазмой и межсосудистыми тканями и всегда обнаруживаются здесь, в том числе и вне рецидива. IgА накапливается в секретах многих желез, в том числе слюнных и слизистых. Полагают, что Т-хелперы, IgA и интерферон-γ обеспечивают т. н. мукозальный иммунитет, препятствующий реинфицированию СОПР.
Особенности иммунной защиты детей от вирусных инфекций
Неиммунные факторы защиты ребенка не оказывают должного противодействия вирусной инфекции: незрелые ткани эпидермиса легко травмируются, и, так же как и тонкая, рыхлая, слабо дифференцированная слизистая оболочка полости рта, легко воспринимают ВПГ и допускают его дальнейшее распространение.
Иммунная система формируется постепенно, достигая «взрослого» состояния примерно к 6–7 годам.
Неспецифическая защита. У новорожденных отмечается выраженный дефицит интерферона-γ и его слабая антивирусная активность; продукция интерферонов и большинства других интерлейкинов достигает взрослого уровня только к 10-летнему возрасту. Естественных киллеров относительно мало, их цитоксическая активность невелика. Фагоцитоз у детей первых лет жизни протекает вяло, что обусловлено невысоким содержанием в крови хемотаксических факторов.
Специфическая защита. Абсолютное число лимфоцитов резко повышается на пятый день после рождения и остается таким до 5-летнего возраста, однако функциональная активность Т-хелперов достигает взрослой нормы только к 3-летнему возрасту. Количество В-лимфоцитов у детей в 4–5 раз больше, чем у взрослых, но эти лимфоциты не имеют достаточной чувствительности к лимфокинам и не проявляют должной активности. В течение первого года жизни доминирует супрессорная направленность Т-клеточного иммунитета ребенка, и только на втором году начинает преобладать хелперная функция по отношению к В-лимфоцитам, вырабатывающим иммуноглобулины. В грудном молоке есть зрелые материнские нейтрофилы, Т- и В-лимфоциты.
Ig М вырабатываются у ребенка достаточно интенсивно, достигая взрослых нормативов к концу первого года жизни. Этот иммуноглобулин и обеспечивает специфический иммунный ответ ребенка в течение первого года жизни на большинство антигенов, не оставляя после заболевания иммунологической памяти.
IgG к тем инфекциям, которые перенесла мать, передаются ребенку трансплацентарно и сохраняют свою активность в течение первых 3–6 месяцев жизни. К полугоду количество материнских антител резко снижается, а выработка собственных тел нарастает крайне медленно, достигая взрослого уровня только к 4–6 годам.
Ig А начинает вырабатываться с 2-месячного возраста, уровень взрослых достигается к 4–6 годам.
При грудном вскармливании в организм ребенка в течение суток с молозивом поступает 8–10 г IgG и IgА, с молоком — 1–2 г.
sIg А в секретах новорожденных отсутствует, начинает вырабатываться с 3 месяцев, достигая уровня взрослых только к 10–11 годам. Секреторный IgА поступает с материнским молоком, не всасывается, но, покрывая СОПР, защищает ее.
Таким образом, неиммунные барьеры и собственный мукозальный иммунитет детей младше 2-летнего возраста не являются эффективной защитой от внедрения первичной герпетической инфекции. Специфический иммунитет ребенка, ранее инфицированного герпесвирусом, также отличается по эффективности от иммунитета взрослых, что обуславливает особенности клинического течения как острой, так и хронической герпетической инфекции у детей.
Воспаление в патогенезе герпетического стоматита
Вирусная инфекция клеток СОПР и иммунная реакция, для запуска которой достаточно нескольких репродуктивных циклов вируса, обуславливают развитие воспаления — сосудисто-тканевой реакции, определяющего метаморфозы симптомов и элементов поражения СОПР на различных стадиях развития герпетического стоматита.
Альтеративное воспаление проявляется в гибели инфицированных клеток, масштабы которой постепенно увеличиваются и выводят на первый план признаки нарастающей экссудации.
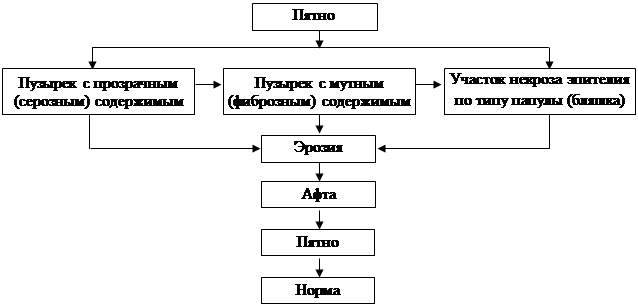
Экссудативное воспаление проявляется в диффузной гиперемии и отечности СОПР и десны, накоплении серозного, а затем и фибринозного экссудата в толще тканей и образованием папул. В полости рта экссудат пропотевает через неороговевающую СОПР и образует на ее поверхности очажки белесого налета , а в более плотной ткани красной каймы губ экссудат формирует везикулы .
Продолжающаяся альтерация приводит к макроскопическому нарушению целостности слизистой оболочки полости рта и формированию вторичных элементов поражения к различной площади и глубины (от эрозий до язв ); на красной кайме губ очаги некроза прикрыты корочками серозного или геморрагического происхождения.
Стадия пролиферации начинается при условии прекращения репродукции ВПГ как в зоне поражения СОПР, так и в организме в целом. В этой стадии экссудация ограничивается зоной некроза (вокруг эрозии формируется «венчик гиперемии»), поверхность эрозии покрывается фибрином — зона поражения приобретает вид афты. Эпителий по окружности и на дне афты регенерирует, постепенно сокращается площадь и глубина афты — целостность тканей восстанавливается, непродолжительное время сохраняя более яркую окраску (пятно). Заживление очагов глубокого некроза, распространившегося за пределы базальной мембраны СОПР, сопровождается образованием рубца.
Эволюция элементов герпетического поражения красной каймы губ
|
Эволюция элементов герпетического поражения СОПР
 |
Исходы острой герпетической инфекции
Степень клинической тяжести острой инфекции зависит, с одной стороны, от агрессивности инфекции, а с другой стороны, — от активности противовирусной защиты, иммунной и/или фармакологической. В иммунокомпетентном организме герпетическая инфекция ведет себя как «самоограниченная»: клиническое выздоровление наступает без лечения на 10–14-й день и процесс переходит в персистентную форму. В случае врожденных или приобретенных дефектов иммунной системы, а также в связи с особенностями типа (штамма) вируса и локализации процесса, репродукция ВПГ продолжается, распространяясь на другие органы и системы (печень, легкие, почки, ЦНС), вплоть до развития генерализованной формы герпетической инфекции.
Патогенез персистентной инфекции вирусом простого герпеса
В большинстве случаев у лиц, перенесших острую стадию первичной ВПГ-инфекции, наступает клиническое выздоровление, однако, организм никогда не освобождается от ВПГ: к 10–14-му дню после первичного заражения вирус герпеса в латентной форме обнаруживается в эпителиоцитах в области входных ворот, в клетках крови и лимфы, а также в нейронах и клетках-сателлитах региональных ганглиев, где сохраняется пожизненно.
Таким образом, после острого периода герпетической инфекции наступает период персистентной пожизненной инфекции, которая чаще всего протекает как латентная либо как истинно латентная (неинфекционная), либо с периодическими, более или менее частыми рецидивами.
Факторы, обуславливающие установление латентной герпетической инфекции
Механизмы латенции не вполне ясны. Известно, что латенцию вируса простого герпеса обеспечивают следующие принципиальные обстоятельства:
· вирус способен ускользать от иммунитета и поэтому пожизненно сохраняется в организме (противогерпетический иммунитет не является стерильным);
· клетка-хозяин и иммунитет в известных пределах сдерживают активность вируса, т. е. ограничивают частоту и тяжесть клинических рецидивов
инфекции;
· ВПГ оснащен специальными механизмами для латенции и реактивации, отличными от механизмов обычной репликации, не контролируемыми ни иммунитетом, ни современной химиотерапией.
Механизмы ускользания вируса от иммунного разрушения
1. Противодействие вируса простого герпеса защитным силам клетки-хозяина:
· вирус блокирует клеточные механизмы элиминации белков (нормальная клетка обеспечивает «санитарную» деградацию собственных белков; продукты деградации, а также вирусные белки переносятся на эндоплазматический ретикулум при помощи транспортных белков для дальнейшего выведения за пределы клетки; ВПГ же производит специальный белок ICP 47, который связывается с транспортными клеточными белками и блокирует их активность);
· вирус предотвращает «аварийную» полную блокаду клеточного аппарата синтеза белков (клеточный фактор инициации трансляции белков eiF-2α при инфицировании клеточного ядра должен блокировать синтез всех белков для того, чтобы остановить репродукцию вируса; ВПГ производит два специальных фактора — вирусную комплементарную РНК и белок γ1 34·5, способные опосредованно, через торможение или активирование клеточных ферментов, препятствовать включению (фосфорилированию) «аварийного» фактора);
· вирус блокирует программируемую смерть зараженной клетки (апоптоз) (по крайней мере три вирусных белка — US 3, gJ и gD — препятствуют клеточной смерти, запрограммированной на случай повреждения клеточных механизмов вирусами и/или иммунными силами).
2. Ускользание от распознавания ВПГ-антигенов иммунными факторами:
· ВПГ персистирует в виде нуклеиновых кислот, не имеющих антигенных свойств. Уровень ДНК вируса контролируется только ДНК-азой крови;
· геном ВПГ встраивается в геном клетки-хозяина;
· при лизисе «материнской» клетки ВПГ переходит в соседнюю клетку по межклеточным мостикам, ускользая от нейтрализации антителами во внеклеточном пространстве;
· антигены ВПГ сходны с антигеном цитокератина, с рецепторами ацетилхолина и т. д., что обеспечивает заметную естественную толерантность иммунных сил к ВПГ;
· в условиях дефицита комплемента вирус, атакованный антителами и образовавший с ними комплекс, сохраняет свою активность при том, что блокированные антителами антигенные рецепторы ВПГ больше не распознаются иммунными факторами.
3. Использование иммунных сил организма в интересах ВПГ:
· ВПГ внедряется в иммунные клетки молодых организмов — макрофаги, Т- и В-лимфоциты, которые становятся не только резервуарами инфекции, но и ее разносчиками;
· антитела, связываясь с антигенами вируса, в некоторых обстоятельствах не только защищают вирусы от распознавания иммунными силами (см. выше), но даже могут провоцировать феномен усиления репродукции вируса;
· вокруг эпителиоцитов, инфицированных комплексом «ВПГ + АТ + комплемент», под действием анафилактоксина нарастает инфильтрация тканей лейкоцитами — создается «муфта» из лейкоцитов, ограничивающая инфицированную зону от иммунных атак.
4. Искажение иммунного ответа (аутоиммунные и аллергические
процессы):
· сходство антигенов ВПГ с антигенами ряда белков организма рецепторами провоцирует перекрестные иммунные реакции;
· появление иммунных комплексов из АГ+АТ провоцирует иммунокомплексные поражения, сопровождающиеся массовым распадом собственных клеток, т. е. аутоиммунные болезни.
5. Подавление иммунного ответа:
· ВПГ, инфицируя иммунные клетки, снижает их прямую функциональную активность;
· ВПГ снижает активность системы Т-хелперов;
· ВПГ подавляет продукцию и активность интерферонов;
· ВПГ ингибирует активацию системы комплемента, что снижает эффективность антител (см. выше).
6. Истощение иммунных сил вследствие постоянного нахождения ВПГ в организме (табл. 2).
Таблица 2
Тенденции изменений иммунного статуса при хронической герпетической инфекции
| Показатель | Тенденции изменений при герпетической инфекции |
| Т-лимфоциты | ↓ |
| Т-хелперы (СD4+) | ↓ |
| Т-супрессоры цитотоксические (СD8+) | ↑ |
| Иммунорегуляторный индекс Тх/Тс | ↓ |
| В-лимфоциты | ↓ |
| Естественные киллеры | ↓ |
| IgG | продукция антител снижена |
| IgA | |
| IgM | |
| IgЕ | |
| Интерферон-γ | ↓ |
Иммунные и клеточные факторы, обуславливающие латенцию
Минимальную активность вируса во время латентной инфекции объясняют следующими фактами:
· количество вирионов, достигающих мест латенции, ограничено и не является достаточным для инфекционного процесса;
· по пути к клеткам нервного ганглия частично утрачивается внутренняя оболочка вируса, несущая белки Vmw65, необходимые для инициации синтеза α-генов ВПГ;
· в нейронах, не способных к размножению, отсутствуют клеточные ферменты (в частности, транскриптаза), необходимые для репликации ВПГ;
· клетки-хозяева латентной инфекции продуцируют факторы, ограничивающие репликацию ВПГ на самых ранних стадиях.
Вирусный геном в латенции.
ВПГ в латентном состоянии проявляет очень умеренную и совершенно особую активность: вне рецидива наблюдается экспрессия специальных участков его генома (latency - associated transcript или LAT), которые практически не используются в обычном режиме репликации. Эти гены не относятся ни к α-, ни к β-, ни к γ-классам, поэтому их предложено называть δ-генами. Известно, что для установления латенции необязательно наличие тимидинкиназы, наличие ранних генов — весь геном ВПГ, кроме LAT, который в период латенции не активен.
Поскольку цикл репликации ВПГ во время латенции не совершается, поэтому ни метаболизм, ни функции клеток-хозяев латентной инфекции не повреждаются. Латентная фаза ВПГ-инфекции как таковая не вызывает никакой распознаваемой патологии.
Установление и существование латенции ВПГ в настоящее время не может быть изменено, т. е. полное удаление вируса из организма невозможно.
Факторы, обуславливающие рецидивы латентной инфекции
По разным данным, от 10 до 75 % лиц, перенесших первичную герпетическую инфекцию, имеют рецидивы заболевания. Рецидивы, как и острая инфекция, могут иметь характер либо инаппарантной, либо клинической инфекции.
Механизмы установления латенции и реактивации вируса изучены недостаточно хорошо. Существует две гипотезы патогенеза рецидива: статическая и динамическая.
Статическая гипотеза: пусковой фактор активирует вирус, находящийся в латентном состоянии в ганглии; на фоне нарушений биохимического и иммунологического равновесия вирус продвигается к периферическим чувствительным клеткам и активно репродуцируется в зоне обслуживания инфицированным ганглием.
Динамическая гипотеза : вирус в ганглиях находится в состоянии не абсолютной латенции, но воспроизводится каждые несколько дней, небольшими порциями выделяется из ганглия и проходит к эпителию, организуя там фокусы микроинфекции; микрофокусы вирусной инфекции более или менее успешно блокируются иммунными силами, поэтому носитель переживает либо инаппарантные, либо абортивные, либо клинические рецидивы.
Обе гипотезы обращают внимание на две группы факторов, обусловливающих развитие рецидивов: повышение активности ВПГ и снижение эффективности иммунитета.
Факторы, связанные с уровнем активности вируса. Течение персистентной инфекции зависит от характера первичной инфекции: так, при инаппарантной первичной инфекции частота рецидивов относительно невысока.
Частота рецидивов зависит от магнитуды латентной инфекции: чем выше концентрация ДНК ВПГ в ганглии, тем чаще рецидивы. Магнитуда ВПГ в нейронах со временем снижается, что обуславливает постепенное уменьшение частоты рецидивов.
Известно, что ряд веществ и факторов могут повышать активностьлатентного вируса в клеточной культуре. Никотин, фенацетин (жаропонижающее лекарство), диметилсульфоксид — эти и, предположительно, многие другие вещества, вероятно, замещают собой недостающие инициальные вирусные белки и включают транскрипцию ранних белков ВПГ. Известно, что простагландины (медиаторы воспаления, организующие эритему и повышающие активность деления клеток) повышают активность вируса простого герпеса. Именно влиянием простагландинов объясняют рецидивирование ВПГ-инфекции на фоне механической травмы СОПР, солнечных ожогов кожи лица и красной каймы губ, невритов.
По другой версии, реактивация ВПГ может быть вызвана изменениями внутренней среды в инфицированных ганглиях: изменения могут быть связаны, например, с воспалением или анестезией участка слизистой оболочки полости рта, иннервируемого узлом, или патологией (травма, воспаление) самого узла.
Факторы, снижающие противовирусный иммунитет. Среди причин иммунодефицита, провоцирующего рецидив ВПГ, называют следующие:
– иммуносупрессивные эффекты персистентной ВПГ-инфекции;
– стресс (эмоциональные расстройства, усталость);
– гормональный дисбаланс (пубертатный период, менструация);
– неблагоприятные экологические факторы;
– качество питания (дефицит белков, витаминов, микроэлементов);
– иммуносупрессивные эффекты заболеваний, связанных с патологией иммунитета (инфекционные, эндокринные и аутоиммунные заболевания, патология крови);
– иммуносупрессивная терапия при аутоиммунных, онкологических заболеваниях и при пересадке органов и тканей.
Все перечисленные факторы патогенеза рецидивов ВПГ являются объектами терапии персистирующей инфекции, имеющей целью снижение частоты рецидивов и их клинической тяжести.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Вирус простого герпеса и его роль в патологии человека / А. Г. Коломиец [и др.]. Мн.: Наука и техника, 1986. 262 с.
2. Вирусология . В 3-х т. Т. 1: пер. с англ.; под ред. Б. Филдса, Д. Найпа при участии Р. Ченока, Б. Ройзмана. М.: Мир, 1089. 452 с.
3. Вирусология . В 3-х т. Т. 3: пер. с англ.; под ред. Б. Филдса, Д. Найпа при участии Р. Ченока. Б. Ройзмана. М.: Мир, 1089. 452 с.
4. Генерализованная герпетическая инфекция: факты и концепция / А. Г. Коломиец [и др.]; под общ. ред. В. И. Вотякова, А. Г. Коломийца. Мн.: Навука i тэхнiка, 1992. 351 с.
5. Германенко, И. Г. Простой герпес и новые герпесвирусы в патологии человека: методические рекомендации / И. Г. Германенко, А. П. Кудин. Мн.: БГМУ, 2001. 36 с.
8-09-2015, 19:55
