Типовой вид: L . interrogans
L. biflexa (сапрофит)
L. borgpetersenii
L. inadai
L. meyeri (сапрофит)
L. noguchii
L. parva (сапрофит)
L. santarosai
L. weilii
L. wolbachii (сапрофит)
Наиболее изучен вид L . Interrogans , по антигенным свойствам он разделен на 25 серогрупп, которые включают 180 сероваров. Таксономическим критерием для классификации штаммов Leptospira на внутривидовом уровне служит антигенный состав клеток. Патогенные лептоспиры разделены на 38 серогрупп и 65 сероваров.
Установлена выраженная видовая чувствительность животных к лептоспирам определенных серологических групп и вариантов. Так, основными возбудителями лептоспироза свиней являются Pomona и Tarassovi, крупного рогатого скота – Hebdomadis, Pomona и Grippotyphosa, мелкого рогатого скота – Grippotyphosa, Pomona и Tarassovi. Крупный и мелкий рогатый скот заражаются лептоспирами Grippotyphosa и Hebdomadis преимущественно при выпасании на территории природного очага от полевок и других видов грызунов – основных резервуаров лептоспир данных серогрупп. Основными хозяевами лептоспир серогрупп Pomona и Tarassovi являются чаще свиньи и крупный рогатый скот. В природных очагах лептоспир Pomona у полевых мышей выявляют серовариант mozdok, который вызывает у сельскохозяйственных животных только спорадические случаи инфекции. Природные очаги лептоспир Tarassovi на территории России и стран СНГ не обнаружены.
Лептоспирами Tarassovi и Pomona в большинстве случаев свиньи заражаются только от свиней, а крупный рогатый скот – только от крупного рогатого скота. Может наблюдаться межвидовое заражение. Лептоспирами Icterohaemorrhagiae и Canicola сельскохозяйственные животные инфицируются от основных хозяев этих лептоспир: серых крыс и собак. Лептоспироз, вызванный этими возбудителями, протекает спорадически и не поражает больших групп животных.
У сельскохозяйственных животных в разных местах обнаруживают лептоспиры одних и тех же серологических групп: Pomona, Tarassovi, Hebdomadis, Icterhaemorrhagica, Canicola. У мелких млекопитающих, кроме названных, выделяют лептоспиры Australis, Javanica, Autumnalis, Cynopteri, Batoviae, Pyrogenes. Эти серогруппы у сельскохозяйственных животных не находят.
8.2 Устойчивость к факторам внешней среды
Лептоспиры неустойчивы к воздействиям внешних факторов. Прямые солнечные лучи убивают их в течение 0,5–2 ч. Высушивание на лептоспир действует также губительно. В воде открытых водоемов лептоспиры выживают от нескольких часов до 30 сут.
При кипячении культуры они гибнут моментально, а при нагревании до 56°С – через 30 мин. Очень устойчивы лептоспиры к низким температурам. Выживаемость микроорганизмов в пищевых продуктах зависит от рН среды. Кислая реакция губительно действует на лептоспиры. Так, в кислом молоке они гибнут в течение 10 мин. Мясо от больных животных обеззараживается при содержании в нем соли 4,8% в течение 10 сут. 20%-ный этиловый спирт, 2%-ная хлористоводородная кислота, 0,5%-ный раствор фенола, 0,5%-ный раствор едкого натра, 0,25%-ный формалин убивают лептоспир в течение 5 мин.
8.3 Отбор патматериала
Для прижизненной диагностики, для бакисследования берут кровь из вены (в первые 7 суток при повышении температуры тела больного животного, 5 мл для бактериологического и 5–10 мл для серологического исследований). Для серологической диагностики кровь отбирают не ранее 5–7 суток после начала заболевания. Обязательно нужно брать пробу крови от абортировшего животного. В крови можно обнаружить живые лептоспиры. Можно брать мочу, которую собирают в стерильные емкости во время естественного мочеиспускания утром (во время кормления). Абортированный плод посылают целиком или его желудок с содержимым (перевязывая его с двух сторон), паренхиматозные органы плода (отдельно от желудка).
Для посмертной диагностики – трупы мелких животных целиком, от крупных животных – сердце с перевязанными сосудами, кусочки органов, почку, селезенку, перевязанный мочевой пузырь, транссудаты из грудной и брюшной полостей. Материал должен быть исследован не позднее 6 часов летом, 10–12 часов – зимой, мочу – в течение 3 часов (то есть сроки выживания лептоспир в данных условиях).
Помимо материала от больных (павших) животных, в лабораторию могут быть направлены для исследования пробы воды (редко корм, навоз).
Для бакисследования предварительно готовят материал: мочу – центрифугируют (при 10–15 тыс. об/мин 30 мин) и исследуют осадок и надосадочную жидкость; кровь (цитратную) отстаивают, исследуют плазму; готовят из проб органов суспензию в стерильном физрастворе, исследуют в нативном состоянии или после центрифугирования.
8.4 Диагностика
Бактериологическая диагностика основана на обнаружении лептоспир в исследуемом материале путем микроскопии или выделения культур. Она складывается из следующих этапов: микроскопия в темном поле микроскопа, выделение культур лептоспир путем посева присланного материала от сельскохозяйственных животных или органов, зараженных этим материалом, лабораторных животных (биопроба) на специальные питательные среды, идентификация и дифференциация выделенных культур.
Одним из самых быстрых, простых и доступных для выполнения в практических условиях методов бактериологической диагностики является микроскопическое исследование. Микроскопию свежевыделенной мочи, околосердечной жидкости, грудного и брюшного экссудата, а также крови и суспензий паренхиматозных органов проводят в темном поле микроскопа. Морфология и характер движения лептоспир – настолько типичны, что в случае их обнаружения дается право ставить окончательный диагноз.
– Морфология
Клетка спирохеты имеет цилиндрическую извитую форму, содержит цитоплазму, отграниченную цитоплазматической мембраной, снаружи которой расположена клеточная стенка со слабовыраженным пептидогликановым слоем. Патогенные спирохеты имеют длину 3–20 мкм и толщину 0,1–0,5 мкм. Представители отдельных родов различаются по длине и толщине, числу и характеру завитков (табл. 2; рис. 21). Спирохеты грамотрицательны. Боррелии в отличие от трепо-нем и лептоспир хорошо окрашиваются анилиновыми красителями. Морфологию трепонем и лептоспир изучают путем микроскопии живых микроорганизмов в препаратах «раздавленная» или «висячая» капля в темнопольном или фазово-контрастном микроскопе, а также в мазках, окрашенных по Романовскому–Гимзе или специальными методами, например серебрением.
Лептоспиры различных серологических групп имеют одинаковые морфологические свойства. В препарате «раздавленная капля» в темном поле микроскопа лептоспиры имеют вид тонких серебристо-белых нитей с нежной спиральной структурой. Длина их 5–18 мкм, диаметр 0,05–0,14 мкм. Лептоспира имеет тонкую ригидную центральную осевую нить, вокруг которой равномерными завитками обвита цитопламатическая спираль. Тело лептоспиры, состоящее из правильных, почти соприкасающихся завитков спирали, постепенно утончается к концам, которые в большинстве случаев загнуты под углом и имеют пуговчатые утолщения (рис. 8). Помимо первичных завитков у лептоспир обнаруживают более крупные вторичные завитки, обусловливающие изгибы ее тела, вследствие чего микроорганизмы приобретают форму букв S, С, X. В старых культурах преобладают более длинные особи. Установлено наличие фильтрующихся форм лептоспир. Осевая нить служит органом движения. Характерная подвижность, лептоспир является их диагностическим признаком. Лептоспиры плохо окрашиваются анилиновыми красками, но хорошо импрегнируются серебром по методу Лёвадити.
Живые бактерии в жидких средах способны быстро перемещаться (прямолинейно, по кругу или вращением на месте). В полужидких субстратах их движения приобретают змеевидный характер. Периодически они становятся неподвижными, похожими на петлю веревки.
ЛС проявляют хемотаксис по отношению к веществам с повышенной вязкостью, гемоглобину и т.д. Сахара оказывают противоположный эффект и даже снижают их подвижность
Структура клетки лептоспир.
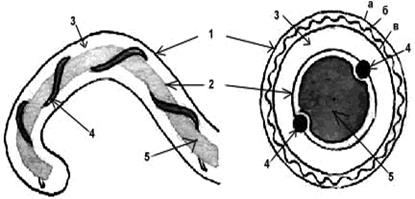
Обозначения: 1-наружная мембрана; 2-периплазматический цилиндр; 3-жгутик: - 1-наружная мембрана (а, б, в-ее слои); - 2-внутренняя мембрана; 3-периплазматическое пространство; 4-жгутики; 5-цитозоль
Структура клеточной стенки лептоспиры аналогична таковой других спирохет. 3–5-слойная наружная мембрана окружает протоплазматический цилиндр, покрытый гибким пептидогликановым слоем, тесно ассоциирванным с внутренней цитоплазматической мембраной, как у грамположительных бактерий. В этих слоях отсутствуют гликолипиды. В пептидогликане преобладает орнитин, а не диаминопимелиновая кислота, как считалось ранее.
Наружная мембрана лептоспиры весьма необычна, поскольку является самой жидкой из известных на сегодняшний день. Находящиеся в ней наружные мембранные протеины при движении всегда (даже при изменении направления) смещаются в задний конец клетки. Скорость дрейфа антигенов в мембранах приблизительно составляет 11 мкм/сек.
Оболочка клетки окружает так называемый «протоплазматический цилиндр». Благодаря укорочению закрученных вокруг него осевых нитей последний имеет винтообразную форму.
Два жгутика (осевые нити) диаметром 20–30 нм локализуются в периплазматическом пространстве между наружной мембраной и пептидогликановым слоем оболочки. Их свободный конец уже внутриклеточного. Аксиальная нить состоит из сердцевины диаметром 11,3 мкм, окруженной 2 мембранными слоями толщиной 21,5 и 42 микрон. Она прикрепляется крючком к базальному тельцу на противоположном конце периплазматического цилиндра и идет вдоль оси клетки приблизительно до ее центра. Аксиальные нити не перекрываются между собой, как это имеет место у других спирохет. Структура базальных телец жгутиков такая же, как и у других грамотрицательных бактерий. Аксиальные нити обеспечивают движение и сохранение лептоспир своей формы. В культурах лептоспиры нередко образуют клубки, а по мере старения в них появляются дегенирирующие формы с атипичной морфологией.
Прохождение на питательных средах более 20 пассажей ведет к изменению морфологии лептоспир – увеличению длины и количества завитков спирали, а также уменьшению количества электронно-прозрачных протоплазматических включений.
– Культуральные свойства
Лептоспиры являются аэробами, их культивируют на средах слабощелочной реакции (рН 7,2–7,4) при 24 – 28 °С. Культивирование лептоспир связано с определенными трудностями, обусловленными их низкой способностью к размножению в жидких, полужидких и особенно на плотных искусственных питательных средах. На простых питательных средах лептоспиры не растут. Для их культивирования наиболее часто используют жидкие среды Любашенко, Терских, Ферворт – Вольфа, содержащие 5–10% сыворотки крови кроликов, а также среду ГНКИ с альбумином. Максимальное накопление биомассы лептоспир отмечается по истечении 5–7 сут. культивирования, при этом вид питательных сред не изменяется.
Патогенные лептоспиры являются аэробными (часто микроаэрофильными) спирохетами. Invitro при хорошей аэрации, pH 7,2–7,4 и оптимальных условиях инкубирования (температуре 28– 30°C для большей части сероваров и 30–32°С для L.canicola) они культивируются намного лучше, чем другие спирохеты. Границы температуры инкубации посевов, в пределах которых возможен рост лептоспир, составляют 22–37°С.
Для нормального роста они нуждаются в липидах и ненасыщенных жирных кислотах, а также витаминах В1 и В12. Наличие белка в питательной среде для лептоспир не обязательно. Из числа аминокислот только аспарагин оказывает на них стимулирующее действие. Его можно заменить полисорбатами. Обработка твина поливинилпирролидоном устраняет его токсичность для лептоспир. В средах без протеина, но с обработанным этим способом твином урожай лептоспир достигает 108 кл/мл. Неплохой альтернативой твину-80 является пируват натрия, который добавляют в среды в концентрации 100 мкг/мл. Наличие в субстрате сахаров угнетает их рост.
Наиболее интенсивно лептоспиры растут на жидких и полужидких питательных средах с 5–10% сыворотки крови кролика или барана (вместо сыворотки часто применяют сывороточный альбумин). Время развития одной генерации лептоспир в логарифмической фазе составляет 58–68 ч, поэтому максимальный рост наблюдают на 5–10 дн.
Классической питательной средой для лептоспир является среда Ногуши-Веньона. Наибольшее распространение в работе с ними получили жидкие (Уленгута, Ферворта-Вольфа в модификации Тарасова, Кортхофа и др.) и полужидкие (Флетчера и др.) агаровые среды (ПРЛ 10:2).
На жидких средах эти спирохеты растут медленно – максимальный урожай бактерий обычно получают на 5–10 дн культивирования. При микроскопировании препаратов культур в этот период в одном поле зрения (окуляр х10, объектив х40) обычно обнаруживают около 100 подвижных бактерий. Культуры лептоспир в жидких средах бесцветны, не имеют запаха, при бурном росте опалесцируют. Опалесценция лучше видна в проходящем свете при легком встряхивании пробирки.
В полужидких средах на 1,5-2 см ниже поверхности появляется помутнение в виде кольца, интенсивность которого усиливается по мере роста лептоспир. В средах с 1% агара эти бактерии формируют преимущественно заглубленные колонии, контуры которых могут быть четкими или размытыми. Тенденция к заглубленному росту (феномен Дингера), обеспечивающая некоторое ограничение доступа кислорода, свидетельствует о микроаэрофильности лептоспир.
В средах с 2% агара лептоспиры образуют поверхностные колонии, имеющие разную степень прозрачности вплоть до трудно различимых при обычном освещении. Пассирование изолятов invivo повышает частоту образования такого типа колоний, в то время, как многократные пересевы invitro способствуют усилению заглубленного роста. Чем чаще делают пересевы, тем быстрее получают пышный рост культур.
Фосфомицин (400 мкг/мл) в сочетании с 5-флуорацилом (100 мкг/мл) при добавлении в среду ингибируют размножение посторонней микрофлоры, не влияя на рост лептоспир. Это позволяет использовать их в селективных средах. В качестве селективных компонентов сред применяют также мочевину, соли кобальта и антимикробные препараты (неомицин, рифампицин, фурацилин, фурагин, налидиксовую кислоту, комбинации рифампицина, полимиксина В, бацитрацина и актидиона.
В процессе хранении музейных штаммов лептоспир их пересевают не реже 1 раза в месяц. Для длительного хранения культуры заливают слоем стерильного вазелинового масла или запаивают в ампулы, что предупреждает испарение среды и изменение ее рН.
Патогенные лептоспиры в процессе культивирования invitro постепенно утрачивают свою вирулентность. Последнюю часто удается восстановить посредством заражения чувствительных животных, например, молодых морских свинок (36).
– Биохимические свойства
Лептоспиры – хемоорганотрофы с дыхательным типом метаболизма. Повышенная чувствительность к солям синильной кислоты, а также результаты спектроскопических исследований свидетельствуют об участии в их дыхании цитохромной системы. Они оксидазонегативны, но каталазо- и / или пероксидазопозитивны.
Эти микроорганизмы проявляют выраженную аминопептидазную активность при отсутствии протеолитических свойств. По механизмам синтеза изолейцина разные лептоспирsразличаются, что дает основание для разделения их на 3 класса.
• Микроорганизмы класса 1 осуществляют это обычным треониновым путем,
• Представители класса 3 – уникальным (пируватным) способом,
• Остальные лептоспиры, вошедшие в класс 2, обоими способами.
Лептоспиры способны утилизировать азот из мочевины, креатинина и саркозина, что протекает под контролем ферментов микроорганизмов – аланин дегидрогеназы, глютамат дегидрогеназы и глютамат пируват трансаминазы.
В клетках лептоспиры обнаружены следующие липидные компоненты: свободные жирные кислоты (41,8%), мажорный фосфолипид (14,8%), фосфатидилэтаноламин (12,9%), эфир холестерина (CE) (9,3%), липофосфатидилэтаноламин (4,9%) и дифосфатидилглицерин (1,1%). Свободные жирные кислоты представлены гексадеканоиковой (26,9%), гексадеценоиковой (15,4%), октадеценоиковой (26,5%) и октадекадиеноиковой (27,4%) кислотами. В состав мажорного фосфолипида входят тетрадекадиеноиковая (53,6%), тетрадекатриеноиковая (14,0%) и октадектадеканоиковая (13,8%) жирные кислоты. Фосфолипид с полиненасыщенными жирными кислотами и 14 атомами углерода в молекуле выявлен только у вирулентных штаммов и отсутствует у авирулентных.
– Биопроба
Лептоспиры могут быть выделены из патологического материала посредством его инокуляции лабораторным животным: кроликам-сосунам, золотистым хомячкам, степным пеструшкам (10–30-дневного возраста) и сусликам, поскольку перечисленные животные в равной степени чувствительны к возбудителям как «желтушных», так и «безжелтушных» лептоспирозов. Другие виды лабораторных животных проявляют неодинаковую чувствительность к разным сероварам лептоспир. Молодых морских свинок и белых мышей (массой 10–14 г.) используют при подозрении на инфекцию серовара icterohaemorrhagiaee.
Гепаринизированную кровь, мочу, спиномозговую жидкость или суспензию гомогената внутренних органов подозреваемой в заражении ЛС собаки, а также тестируемые корма и воду вводят лабораторным животным подкожно, через скарифицированную кожу, закапыванием в глаза, внутрибрюшинно, внутривенно, интракардиально и перорально.
У молодых кроликов, золотистых хомяков и сусликов инфекция «желтушных» и «безжелтушных» лептоспир вызывает развитие таких же клинических и патоморфологических изменений, как и у других видов лабораторных животных при инфекции L.icterohaemorrhagiaee. После инкубационного периода, составляющего в зависимости от патогенности штамма агента от 2 до 7 дн (реже более) температура тела поднимается до 39–41°С, животные отказываются от корма и быстро теряют в весе. У них развивается инъекция сосудов склеры глаз. На 2–5 дн клинической стадии инфекции на фоне резкого истощения температура их тела снижается ниже нормы, появляется желтушность склеры глаз, видимых слизистых оболочек и кожи. Усиленно выпадают волосы. Заболевшие животные в большинстве случаев погибают на 4–12 дн после заражения.
На их вскрытии обнаруживают желтушность тканей, особенно подкожной клетчатки, кровоизлияния во внутренних органах, коже, подкожной клетчатке, которые наиболее интенсивны в паховой и подмышечной областях. Типичны крупноточечные кровоизлияния в легочной ткани, которые выделяясь на общем ишемическом фоне придают легким сходство с крыльями бабочки. В печени находят красновато-желтые некротические очаги. В следствии острого нефрита почки увеличены, надпочечники гиперемированы.
В течение инкубационного периода и всей клинической стадии инфекции лептоспиры циркулируют в крови животного. С появлением желтухи их обнаруживают во внутренних органах (особенно часто в печени).
В ходе биопробы по рекомендациям ВОЗ за подопытными животными ведут следующие наблюдения:
1) определяют массу тела до опыта и ежедневно в течение всего эксперимента;
2) у крупных животных (кроликов, морских свинок) дважды в сутки измеряют ректальную температуру. При ее повышении проводят микроскопию на наличие лептоспир брюшного эксудата. Его собирают стерильной пастеровской пипеткой через надрез кожи, сделанный выше пупка (для избежания травмы мочевого пузыря);
3) высевают взятую из сердца кровь в пробирки с питательной средой. За выжиывшими животными ведут наблюдение в течение 1 мес, а затем подвергают эутаназии. Высевают на питательные среды гомогенат коркового слоя почек и проводят его микроскопическое исследование с целью обнаружения лептоспир. Кровь из сердца исследуют на наличие специфических антител в РАЛ.
Для обнаружения патогенных лептоспир в воде и иле водоемов пользуются методом Аппельмана-ван Тиля, сущность которого состоит в купании в течение 1 ч морских свинок со скарифицированной на площади в 10–20 см2 кожей брюшка. Кожу скарифицируют после удаления волос нанесением скальпелем продольных и поперечных штрихов. За животными ведут наблюдение по общим правилам. В связи с легкостью клинического течения лептоспироза у морских свинок, вызванного «безжелтушными» штаммами агента, независимо от состояния животных проводят посевы на питательные среды из крови сердца с 4–5 по 20 дн после заражения и микроскопирование брюшного эксудата.
В случае получения сомнительных результатов биопробы, что может иметь место при плохой сохранности поступившего для исследования патологического материала, низкой патогенности тестируемого штамма лептоспир или вследствии низкой заражающей дозы, прибегают к проведению 1–2 последующих пассажей на лабораторных животных.
– Идентификация вирулентных лептоспир
Патогенные и сапрофитные изоляты лептоспир дифференцируют по результатам биопробы, чувствительности к 8-азагуанину, бикарбонату натрия, солям меди,
8-09-2015, 20:09
