Липостат - система, контролирующая постоянство массы тела. Ее функционирование обеспечивается взаимодействием между гипоталамусом, жировой тканью и желудочно-кишечным трактом. Холецистокинин - ингибитор голода. Нейтропептид V стимулирует поиск пищи, продукцию инсулина и липогенез. Его выработка уменьшается под влиянием лептина. ЛПГ (липотропный гормон гипофиза), СНС (симпатическая нервная система) и тиреотропин стимулируют липолиз. Лептин вызывает чувство насыщения (действуя на рецепторы вентромедиальных ядер) и оказывает тормозящее влияние на центр голода через выработку ГПП I (глюкагоноподобный пептид).
Вторичное ожирение - синдром, возникающий при нарушении соотношения между процессами липолиза и липогенеза, носит симптоматический характер и порождается различными и эндокринными расстройствами (гиперкортизолизм, гиперинтсулинизм, гипогонадизм, опухоли мозга, нарушения мозгового кровообращения пр.).
По степени увеличения массы тела различают ожирение I степени (масса тела увеличена на 30%); II степени (на 30-50%) и III степени (более чем на 50%).
Одним из наиболее распространенных показателей для оценки степени ожирения является индекс массы тела (ИМТ), рассчитываемый следующим образом:
Масса тела в кг
ИМТ = (Рост в м)2
Больные с ИМТ 30 кг/м2 и более, а также пациенты с ИМТ 27 кг/м2 или более, ожирение которых связано с такими факторами риска, как диабет II типа или дислипидемия, подлежат обязательному лечению (табл. 43).
Классификация избыточной массы у взрослых в зависимости от ИМТ
(подготовлено в соответствии с докладом ВОЗ 1998)
| Классификация | ИМТ, кг/м2 |
Вероятность сопутствующего заболевания |
| Недостаточная масса | < 18,5 | Низкая (но риск других клинических проблем увеличивается) |
| Нормальный диапазон | 18,5 - 24,9 | Средняя |
Избыточная масса Предожирение Ожирение класс I Ожирение класс II Ожирение класс III |
> 25,0 25,0-29,9 30,0-34,9 35,0-39,9 > 40,0 |
Увеличена Умеренно увеличена Значительно увеличена Очень увеличена |
Наиболее простым методом определения необходимости регулирования массы тела является измерение окружности талии. В идеале окружность талии не должна превышать 94 см у мужчин и 80 см у женщин. Если окружность талии у мужчин достигает 102 см, а у женщин - 88 см, возникает серьезная угроза увеличения риска заболевания.
По особенностям морфологии жировой ткани выделяют гипертрофическое и гиперпластическое ожирение.
Гипертрофическое ожирение связано с увеличением размеров адипоцитов (это лабильный фактор, зависимый от питания), чаще встречается в зрелом возрасте. При этом виде ожирения масса тела может увеличиваться в 3-3,3 раза.
Гиперпластическое ожирение сопровождается увеличением количества адипоцитов. Начинается, как правило, в детском возрасте, так как дифференцировка фибробластических клеток-предшественниц в новые адипоциты во взрослом организме - явление довольно редкое (это происходит в период внутриутробного развития и в раннем грудном возрасте). Данный вид ожирения в большей степени зависит от наследственности. Избыток массы тела при гиперпластическом ожирении может достигать гигантских величин (до 1000%). Следует отметить, что в подростковый и преклимактерический периоды повышается пролиферативная активность преадипоцитов. Кроме того, их деление индуцируют избыточная калорийность пищи, сахарный диабет или переедание у беременных. В этих случаях гиперпластическое ожирение развивается у взрослых.
По патогенезу различают алиментарное, метаболическое и энергетическое ожирение.
Алиментарное ожирение - наблюдается при чрезмерном потреблении пищи, что может быть обусловлено:
а) нарушением деятельности гипоталамического пищевого центра (длительное возбуждение вентролатеральных ядер) в результате травм, кровоизлияний в диэнцефальную область, воспаления (по этиологии это гипоталамическое ожирение);
б) частой афферентной импульсацией при возбуждении вкусовых рецепторов; в) переходом от активного к малоподвижному образу жизни. При этом в некоторых случаях сохраняется высокий уровень возбудимости пищевого центра (характерный для лиц физического труда или спортсменов), что приводит к систематическому перееданию;
г) чрезмерным растяжением стенок желудка при его переполнении. Это снижает чувствительность нервных окончаний слизистой оболочки, и тормозящие импульсы передаются в пищевой центр только при очень большом скоплении пищи в желудке. В результате переедание становится постоянным и возникает ожирение;
д) пожилым возрастом, что объясняется несоответствием между прежним уровнем возбудимости центра голода и меньшими знергозатратами (после 25 лет основной обмен снижается в каждые последующие 10 лет примерно на 7,5%). Интересно отметить, что в глубокой старости часто развивается исхудание, поскольку угнетается активность пищевого центра и снижается переход углеводов в жиры.
Метаболическое ожирение обусловлено повышенным синтезом жира из углеводов. В обычных условиях до 30% поступающей в организм глюкозы под действием инсулина превращается в жир. При гиперфункции инсулярного аппарата этот процент возрастает. Аналогичное изменение метаболизма наблюдается при повышенной продукции пролактина (гормона передней доли гипофиза) глюкокортикоидов.
Энергетическое ожирение развивается при недостаточном использовании жиров в качестве источника энергии. Наблюдается при гиподинамии в сочетании с хорошим аппетитом, при снижении тонуса симпатической нервной системы и недостаточной продукции жиромобилизующих гормонов (СТГ, тиреоидные гормоны, катехоламины), поскольку задерживается выход жира из депо и использование его в качестве энергетического субстрата.
По этиологии ожирение классифицируют на экзогенно-конституциональное, гипоталамическое, гормональное (эндокринное).
Экзогенно-конституциональное ожирение. Определенные условия способствуют реализации наследственно обусловленной предрасположенности. Длительное повышение активности «пищевого центра» ведет к повышению аппетита (гиперфагии) и ожирению. Привычка переедать может быть приобретена в детстве. Так, установлено, что избыточное кормление ребенка первого года жизни способствует развитию гиперпластического ожирения, характеризующегося увеличением объема жировых клеток. В результате создаются условия для развития ожирения.
Гипоталамическое ожирение. Является следствием поражения области гипоталамуса. Причиной могут быть перенесенные травмы головного мозга, стойкая внутричерепная гипертензия, опухоли мозга, менингит, а также врожденные дегенеративные изменения гипоталамической области (например, синдром Фрёлиха).
Гормональное ожирение. Связано как с гипо-, так и с гиперфункцией желез внутренней секреции и наблюдается при гипотиреозе, гипофункции половых желез, а также при гиперинсулинизме и гиперкортицизме. В крови таких больных повышается содержание ЛПНП и ЛПОНП, НЭЖК. При гормональном ожирении рано развивается гипертриацилглицеридемия и несколько позже - гиперхолестеринемия.
Нарушению обмена липидов сопутствует изменение углеводного обмена: развивается гипергликемия, стимулирующая секрецию инсулина и предшественника инсулина - низкоактивного гормона проинсулина. В свою очередь, секрецию проинсулина и инсулина стимулируют НЭЖК, ЛПНОП, ЛПНП. Усиленный выброс глюкокортикоидов, стимулирующих глюконеогенез, также повышает уровень инсулярных гормонов в крови. Гиперинсулинизм ведет к усилению синтеза и депонирования липидов. Постепенно длительная стимуляция β-клеток инсулярного аппарата поджелудочной железы приводит к его истощению и провоцирует развитие сахарного диабета.
Последствия ожирения. При ожирении постепенно изменяется белковый обмен, который характеризуется снижением уровня общего белка крови преимущественно за счет уменьшения концентрации альбуминов, увеличением содержания фибриногена, продуктов деградации фибрина, снижением содержания гепарина. Следствием этого является нарушение транспорта НЭЖК и других липидов, повышение тромбогенных свойств крови, снижение фибринолитической активности крови, возникновение тромбоэмболических осложнений. Эти изменения являются факторами риска атеросклероза, ишемической болезни сердца, инсульта, гипертонической болезни. Кроме этого, возникают изменения функций ЦНС, наблюдаются утомляемость, сонливость, ухудшение памяти, развивается преждевременное старение, возникают изменения во внутренних органах, например жировая инфильтрация (ожирение или жировая трансформация) печени (рис. 96).
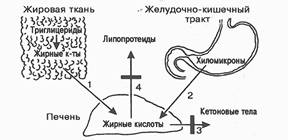
Рис. 96. Причины жировой инфильтрации печени:
1 - усиленный выход НЭЖК из жировой ткани;
2 - интенсивное длительное поступление хиломикронов из кишечника в кровь, а затем в печень;
3 - задержка окисления жирных кислот в печени до кетоновых тел;
4 - задержка выхода из печени пре-β-, β-липопротеидов.
Затемненные прямоугольники - место нарушения процесса
Жировая инфильтрация печени. При нарушении расщепления и выведения жиров из клетки (гепатоцита) говорят о жировом пропитывании ее (инфильтрации). Сочетание инфильтрации с нарушением цитоплазматической структуры клетки и ее белковых компонентов называется жировой дистрофией (рис. 97).
При нарушении междолькового кровотока в центре дольки возникают гипоксия, клеточная атрофия и происходит гибель клеток.
Причинами жировой инфильтрации печени являются: сахарный диабет; ожирение; гиперлипопротеидемия; алкоголизм; отравление фосфором, мышьяком, хлороформом и другими ядами гепатотропного действия; голодание и гиповитаминозы; инфекции и интоксикации; длительное стрессорное воздействие; недостаток в пище холина, метионина и других липотропных факторов, снижение синтеза липокаина в мелких протоках поджелудочной железы; беременность; наследственные дефекты окисления жирных кислот.
Патогенез ожирения печени связан с увеличением поступления липидов в гепатоциты и снижением их утилизации в результате торможения окисления свободных жирных кислот, нарушением образования ЛПОНП и их секреции в кровь. Например, гепатотропные яды угнетают окисление свободных жирных кислот (СЖК) в митохондриях печени, нарушают образование ЛПОНП, образуют активные кислородные радикалы, повреждающие гепатоциты.
Ожирение печени может заканчиваться гибелью гепатоцитов и формированием фиброза и цирроза органа. В то же время следует знать, что в принципе это процесс обратимый и в некоторых случаях он может протекать бессимптомно. Однако чаще при ожирении печени выявляются патологические печеночные пробы, гиперкетонемия и ацидоз (в крови обнаруживаются ацетон, ацетоуксусная и β-оксимасляная кислоты), появляются признаки печеночно-клеточной недостаточности и энцефалопатии.
НАРУШЕНИЕ ОБМЕНА ЛИПИДОВ И НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
Жирные кислоты окисляются в процессе β-окисления, образуя ацетил-КоА. В печени из двух молекул ацетил-КоА образуется ацетоацетил-КоА, который затем взаимодействует еще с одной молекулой ацетил-КоА. Образовавшийся β-окси-β-метилглутарил-КоА способен под действием фермента оксиметилглутарил-КоА-лиазы расщепляться на ацетоацетат и ацетил-КоА. При декарбоксилировании ацетоуксусной кислоты (ацетоацетат) образуется ацетон, при ее восстановлении – D-β-оксимасляная кислота (D-β-оксибутират). Существует второй путь синтеза кетоновых тел: при отщеплении КоА от ацетоацетил-КоА образуется свободная ацетоуксусная кислота. Процесс катализируется ферментом деацилазой, однако его активность в печени низкая, следовательно, этот путь не имеет существенного значения. При жировой инфильтрации печени отмечается избыточное поступление НЭЖК, задержка их окисления и выведения липопротеидов из печени, происходит накопление кетоновых тел в крови (гиперкетонемия) и в моче (кетонурия). Возможно изменение рН крови.
Гиперкетонемия со сдвигом рИ крови в кислую сторону (ацидоз) возможна при угнетении цикла Кребса (цикла трикарбоновых кислот), в котором происходит окисление кетоновых тел. Это наблюдается при голодании, сахарном диабете, стрессе различной этиологии, тяжелой мышечной работе. Однако следует помнить, что в экстремальных ситуациях из кетоновых тел путем глюконеогенеза может синтезироваться глюкоза, служащая источником энергии для работы центральной нервной системы.
При метаболизме липидов образуются полиненасыщенные высшие жирные кислоты (линолевая, линоленовая, арахидоновая). Они являются регуляторами жизненно важных функций и процессов гомеостаза: контролируют течение иммунных реакций, физиологических родов, репаративных процессов. Во время метаболизма арахидоновой кислоты по циклооксигеназному пути в организме образуются простагландины, простациклины, тромбоксаны, а при работе липоксигеназного метаболического пути из арахидоновой кислоты образуются лейкотриены.
Простагландины (ПГ) G2 и Н2 являются предшественниками стабильных ПГЕ , ПГД2 , ПГF , а также простациклинов и тромбоксанов. ПГЕ оказывают иммуномодулирующее действие, расслабляют гладкие мышцы бронхов, трахеи, ЖЕТ, тормозят высвобождение медиаторов из тучных клеток.
8-09-2015, 21:57
