Гонадотропные гормоны это фолликулостимулирующий (ФСГ) и лютеинизирующий гормон, стимулирующий интерстициальные клетки (ЛГ) продуцируются барофильными клетками передней доли гипофиза.
Физиологические эффекты, вызываемые фолликулостимулирующим и лютеинизирующим гормонами, обусловлены их действием на половые железы самцов и самок стимуляцией развития пубертатной железы и фолликулов (образованием в них половых гормонов).
При введении гонадотропных гормонов гипофиза кастратам характерных физиологических эффектов не наблюдается. Это свидетельствует о том, что ускорение полового созревания, сопровождаемое увеличением размера половых органов и ранним появлением вторичных половых признаков, при регулярных инъекциях половозрелым животным гонадотропных гормонов представляет собой результат их действия на половые железы. Непосредственной же причиной полового созревания является действие гормонов, образуемых половыми железами, а не самих гонадотропинов гипофиза. И только разрастание предстательной железы, происходящее при введении ФСГ не только у нормальных самцов, но и у кастратов, является результатом прямого стимулирующего действия этого гормона.
Высвобождение ФСГ гипофизом стимулируется действием нейросекрета гипоталамуса. ФСГ - высвобождающий фактор, представляет собой вещество с относительно низкой молекулярной массой (менее 1000). Повышение в крови уровня андрогенов (у мужчин) или эстрогенов (у женщин) тормозит выделение данного фактора, а также секрецию ФСГ аденогипофизом. Эта отрицательная обратная связь регулирует нормальный уровень половых гормонов в организме. Влияние гипоталамуса на выработку ЛГ гипофизом осуществляется посредством нейросекреции ЛГ высвобождающего фактора.
Нервная система оказывает влияние на выработку этих гормонов путем контроля гипоталамусом выделения ФСГ и ЛГ. Выработка ФСГ и ЛГ зависит от рефлекторных влияний полового акта, а также от различных факторов внешней среды. На выработку гонадотропных гормонов у человека влияют психические переживания. Так, во время второй мировой войны страх, вызванный налетами бомбардировщиков, резко нарушал выделение гонадотропных гормонов и вел к прекращению менструальных циклов. Кроме того, между секрецией ФСГ и ЛГ, с одной стороны, и пролактина - с другой, имеются реципрокные отношения. Усиление секреции двух первых гормонов тормозит секрецию последнего и наоборот (Безруких М 2002).
Промежуточная доля
У большинства животных и у человека промежуточная доля гипофиза обособлена. От передней доли и сращена с задней. Гормон промежуточной доли - интермедин, или меланоцитостимулирующий гормон. Он выделен в химически чистом виде. Определена также последовательность входящих в его состав аминокислот. Гормон встречается в двух формах, различающихся по числу аминокислотных остатков.
У амфибий (в частности, у лягушек) и у некоторых рыб интермедин вызывает потемнение кожи вследствие расширения ее пигментных клеток - меланофоров и более широкого распределения находящихся в их протоплазме пигментных зернышек. Значение интермедина состоит в приспособлении окраски покровов тела к цвету окружающей среды.
При наличии у людей участков кожи, не содержащих пигмента, внутрикожная инъекция интермедина в соответствующие участки приводит к постепенной нормализации их цвета.
Во время беременности и при недостаточности коры надпочечников (в обоих случаях нередко наблюдаются изменения пигментации кожи) количество меланоцитстимулирующего гормона в гипофизе возрастает. По-видимому, интермедин у человека также является регулятором кожной пигментации.
Секреция интермедина промежуточных долей гипофиза регулируется рефлекторно действием света на сетчатку глаза. У млекопитающих и человека интермедин имеет значение в регуляции движений клеток черного пигментного слоя в глазу. При ярком свете клетки пигментного слоя выпускают псевдоподии, благодаря чему избыток световых лучей поглощается пигментом, и сетчатка не подвергается интенсивному раздражению (Воробьева. Е1988).
Задняя доля гипофиза.
Задняя доля гипофиза (нейрогипофиз) состоит из клеток, напоминающих клетки глии,- так называемых питуицитов. Эти клетки регулируются нервными волокнами, которые проходят в ножке гипофиза и являются отростками нейронов гипоталамуса.
Гипофункция задней доли является причиной несахарного мочеизнурения (несахарного диабета). При этом наблюдается выделение больших количеств мочи (иногда десятки литров в сутки), не содержащей сахар, и сильная жажда. Подкожное введение препарата задней доли гипофиза таким больным снижает суточное выделение мочи до нормы.
Из задней доли гипофиза получены два препарата; один резко снижает выделение мочи и повышает артериальное давление, а другой вызывает сокращение мускулатуры матки. Первый назван антидиуретическим гормоном, или вазопрессином, второй - окситоцином.
Механизм антидиуретического действия вазопрессина состоит в усилении обратного всасывания воды стенками собирательных трубочек почек. По этой причине при введении животным и человеку данного гормона у них не только уменьшается диурез, но увеличивается относительная плотность (удельный вес) мочи.
Вазопрессин вызывает сокращение гладких мышц сосудов (особенно артериол) и ведет к повышению артериального давления. Однако прессорный эффект наблюдается лишь при искусственном введении больших доз гормона; выделяющееся же в норме количество вазопрессина дает лишь антидиуретический эффект и практически не влияет на гладкую мускулатуру сосудов.( Иваницкий М. 2003).
Окситоцин стимулирует сокращение гладких мышц матки, особенно в конце беременности. Наличие этого гормона является обязательным условием нормального течения родового акта. При удалении гипофиза у беременных самок роды затрудняются и удлиняются.· Окситоцин также влияет на отделение молока.
Определена химическая структура, как вазопрессина, так и окситоцина, и они получены синтетически. Оказалось, что молекула каждого из них состоит из 8 аминокислот и 3 молекул аммиака.
Шесть аминокислот одинаковы и в вазопрессине, и в окситоцине, а 2 аминокислоты в этих гормонах разные (в окситоцине - лейцин и изолейцин, в вазопрессине - фенилаланин и аргинин). Таким образом, в отличие от гормонов передней доли гипофиза гормоны задней доли являются полипептидами не очень сложного состава.
1.3.Взаимоотношение и взаимодействие гипоталамуса и гипофиза
Как указывалось выше от вентромедиальной области гипоталамуса начинается ножка гипофиза, соединяющаяся его с адено- и нейрогипофизом, которая и является анатомическим связующим элементом двух отделов гипоталамо-гипофизарного аппарата. Через неё осуществляется и функциональная связь.
Поскольку функциональное влияние гипоталамуса на гипофиз осуществляется через биологически активные соединения – нейрогормоны, или рилизинг-факторы, то в данном разделе есть все основания для краткой характеристики гормональной регуляции в целом. К этому следует добавить, что в свою очередь уже передняя доля гипофиза (аденогипофиза) через свои гормоны регулирует деятельность большинства других желез внутренней секреции.
Паракрины. Прежде чем перейти к рассмотрению отдельных гормональных систем, следует остановиться на недавних открытиях, заставляющих пересмотреть многие традиционные представления и ввести новые понятия. Согласно принятому, определению, гормоны - это носители химической информации, вырабатываемые секреторными клетками и выделяемые в кровь, которая доставляет их к органу-мишени. Характерный признак органа-мишени - это способность считывать информацию, закодированную в гормоне. В некоторых случаях информация может считываться клетками, находящимися в непосредственной близости от клетки, секретирующей гормон. При этом гормон просто диффундирует через межклеточное пространство к клетке-мишени, т. е. не является гормоном в классическом виде, поскольку не переносится кровью. (Шмидт Р. и Тевс Г. 1996).
Когда такие носители информации действуют на соседние клетки, их называют паракринными гормонами или гормонами местного действия. Иногда их называют также тканевыми гормонами. Еще раньше это название было закреплено за простагландинами, которые, как недавно установлено, действуют именно таким образом. К настоящему времени известно, что некоторые классические гормоны также могут действовать паракринным путем, а, следовательно, могут называться «тканевыми гормонами». На рис. 1.2 и рис. 1.3 проведено сравнение между гормональной и паракринной регуляцией. Сейчас уже известно, что наряду с классическими гормонами существует множество веществ, обладающих паракринным действием. Нейросекреторная клетка способна осуществлять регулирующее влияние не только посылая другим нейронам обычные нервные импульсы, но и выделяя специфические вещества - нейрогормоны. Процессы нервной и гуморальной регуляции здесь объединены в одной клетке.
При поступлении к передней доли гипофиза продуктов нейросекреции гипоталамуса гипофиз усиливает выделение ряда гормонов. Так, в гипоталамусе образуются и поступают к аденогипофизу вещества, получившие название Высвобождающих факторов (рилизинг-факторов): кортикотропинвысвобождающий, тиротропинвысвобождающий, фолликулостимулинвысвобождающий, лютеинвысвобождающий, соматотропинвысвобождающий. Они способствуют образованию и выделению АКТГ, гонадотропинов, тиротропина, соматотропина.
Содержание высвобождающих факторов в гипоталамусе очень невелико. Поэтому, чтобы исследовать активные соединения, стимулирующие выделение гормона роста и лютеинизирующего гормона гипофиза, потребовалось обработать свыше 100000 гипоталамусов животных
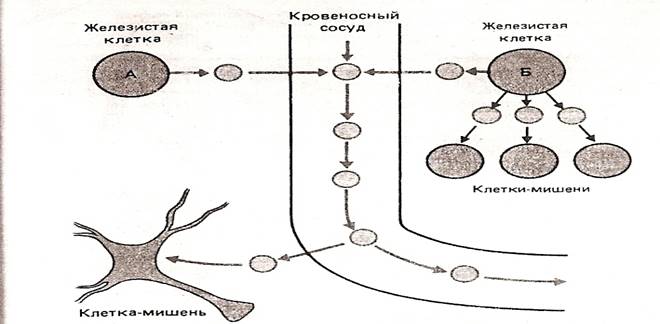
Рис. 1.2 Различие между гормональной и паракринной регуляцией. Железистая клетка А вырабатывает гормон, который в соответствии с классическим определением доставляется к клетке-мишени кровью. Железистая клетка Б вырабатывает гормон, обладающий паракринным действием, т.е. влияющий на соседние клетки. Этот же гормон, однако, может доставляться к органу – мишени и кровью. (По Шмидт Р. и Тевс Г.)
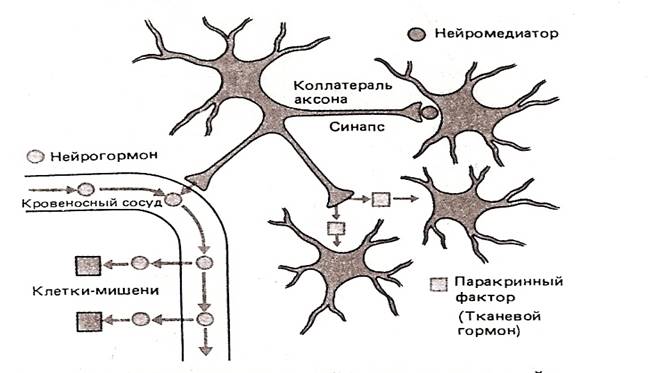
Рис. 1.3.Различия между нейромедиатором, нейрогомоном и паракринным нейрогормоном. Нейрон вырабатывает некое вещество. Если оно выделяется в синаптических окончаниях, то соответствует определению нейромедиатора. Аксон того же нейрона может иметь коллатераль, которая, оканчивается на кровеносном сосуде и высвобождает это вещество в кровоток – в таком случае оно ведет себя как нейрогормон. Из другой коллатерали аксона то же вещество в диффундирует в окружающую ткань и действует соседнюю группу клеток, т.е. оказывает паракринное действие. (По Шмидт Р. и Тевс Г.)
В принципе к таким веществам, паракриннам, можно отнести и классические нейромедиаторы, с той только разницей, что источником химической информации в этом случае являются не специализированные клетки внутренней секреции, а нервные клетки. Нейромедиаторы не поступают в кровь, а диффундируют через узкую синаптическую щель в сторону постсинаптической нервной клетки. На постсинаптической мембране нейромедиатор, как и гормон, связывается со специфичным рецептором.
Нейрогормоны. Недавно было установлено, что нервные клетки также могут вырабатывать пептидные и белковые гормоны и часто выделяют свои секреты в кровь, т. е. продуцируют нейрогормоны. Таким образом, следует признать, что большие участки центральной нервной системы способны выполнять эндокринную функцию. В чем же заключается основное различие между гормоном и нейромедиатором? Оно состоит в том, что нейромедиатор диффундирует через синаптическую щель, тогда как нейрогормон попадает в орган-мишень через кровеносную систему.( Березов Т 2004).
В некоторых случаях терминали аксона нервной клетки выделяют вырабатываемое вещество в виде нейромедиатора, а коллатерали аксона того же нейрона оканчиваются на кровеносном сосуде и высвобождают то же вещество в виде нейрогормона. Поскольку выделяемые пептиды влияют на активность соседних клеток, их следует также считать нейромедиаторами. Нейрофизиологические опыты показали, что нейроны, выделяющие тот или иной классический нейромедиатор, могут быть подразделены на субпопуляции, высвобождающие разные нейропептиды. О функциях этих субпопуляций известно мало. В настоящее время представляется вероятным то, что многие нейроны способны вырабатывать помимо классических нейромедиаторов один или несколько других пептидов.
Поскольку многие полипептидные гормоны образуются из общего белкового предшественника, изменение синтеза одного из этих гормонов может приводить к параллельному изменению (ускорению или замедлению) синтеза ряда других гормонов. Так, из белка проопиокортина образуются кортикотропин и β - липотропин, из β - липотропина может образоваться еще несколько гормонов: γ-липотропин, β-меланоцитостимулирующий гормон, β-эндорфин, γ-эндорфин, α-эндорфин, метионин-энкефлин.
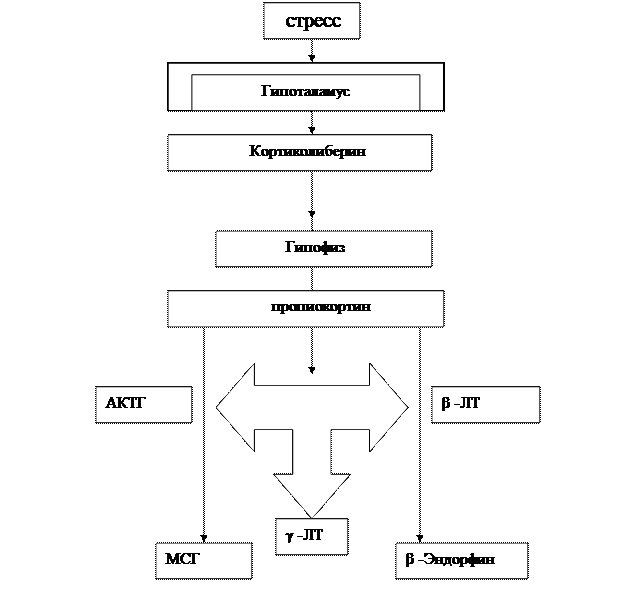
При действии специфических протеиназ из кортикотропина могут образовываться а-меланоцитостимулирующий гормон и АКТГ - подобный пептид средней доли гипофиза (по Федюкович Н. 2001).
Рис 1.5. Прямые и обратные связи в нейроэндокринной системе регуляции.
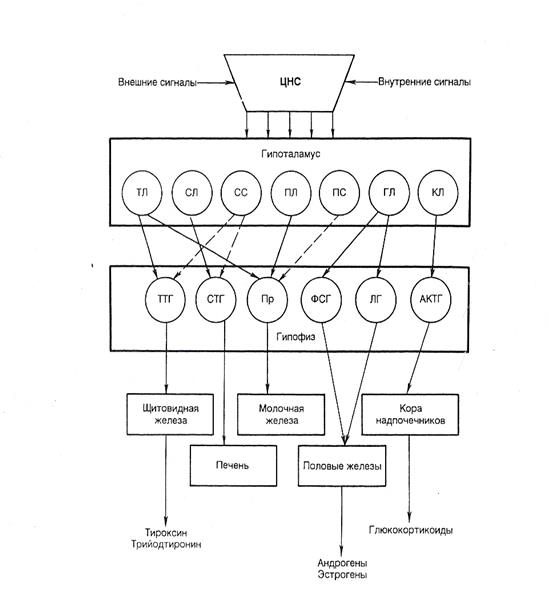
Рис. 1.5 Регуляция активности эндокринных желез центральной нервной системой при участии гипоталамуса и гипофиза.
ТЛ – тиреолиберин, СЛ – соматолиберин ,СС – соматостатин, ПЛ – пролактолиберин, ГЛ – гонадолиберин, КЛ – кортиколиберин, ТТГ – тиреотропный гормон, СТГ – соматотропный гормон, ПР – пролактин, ФСГ – фолликулостимулирующий гормон, ЛГ – лютенизирующий гормон, АКТГ – адренокортикотропный гормон. Сплошными стрелками обозначено активизирующее действие, пунктирным ингибирующее
Рилизинг-гормоны высвобождаются из нервных отростков в области срединного возвышения и через гипоталамо-гипофизарную портальную систему с кровью поступают к аденогипофизу. (поВ. Н. Яковлев 2006).
Секреция гормонов нейронами гипофизотрапной зоны гипоталамуса в портальную систему регулируется содержанием в плазме крови гормонов периферических эндокринных желез. Так, при повышении уровня кортизола в плазме в срединном возвышении высвобождается меньше АКТГ-РГ (рилизинг-гормон адренокортикотропного гормона) и в результате снижается секреция АКТГ аденогипофизом. Общий принцип такой регуляции заключается в том, что при повышении содержания в плазме гормонов периферических эндокринных желез уменьшается выброс соответствующего рилизинг-гормона в кровеносные сосуды медиальной области гипоталамуса. Обратная связь в этой системе регуляции может быть опосредована также самими гормонами гипоталамуса и аденогипофиза. Иллюстрацией прямых и обратных связей в нейроэндокринной системе может служить рисунок 1.6. 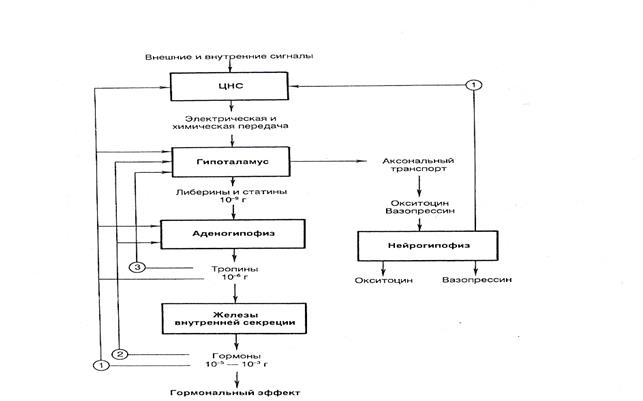
Рис .1.6. прямые и обратные связи синтеза гормонов.
1 – медленно развивающееся и продолжительное ингибирование секреции гормонов и нейромедиаторов, а также изменение поведения и формирования памяти.2 – быстро развивающееся, но продолжительное ингибирование.3 – кратковременное ингибирование.
РАЗДЕЛ 2.МЕТОДЫ ИССЛЕДОВАНИЯ ГИПОТАЛАМО – ГИПОФИЗАРНОГО АППАРАТА
2.1. Методы исследования желез внутренней секреции
Для изучения функций желез внутренней секреции известны следующие методы (Г. Косицкий.1985).
1.Наблюдение результатов полного или частичного удаления соответствующей железы внутренней секреции или воздействия на нее некоторых химических соединений, угнетающих активность .исследуемой железы или избирательно повреждающих клетки, образующие гормон.
2. Введение экстрактов, полученных из той или иной железы, или химически чистых гормонов нормальному животному или животному после удаления железы внутренней секреции или пересадки в организм ткани этой железы.
3. Сращивание (создание общего кровообращения) двух организмов, у одного из которых либо повреждена, либо удалена та или другая железа внутренней секреции.
4. Сравнение физиологической активности крови, притекающей к железе и оттекающей от нее.
5. Определение биологическими или химическими методами содержания определенного. гормона в крови и моче.
6. Изучение механизмов биосинтеза гормонов (чаще всего с помощью метода меченых атомов, т. е. радиоактивных изотопов).
7. Определение химической структуры и искусственный синтез гормона.
8. Исследование больных с недостаточной или избыточной функцией той или иной железы и последствий хирургических операций, проведенных у таких больных с лечебными целями.
К наиболее важным и распространенным из них следует отнести следующие.
1. Изучение последствий удаления (экстирпации) эндокринных желез. После удаления какой-либо эндокринной железы возникает комплекс расстройств, обусловленных выпадением регуляторных эффектов тех гормонов, которые вырабатываются в этой железе. Например, предположение о наличии эндокринных функций у поджелудочной железы нашло подтверждение в опытах И. Меринга и О. Минковского, показавших, что ее удаление у собак приводит к выраженной гипергликемии и глюкозурии; животные погибали в течение 2-3 нед. после операции на фоне явлений тяжелого сахарного диабета. В последующем было установлено, что эти изменения возникают из-за недостатка инсулина - гормона, образующегося в, островковом аппарате поджелудочной железы.
Вследствие травматичности оперативного вмешательства вместо хирургического удаления эндокринной железы может быть использовано введение химических веществ, нарушающих их гормональную функцию. Например, введение животным аллоксана нарушает функцию β - клеток поджелудочной железы, что приводит к развитию сахарного диабета, проявления которого практически идентичны расстройствам, наблюдаемым после экстирпации поджелудочной железы.
2. Наблюдение эффектов, возникших при имплантации желез.
У животного с удаленной эндокринной железой можно ее имплантировать заново в хорошо васкуляризированную область тела, например под капсулу почки или в переднюю камеру глаза. Такая операция называется реимплантацией. Для ее проведения обычно используют эндокринную железу, полученную от животного-донора.
После реимплантации постепенно восстанавливается уровень гормонов в крови, что приводит к исчезновению нарушений, возникших ранее в результате дефицита этих гормонов в организме. Например, Бертольдом (1849) было показано, что у петухов пересадка половых желез в брюшную полость после кастрации предотвращает развитие посткастрационного синдрома. Возможна также пересадка эндокринной железы животному, у которого операция экстирпации ранее не производилась. Последнее может быть использовано для изучения эффектов, возникающих при избытке гормона в крови, так как его секреция в данном случае осуществляется не только собственной эндокринной железой животного, но и имплантированной.
З. Изучение эффектов, возникших при введении экстрактов эндокринных желез. Нарушения, возникшие после хирургического удаления эндокринной железы, могут быть откорректированы посредством введения в организм достаточного количества экстракта данной железы или индивидуального гормона.
4. Использование радиоактивных изотопов. Иногда для исследования функциональной активности эндокринной железы может быть использована ее способность захватывать из крови и накапливать определенное соединение. Известно, например, что щитовидная железа активно поглощает йод, который затем используется для синтеза тироксина и трийодтиронина. При гиперфункции щитовидной железы накопление йода усиливается, при гипофункции наблюдается обратный эффект. Интенсивность накопления йода может быть определена путем введения в организм радиоактивного изотопа 131 I с последующей оценкой радиоактивности щитовидной железы. В качестве радиоактивной метки могут быть введены также соединения, которые используются для синтеза эндогенных гормонов и включаются в их структуру. В последующем можно определить радиоактивность различных органов и тканей и оценить, таким образом, распределение гормона в организме, а также найти его органы-мишени.
5. Определение количественного содержания гормона. В ряде случаев для выяснения механизма какого-либо физиологического эффекта целесообразно сопоставить его динамику с изменением количественного содержания гормона в крови или в другом исследуемом материале.
К наиболее современным относятся методы радиоиммунологическогo определения концентрации гормонов в крови. Эти методы основаны на том, что меченный радиоактивной меткой гормон и гормон, содержащийся в исследуемом материале, конкурируют между собой за связывание со специфическими антителами: чем больше в биологическом материале содержится данного гормона, тем меньше свяжется меченых молекул гормона, так как количество гормонсвязывающих участков в образце постоянное.
6.Важное значение
8-09-2015, 23:52
