Различают первичный туберкулез, который развивается в ранее не инфицированном МБТ организме, а также вторичный генез туберкулеза, когда заболевание возникает при повторном инфицировании. Микобактерии туберкулеза проникают в организм различными путями. При небольшом их количестве, слабой вирулентности и при достаточной устойчивости организма они могут не вызвать специфических изменений на месте внедрения, а также и при лимфо–гематогенном рассеивании. Возникает состояние латентного микробизма [Земскова З.С., Дорожкова И.Р., 1984]. В дальнейшем может развиться инфицирование МБТ, когда возбудитель находится в макроорганизме, но человек не заболевает туберкулезом. При других условиях в результате первичного заражения образуются туберкулезные очаги в том или ином органе (первичный туберкулез).
Если же на фоне инфицирования в организм дополнительно попадет новая порция вирулентных микобактерий, может развиться заболевание, которое будет иметь вторичный генез (вторичный туберкулез). Наличие факторов, приводящих к снижению общей и местной резистентности организма, таких как курение, сахарный диабет, кортикостероидная терапия, лечение цитостатиками, ВИЧ-инфицирование и другие, увеличит вероятность этого события. Также вторичный туберкулез может возникнуть в результате обострения перенесенного в прошлом первичного процесса.
Патогенетические механизмы первичных и вторичных форм туберкулеза разнятся. Поэтому различаются и клинические формы, характерные для этих двух групп. Если для первичного туберкулеза свойственно поражение лимфатических узлов средостения или мезентериальных и, как осложнение, легочной ткани (исключение составляет первичный туберкулезный комплекс, при котором первичный аффект формируется в легком), то при вторичном генезе туберкулеза, как правило, поражается легочная ткань.
В связи с этим фактом можно предположить, что резистентность макроорганизма к первичному и вторичному туберкулезу обусловлена разными факторами иммунитета, а значит, варианты генов, приводящие к предрасположенности к разным по генезу формам туберкулеза, также будут различаться.В ходе дальнейшего анализа больные туберкулезом были поделены на две группы в зависимости от того, на каком этапе симбиоза человека и микобактерии произошло заболевание. В выборку больных с первичным туберкулезом были отнесены пациенты, у которых выставили диагнозы: туберкулез внутригрудных лимфоузлов (n=36), первичный туберкулезный комплекс (n=3), гематогенно-диссеминированный туберкулез легких первичного периода (n=2), плеврит туберкулезной этиологии первичного периода (n=2).Сравнение частот аллелей и распределений генотипов в выборках больных первичным туберкулезом и контрольной показало наличие ассоциации с заболеванием полиморфизма 1465-85G/A гена NRAMP1: найдены статистически значимые различия частот аллелей (р=0,047) и генотипов (р=0,004) этого полиморфизма в группах больных и здоровых. У заболевших первичным туберкулезом чаще, чем в контрольной группе, встречался гетерозиготный генотип 1465-85G/A, риск заболевания у этих индивидов был три раза выше, чем у обладателей других генотипов этого полиморфизма (OR=3,16, 95%CI:1,47–6,86; р=0,002) (табл. 14). Показано, что генотип 1465-85G/G чаще регистрировался у здоровых индивидов (OR=0,33, 95%CI:0,15–0,73; р=0,005), таким образом, установлена его протективная роль в отношении первичного туберкулеза.
Таблица 14 Cтатистические показатели для сравнения частот аллелей и генотипов полиморфизма 1465-85 G/A гена NRAMP1 у больных туберкулезом первичного периода и здоровых
| Полиморфизм | Гено-тип | N | р | OR (95%CI) | Частота аллеля | р |
1465-85 G/A |
GG GA AA |
12 27 4 |
0,004 | 0,33*(0,15–0,73) 3,16* (1,47–6,86) 0,82 (0,22–2,86) |
G=0,593 | 0,047 |
Примечание. Обозначения см. табл. 13
Известно, что продукт гена Nramp1 у мышей участвует в процессе фагоцитоза, влияя на судьбу МБТ в макроорганизме. Кроме того, на мышах показано, что именно ранняя фаза инфекции с микобактериями туберкулеза штамма BCG находится под контролем гена Nramp1 [ScameneE. etal., 1980]. По всей видимости, дефект продукции или функции человеческого гомолога Nramp1 при первой встрече человека с микобактерией может способствовать возникновению заболевания. Тогда, как в организме инфицированного ранее индивида срабатывают механизмы иммунологической защиты, и мутации в гене, а следовательно и дефекты белка NRAMP1 не оказывают подобного влияния.
Ранее показано, что полиморфизм 1465-85G/A гена NRAMP1 оказывает предрасполагающую роль к инфильтративному туберкулезу у тувинцев [Рудко А.А., 2004]. Частота гомозигот А/А этого полиморфизма была практически в два раза выше у больных ТБ, чем у здоровых. Учитывая результаты исследования генетических основ подверженности к туберкулезу русских и тувинцев, можно отметить, что ген NRAMP1 оказывает влияние на предрасположенность к заболеванию, проявляя этническую специфичность.
Выборку больных с вторичным происхождением туберкулеза составили пациенты с установленным диагнозом инфильтративного туберкулеза легких (150 человек), диссеминированного туберкулеза легких (65 человек), очагового туберкулеза (27 человек), казеозной пневмонии (5 человек), впервые выявленного фиброзно–кавернозного туберкулеза легких (4 человека), туберкуломы (4 человека), туберкулеза почечной паренхимы (3 человека), туберкулеза бронха (2 человека), плеврита туберкулезной этиологии (1 человек). Всем больным диагноз туберкулеза был установлен впервые.
При сравнении частот аллелей и распределений генотипов ассоциацию с вторичным туберкулезом продемонстрировали полиморфизм 274С/Т гена NRAMP1, полиморфный маркер гена IL1В, VNTR полиморфизм гена IL1RN, а также ген IL12B (табл. 15). Аллель 274Т гена NRAMP1 чаще встречался в группе больных (р=0,005), причем у лиц гетерозиготных по этому полиморфизму риск заболеть туберкулезом возрастал в 1,75 раза (95%СI:1,06–2,88; p=0,026), а у гомозигот 274Т/Т шанс заболеть был в пять раз выше, чем у обладателей других генотипов этого полиморфизма (95%CI:1,07–33,72; p=0,037).
Показано, что генотип 274С/С статистически значимо чаще встречался у здоровых лиц (OR=0,51, 95%CI:0,31–0,82; p=0,005). В целом, сравнивая результаты, полученные при исследовании частот аллелей и генотипов у больных первичным и вторичным туберкулезом, можно отметить, что разные полиморфизмы гена NRAMP1 оказывают неравнозначное влияние на предрасположенность к туберкулезу у русских г. Томска.
Таблица 15 Статистические показатели для сравнения частот аллелей и генотипов у больных вторичным туберкулезом легких и здоровых
| Полимор-физм | Гено-тип | N | р | OR (95% СI) | Частота аллеля | р |
| NRAMP1 | ||||||
| 274С/Т | CC CT TT |
136 108 13 |
0,010 | 0,51* (0,31–0,82) 1,75* (1,06–2,88) 5,01* (1,07–33,72) |
C=0,739 | 0,005 |
| IL1B | ||||||
| +3953 А1/А2 | A1A1 A1A2 A2A2 |
146 92 21 |
0,103 | 0,70 (0,45–1,10) 1,19 (0,75–1,89) 2,36 (0,82–7,34) |
A1=0,741 | 0,041 |
| IL1RN | ||||||
| VNTR | A1A1 A1A2 A2A2 другие |
134 89 23 12 |
0,025 | 0,55* (0,35–0,86) 2,20* (1,31–3,72) 1,04 (0,48–2,31) - |
А1=0,705 A2=0,269 A3=0,023 A4=0,003 |
0,019 |
Примечание. р - достигнутый уровень значимости; OR – величина отношения шансов; (95%CI) - доверительный интервал для OR; N – количество индивидов с определенным генотипом; *- p < 0,05
Показано, что полиморфизм 1465-85 G/A гена NRAMP1 проявил связь с первичным туберкулезом. Учитывая, что при аналогичном сравнении частот генотипов и аллелей в выборках больных вторичными формами туберкулеза и здоровых, различий не было найдено, полученные данные позволяют предположить наличие влияния этого полиморфизма на более раннее возникновение заболевания. Полиморфный вариант 274С/Т оказался ассоциированным с вторичным генезом заболевания. Для маркеров D543N и 469+14G/C гена NRAMP1 не показано предрасполагающего влияния на ТБ у русских жителей г. Томска.
Известно, что IL–1β является провоспалительным цитокином, а значит, его варианты могут приводить к ослаблению защитной реакции организма и, как следствие, способствовать заболеванию при наличии возбудителя в организме. Выявлены различия частот аллелей при сравнении группы контроля и больных вторичным туберкулезом, при которых заболевание ассоциированно с аллелем А2 IL1В (χ2 =4,17, р=0,041). Продукт гена IL1RN является рецепторным антагонистом IL–1β, выполняя функцию специфического блокатора биологического действия IL–1β. Показано, что аллель А2 приводит к увеличению продукции белка IL–1RN [WilkinsonR. J. etal., 1999].
Выявлено статистически значимое увеличение частоты аллеля А2 VNTR полиморфизма гена IL1RN у больных по сравнению с контролем (χ2 =9,92, р=0,019). Распределение генотипов этого полиморфизма также различалось в группах лиц с вторичным туберкулезом и здоровых (χ2 =14,49, р=0,025): у больных чаще регистрировался гетерозиготный генотип А1/А2, риск развития заболевания у них был выше более чем в 2 раза, по сравнению с лицами с другими генотипами этого полиморфизма (95%CI: 1,31–3,72, р=0,002). Протективная роль в развитии вторичного туберкулеза показана для генотипа А1/А1, так как он статистически значимо чаще встречен у здоровых (OR=0,55, 95%CI: 0,35–0,86, р=0,007).
В целом, сравнение общей группы больных туберкулезом, выборки пациентов–бактериовыделителей, больных вторичным ТБ с контрольной выборкой показало аналогичные результаты, то есть связь полиморфизмов 274С/Т гена NRAMP1, +3953 А1/А2 гена IL1B и VNTR гена IL1RN с заболеванием. Общую выборку больных на 86% составили пациенты с вторичным туберкулезом. При первичном туберкулезе, как правило, не встречается выделение МБТ с мокротой [Рабухин А.Е., 1976]. В исследовании жителей г. Томска только один больной с первичным туберкулезным комплексом был бактериовыделителем. Так, выборка больных туберкулезом МБТ+ практически на 100% состояла из пациентов с туберкулезом вторичного периода. Таким образом, полиморфизм 274С/Т гена NRAMP1, +3953 А1/А2 полиморфизм гена IL1B и VNTR полиморфизм IL1RN проявили ассоциацию с вторичным туберкулезом. Тем более, что ассоциации, найденные при сравнении первичного туберкулеза с контролем, затрагивали иные гены.
Найдена связь полиморфизма 1188А/С гена IL12B как с первичным, так и с вторичным туберкулезом, причем генотип 1188С/С чаще встречался у больных, чем у здоровых (табл. 16). Это наблюдение вполне объяснимо, поскольку известно, что IL-12 участвует в активации макрофагов посредством Т-хелперов, вырабатывающих INF-γ, а активизированные макрофаги, в свою очередь, устремляются к месту нахождения микобактерий и активно их поглощают. Вероятно, варианты гена IL12B влияют на подверженность заболеванию у неинфицированных МБТ и инфицированных ранее людей.
Кроме анализа связи генетических маркеров с заболеванием по типу случай–контроль был использован метод оценки ассоциации болезни с генетическими маркерами на семейном материале с помощью TransmissionDisequilibriumTest (TDT). Метод оценивает предпочтительность переноса аллеля М1 больному потомку от М1М2 гетерозиготных родителей.
Если аллель М1 переносится существенно больше, чем в половину раз, можно заключить, что маркерный локус сцеплен с локусом предрасположенности к заболеванию, и что аллель М1 положительно ассоциирован с аллелем, который увеличивает восприимчивость к заболеванию, или является таковым [SpielmanR.S. et. al., 1993].
Таблица 16 Статистические показатели для сравнения частот аллелей и генотипов полиморфизма 1188А/С гена IL12B у больных различным по генезу туберкулезом и здоровых
| Выборка больных ТБ | Генотипы 1188А/С |
Сравнение | OR(95%CI) | p | ||
| генотипов | аллелей | |||||
| ТБ первичного периода | АА | 27 | р=0,012 | р=0,370 | 0,93(0,42–2,06) | 0,997 |
| АС | 11 | 0,71(0,30–1,64) | 0,500 | |||
| СС | 4 | 13,47(1,35–326,42) | 0,013 | |||
| ТБ вторичного периода | АА | 135 | р=0,041 | р=0,041 | 0,69(0,43–1,10) | 0,120 |
| АС | 89 | 1,20(0,75–1,94) | 0,491 | |||
| СС | 13 | 7,43(1,00–153,87) | 0,023 | |||
Примечание. Обозначения см. табл. 12
Расчет TDT провели для всех исследованных полиморфных маркеров, за исключением D543N гена NRAMP1, для которого TDT не был рссчитан из-за низкой гетерозиготности родителей пробандов (табл. 17). Анализ показал наличие связи полиморфизма 1188А/С гена IL12B с туберкулезом. Дети, больные туберкулезом, лишь в 13% случаев наследовали от родителей аллель 1188А, тогда как аллель 1188С – в 87%.
Таблица 17 Число аллелей, унаследованных больными потомками от гетерозиготных родителей
| Ген | Полиморфизм | Аллели | Количествоперенесенных аллелей | TDT | p (d.f.=1) |
| NRAMP1 | 469+14G/C | G | 10 | 1,00 | 0,317 |
| С | 6 | ||||
| 1465-85G/A | G | 12 | 0,15 | 0,695 | |
| A | 14 | ||||
| 274C/T | C | 9 | 0,06 | 0,808 | |
| T | 8 | ||||
| IL12B | 1188A/C | A | 2 | 8,07 | 0,005 |
| C | 13 | ||||
| VDR | B/b | B | 6 | 2,00 | 0,157 |
| b | 12 | ||||
| F/f | F | 11 | 0,00 | 1,000 | |
| f | 11 | ||||
| IL1B | +3953A1/A2 | A1 | 9 | 0,05 | 0,818 |
| A2 | 10 | ||||
| IL1RN | VNTR | A1 | 9 | 0,60 | 0,439 |
| не А1* | 6 |
Примечание. р – достигнутый уровень значимости; d.f. – число степеней свободы; * - аллели А2 и А3
Найденная связь изменчивости гена IL12B закономерна, поскольку продукт экспрессии этого гена – IL–12 является ключевым цитокином для усиления клеточно-опосредованного иммунного ответа и инициации эффективной противоинфекционной защиты. Он секретируется макрофагами в ответ на индукцию микробными компонентами и продуктами, активирует дифференцировку Т-лимфоцитов, повышает их цитотоксическую активность, усиливает пролиферацию естественных киллеров, Т-лимфоцитов и продукцию других цитокинов. Главный эффект – индукция синтеза INF-γ. Характер течения и исход многих инфекций зависят от способности возбудителя индуцировать синтез IL-12 [Тотолян А.А., Фрейдлин И.С., 2000].Таким образом, у русских жителей г. Томска установлена ассоциация полиморфизма 1188А/С гена IL12B с заболеванием: индивиды-носители аллеля 1188С в большей степени подвержены туберкулезу, как первичному, так и вторичному. Важным обстоятельством с точки зрения достоверности является тот факт, что показанная связь маркера с заболеванием выявлена как методом случай – контороль, так и TDT на семейном материале.
3.3 Анализ накопления случаев туберкулеза в семьях больных
В практической деятельности фтизиатры выделяют такое понятие, как семейный контакт по туберкулезу. Оно подразумевает наличие тесного семейного общения родственников и неродственных индивидов с больным туберкулезом. Также выделяют смежное понятие - семейный туберкулез. О таком туберкулезе говорят, когда больны родственники пациента.При сравнении частоты встречаемости родственников, больных туберкулезом, у заболевших этой инфекцией и у здоровых индивидов, были выявлены отличия (χ2 =15,67, р<0,001) (табл. 18). Показано, что вероятность заболеть туберкулезом выше у индивидов, в семьях которых имеются лица, перенесшие это заболевание (OR=3,63, 95%CI:1,84–7,31; р<0,000). У больных частота туберкулеза среди родственников первой степени родства в 3,63 раза выше по сравнению с родственниками первой степени родства здоровых индивидов.
Таблица 18 Частота заболевания туберкулезом родственников больных данным инфекционным заболеванием и здоровых индивидов
| Выборка | Нет тубер-кулеза в роду | Имеют родственников с туберкулезом | Кол-во родствен-ников 1 степени родства с туб-зом |
Кол-во родствен-ников 2 степени родства с туб-зом |
||
| Из них 1 степени родства | Из них 2 степени родства | Из них 1 и 2 степени родства | ||||
Здоровые n=97 |
84 (86,6%) |
1 (1%) |
11 (11,4%) |
1 (1%) |
2 | 14 |
Больные туберкулезом n=225 |
144 (64%) |
59 (26,2%) |
12 (5,3%) |
10 (4,5%) |
93 | 25 |
Примечание. n – численность группы
Необходимо отметить, что учитывались родственники I и II степени родства, перенесшие туберкулез, но не имеющие тесного семейного контакта в период болезни с обследуемыми индивидами. Таким образом, в данном случае туберкулезный контакт, как причину накопления случаев заболевания у родственников индивидов больных ТБ, можно исключить.
К тому же исследование распространенности туберкулеза среди супругов пробандов, не состоящих в кровном родстве с больными туберкулезом, но находившихся с ними в семейном контакте, проведенное В.П. Чукановой с соавт. (1995), показало, что частота туберкулеза легких в этой группе не отличалась от частоты заболевания среди населения обследованной этнической группы. Кроме того, было установлено, что в семьях пробандов, которые болели деструктивными формами инфекции, частота туберкулеза среди родственников первой степени родства превышала в пять раз частоту заболевания среди населения при отсутствии семейного контакта [Чуканова В.П. и др., 1995]. В аналогичном исследовании, проведенном ранее, получены сходные результаты: в роду здоровых туберкулез встречался в пять раз реже, чем у больных [Березовский Б.А. и др., 1986]. Можно заметить, что в исследовании жителей г. Томска увеличение заболеваемости среди родственников больных несколько ниже. Возможно, это обусловлено социальными, демографическими, или другими причинами. Повышение частоты туберкулеза у родственников больных по сравнению со здоровыми, свидетельствует в пользу имеющегося мнения о наследственной предрасположенности к инфекционным заболеваниям, в том числе к туберкулезу.
При дальнейшем анализе выборку больных разделили на две группы: первую группу составили пациенты, родственники которых болели туберкулезом, вторую – те, среди родственников которых не было заболевших этой инфекцией. Учитывались родственники I и II степени родства. При сравнении частот аллелей у больных первой и второй группы установлено, что в выборке больных семейным туберкулезом статистически значимо чаще встречался аллель 543N гена NRAMP1 (χ2 =6,08, р=0,014).
Полиморфизм D543N гена NRAMP1 является наиболее исследованным в различных популяциях мира из всех аллельных вариантов этого гена. Показана его значимость в подверженности к туберкулезу у японцев и китайцев [GaoP. S. etal., 2000; LiuW. etal., 2004]. Однако у русских г. Томска не найдено ассоциаций этого полиморфизма с заболеванием. Вероятно, полученное накопление аллеля 543N гена NRAMP1 в группе больных, чьи родственники заболели ТБ, по сравнению с больными, у которых здоровые родственники, можно объяснить неравновесием по сцеплению с другим полиморфизмом этого гена, значимым для туберкулеза.
3.4 Анализ связи полиморфизма генов NRAMP1, IL12B, VDR, IL1B, IL1RN с патогенетически важными параметрами болезни
Учитывая поставленные задачи, поиск ассициаций исследуемых полиморфизмов с патогенетически важными параметрами болезни проведен в два этапа: во-первых, анализировали качественные, патогенетически значимые признаки туберкулеза, во-вторых, проведен анализ связи генов с количественными показателями болезни.
3.4.1 Анализ ассоциаций исследованных генов с качественными признаками туберкулеза
Патоморфологические изменения в органах и тканях при туберкулезе многообразны, обусловлены биологическими закономерностями воспалительной реакции, а также особенностями возбудителя болезни, зависят от формы, стадии, локализации и распространенности патологического процесса. Туберкулез относят к хроническим гранулематозным заболеваниям, для которых характерно одинаковое построение гранулем, состоящих из эпителиоидных клеток, гигантских клеток Пирогова-Лангханса и лимфоцитов [Струков А.И., Кауфман О.Я., 1989]. В основе воспаления лежат фазы экссудации, альтерации и пролиферации, однако они не всегда четко выражены и не всегда сохраняется их последовательность. Туберкулезные бугорки могут быть экссудативными (преимущественно лимфоцитарные), продуктивными (эпителиоидно-гигантоклеточные), некротическими, что зависит от вирулентности МБТ, а также от особенностей иммунной реактивности инфицированного макроорганизма [Пузик В.И. и др., 1973; Ерохин В.В., Земскова З.С., 2003]. Степень выраженности различных фаз воспаления также зависит от характера ткани, в которой развивается патологический процесс. Так, экссудация и альтерация будут более резко выражены в рыхлых тканях, и менее – в плотных [Хоменко А.Г., 1996].
Для оценки влияния вариантов генов NRAMP1, VDR, IL1B, IL12B, IL1RN на изменчивость признаков болезни, определяемых рентгенологическими методами, проведен поиск ассоциаций генетических маркеров с наличием деструкции в легочной ткани при туберкулезе и с объемом поражения легкого. При этом пользовались определенным алгоритмом сравнения (рис. 5).
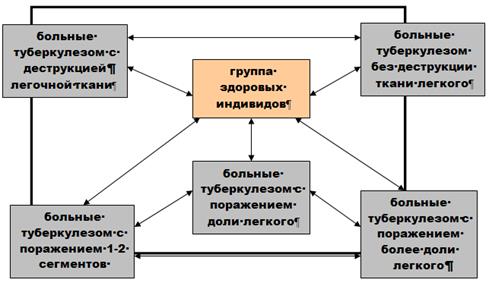
Рис. 5 Алгоритм сравнения групп больных туберкулезом и здоровых индивидов
Выборка больных вторичными формами туберкулеза легких была разделена на две группы в зависимости от наличия деструкции легочной ткани: первую составили 184 больных с экссудативно-некротическим и пролиферативно-некротическим типом воспалительной реакции (инфильтративный туберкулез в фазе распада, диссеминированный туберкулез в фазе распада, казеозная пневмония, фиброзно-кавернозный туберкулез легких); во вторую отнесены 52 больных туберкулезом с отсутствием некроза ткани легкого (диссеминированный туберкулез легких в фазе инфильтрации, инфильтративный туберкулез без распада, очаговый туберкулез, туберкулома).
При сравнении распределений генотипов
8-09-2015, 21:48
