К.ф.-м.н. Ягов Г.В.
Введение
Опыт современной науки показывает, что сочетание казалось бы противоположных свойств приводит к получению новых, неожиданных результатов. Именно такое сочетание свойств воды (водных растворов электролитов) и "камня" (диоксида кремния, кварца, из которого изготовлен капилляр), позволили создать новый метод анализа, который носит название капиллярного электрофореза (КЭФ). Собственно и электрофорез и капиллярность были известны достаточно давно, но только несколько десятилетий назад удалось разработать новый метод анализа, в котором эти явления используются для разделения проб сложного состава на составляющие компоненты.
На сегодняшний день капиллярный электрофорез является одним из наиболее перспективных методов анализа, он динамично развивается и получает всё более широкое применение в различных областях аналитической химии. Простота и доступность этого метода, а также неоспоримые преимущества, которые он даёт при выполнении измерений, позволяют надеяться на динамичное развитие методического обеспечения и скорейшее включение капиллярного электрофореза в перечень физико-химических методов анализа, наиболее часто применяемых в повседневной лабораторной практике.
В предлагаемой вашему вниманию статье обобщены материалы, которые обсуждались на семинарах фирмы ЛЮМЭКС, некоторые из них были опубликованы ранее. Автор выражает надежду, что излагаемый материал будет полезен для специалистов, приступающих к самостоятельной работе с приборами капиллярного электрофореза, как в исследовательском плане, так и для выполнения рутинных измерений.
Основы метода
Теоретические основы капиллярного электрофореза достаточно сложны, что обусловлено использованием в этом методе свойств поверхности раздела двух фаз - жидкости и твердого тела, свойств вязкости жидкости и свойств ионной электропроводности жидкости, потому, не претендуя на академическую строгость изложения, постараемся продемонстрировать основные моменты метода капиллярного электрофореза.
|
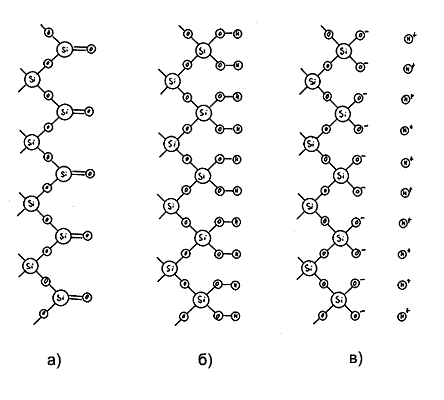
Рис. 1. Схема процессов, происходящих на поверхности кварца а) ювенильная (свежесозданная) поверхность кварца б) образование силанольных групп на поверхности кварца в) диссоциация силанольных групп в водном электролите г) гидратация образовавшихся ионов д) связывание части катионов с поверхностью, формирование двойного электрического слоя |
Обратимся к процессам, происходящим на границе раздела двух фаз: внутренней поверхности кварцевого капилляра и водного раствора электролита, заполняющего капилляр. На свежеобразованной (ювенильной) поверхности плавленого кварца (SiO2 )находятся главным образом силоксановые группы (рис. 1а). При контакте с парами воды или водными растворами силоксановые группы, обладающие двойными связями, оказываются неустойчивыми и, присоединяя молекулу воды, образуют силанольные группы (рис. 1б). При контакте поверхности кварца с водными растворами, силанольные группы диссоциируют с отщеплением ионов Н+ (рис. 1в). Степень диссоциации зависит от температуры и состава водного раствора, в частности от величины рН. При рН> 2,5 на поверхности кварца образуются диссоциированные силанольные группы, которые создают отрицательный поверхностный заряд.
Диссоциированные ионы, находящиеся как на кварцевой поверхности, так и в объёме электролита, гидратируются (рис. 1г). За счёт сил кулоновского взаимодействия, противоположно заряженные гидратированные ионы, находящиеся на поверхности и в объёме жидкости, взаимно притягиваются. Действующие при этом силы настолько велики, что ионы (часть катионов и остатки силанольных групп) частично теряют гидратирующую воду. В результате этого, первый слой катионов, непосредственно прилегающий к поверхности, теряет подвижность, связывается (рис. 1д). Поскольку "пушистые" гидратированные катионы не могут все разместиться в виде монослоя и полностью компенсировать отрицательный заряд поверхности, некоторая часть катионов, нейтрализующих отрицательный заряд, отходит в толщу раствора и образует заряд, распределённый в объеме жидкости, прилегающем к границе раздела и, в силу меньшей энергии связи с поверхностью, обладающий способностью к перемещению (рис. 2а).
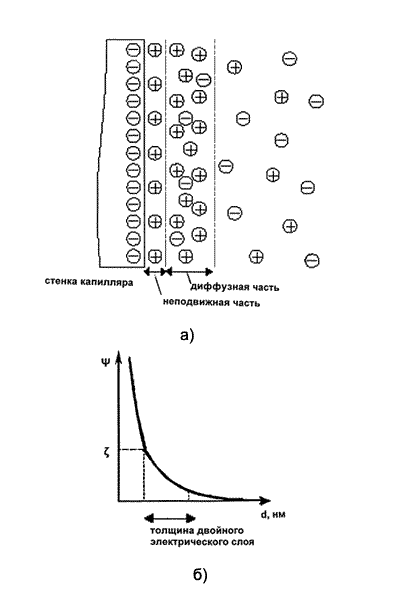 |
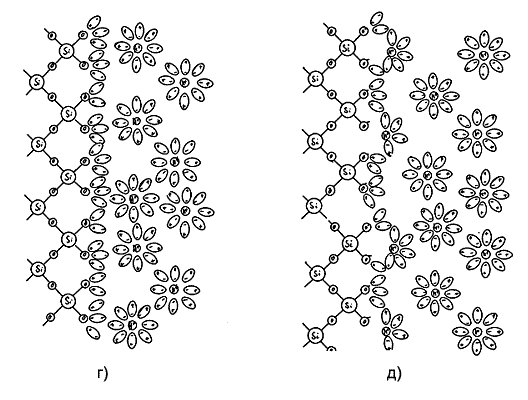
Рис. 2. Формирование двойного электрического слоя (а) и ход потенциала на границе раздела кварц-электролит (б) |
Несмотря на сильное кулоновское взаимодействие рекомбинации зарядов не происходит. В результате взаимодействующие системы зарядов образуют двойной электрический слой, состоящий как бы из двух изолированных друг от друга обкладок конденсатора, имеющих заряды противоположного знака. Одну из обкладок составляют отрицательно заряженные остатки силанольных групп, другая состоит из двух частей - неподвижного слоя катионов, непосредственно примыкающих к поверхности кварца, и диффузного слоя, образованного катионами, находящимися в объеме жидкости. Распределение катионов между неподвижным и диффузным слоями, а, следовательно, и толщина двойного электрического слоя зависит в первую очередь от общей концентрации электролита в растворе. Чем она выше, тем бo льшая часть положительного заряда диффузного слоя перемещается в неподвижный слой и тем меньше становится толщина диффузного слоя (рис. 2б). При концентрации бинарного однозарядного электролита 10-3 ...10-4 М толщина двойного электрического слоя составляет в среднем 30...50 мкм.
Свернём (мысленно) рассматриваемую поверхность в виде трубы с внутренним диаметром 50...100 мкм, тогда окажется, что практически вся жидкость, заполняющая её, будет представлять собой диффузную часть двойного электрического слоя. Трубу столь малого диаметра принято называть капилляром. Если в такой системе вдоль оси капилляра приложить электрическое поле, то в капилляре возникнет продольное движение свободных носителей электрических зарядов (разнополярных ионов) во взаимно противоположных направлениях, а поскольку в диффузной части двойного электрического слоя присутствует избыточная концентрация катионов, то число ионов, перемещающихся к катоду будет значительно больше, при этом их движение будет увлекать за собой всю остальную массу жидкости в капилляре (вследствие молекулярного сцепления и внутреннего трения). Возникает так называемый электроосмотический поток (ЭОП), направленный к катоду, который будет осуществлять пассивный перенос раствора внутри капилляра (рис. 3).
 |
| Рис. 3. Схема процессов в кварцевом капилляре. Стрелкой показано направление электроосмотического потока. |
Вследствие этого процесса в электролите, заполняющем капилляр, возникает направленное перемещение массы жидкости, которое вызвано приложенной разностью потенциалов, при этом вся масса жидкости (за малым исключением приповерхностного слоя) перемещается с одинаковой скоростью, т.е. формируется плоский профиль скоростей. Это очень важное обстоятельство, которое позволяет получить чрезвычайно высокую разрешающую способность метода, поэтому на него надо обратить особое внимание.
Техническая реализация метода КЭФ
Минимальный состав системы, реализующей метод капиллярного электрофореза, должен иметь в своём составе следующие компоненты: кварцевый капилляр, источник высокого напряжения, устройство ввода пробы, детектор и устройство вывода информации. Дополнительные устройства позволяют автоматизировать подачу образцов, термостатировать капилляр и сделать более удобной обработку получаемой информации.
На рис. 4 представлена схема системы капиллярного электрофореза в простейшем случае. Капилляр заполняется раствором электролита, своими концами капилляр опущен в два сосуда, содержащих тот же электролит. Электролит обязательно должен обладать буферными свойствами, чтобы, с одной стороны, воспрепятствовать изменению состава раствора в приэлектродных пространствах, а с другой - стабилизировать состояние компонентов пробы в процессе анализа. В сосуды введены электроды, к которым прикладывается разность потенциалов. Под действием разности потенциалов в капилляре быстро устанавливается стационарное состояние: через него протекает электроосмотический поток (ЭОП), на который будет накладываться электромиграция катионов и анионов во взаимно противоположных направлениях.
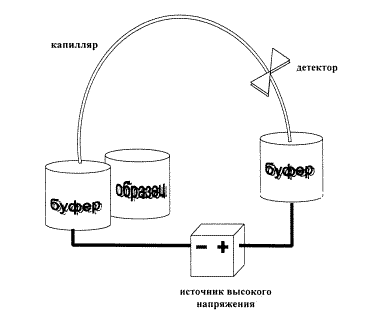 |
| Рис. 4. Схема системы капиллярного электрофореза |
Как правило, в приборах капиллярного электрофореза ЭОП направлен от входного конца капилляра к детектору поэтому, при использовании кварцевого капилляра, разность потенциалов устанавливают таким образом, что входной конец капилляра имеет положительную полярность (анод), а детектор устанавливается вблизи катода. Если теперь в капилляр со стороны анода ввести небольшой объем раствора пробы, то ЭОП будет переносить зону пробы к катоду, и она некоторое время будет находиться в капилляре под воздействием электрического поля высокой напряженности. В течение этого времени компоненты пробы, имеющие заряды и отличающиеся от компонентов рабочего буфера, будут перемещаться в соответствии с присущими им электрическими подвижностями, специфичными для каждого компонента. Катионные компоненты пробы, двигаясь к катоду, будут обгонять электроосмотический поток. Скорость их движения будет складываться из скорости ЭОП и скорости электромиграции, поэтому на выходе капилляра катионные компоненты будут появляться первыми и тем раньше, чем больше электрическая подвижность данного иона. Нейтральные компоненты пробы будут перемещаться только под действием ЭОП, и появятся на выходе, когда его достигнет зона пробы. Анионные компоненты перемещаются к аноду с различными скоростями. Некоторые из них, медленно мигрирующие, будут появляться вблизи детектора после выхода ЭОП, а те, чья скорость миграции по абсолютной величине превышает скорость ЭОП, рано или поздно выйдут из капилляра в прианодное пространство.
Если время нахождения пробы в капилляре (которое можно регулировать длиной капилляра, скоростью ЭОП или приложенной разностью потенциалов) достаточно, то на выходе капилляра вблизи катода формируются зоны раствора, в которых находятся индивидуальные компоненты пробы. Происходит, таким образом, разделение исходной смеси. Если теперь с помощью детектора зарегистрировать появление компонентов на выходе из капилляра, то полученная запись будет называться электрофореграммой и может служить основой для качественного и количественного анализа смеси. Описанный вариант анализа носит название капиллярного зонного электрофореза (КЗЭ). В этом варианте могут определяться катионные компоненты проб и некоторые медленно мигрирующие анионы. Однако главные анионы, определяющие минеральный состав воды, зарегистрировать таким способом невозможно.
Анализ анионов методом капиллярного электрофореза
Для того чтобы методом КЗЭ можно было определять анионные компоненты проб, необходимо изменить полярность прикладываемого напряжения. Однако в этом случае изменится не только направление миграции анионов, но также направление ЭОП и он будет препятствовать перемещению в сторону детектора медленно мигрирующих анионов. Для изменения направления ЭОП необходимо модифицировать поверхность кварцевого капилляра таким образом, чтобы знаки зарядов двойного электрического слоя поменялись на обратные, и направление ЭОП совпадало с направлением перемещения анионов. Это достигается введением в рабочий буферный раствор катионного поверхностно-активного вещества, например, бромида цетилтриметиламмония (ЦТАБ). Катион ЦТАБ активно сорбируется на кварцевой поверхности, занимая при достаточной его концентрации, все вакансии в ближайшем к поверхности слое. Поверхность как бы "ощетинивается" длинными цетильными (С16 Н33- ) цепочками. при дальнейшей промывке рабочим буферным раствором поверхность сорбирует еще один слой поверхностно-активного катиона, ориентированного аммонийным концом наружу (сорбция "щетка в щетку"). В результате первая обкладка двойного электрического слоя становится положительно заряженнной, а вторая (в том числе и диффузная её часть) приобретает отрицательный заряд, и теперь ЭОП снова перемещается в направлении от входного конца капилляра к детектору.
Аналогичными свойствами по модификации поверхности капилляра обладают и другие буферные растворы, например, приготовленный на основе 2-[ N-Циклогексиламино] этан-сульфоновой кислоты с модификатором электроосмотического потока в гидроксильной форме (тетрадецетилтриметил аммония гидроксид) и т.п.
Детектирование сигналов
В системах капиллярного электрофореза наиболее часто применяется фотометрическое детектирование, в котором используется одна ила несколько длин волн, обычно лежащих в ультрафиолетовой области спектра. Соответственно отклик детектора будет наблюдаться только в том случае, когда определяемый компонент имеет заметное поглощение на длине волны детектирования. Это - прямое детектирование. Электрофореграмма будет представлять собой набор положительных пиков, возвышающихся над базовой линией.
Однако, анионы, растворенные в воде, зарегистрировать таким простым способом не удается, т.к. они не обладают собственным поглощением в указанном спектральном диапазоне. В этом случае применяется косвенное детектирование, суть которого состоит в том, что ведущий электролит готовится с добавкой вещества, поглощающего свет на длине волны детектирования. В случае определения анионов добавка также должна быть анионом, например, это может быть хромат-ион. Вследствие того, что ионная сила ведущего электролита в процессе разделения остается постоянной, в зоне, где находится непоглощающий ион, эквивалентно уменьшается концентрация поглощающего иона. В этом случае на электрофореграмме будут наблюдаться обратные (отрицательные) пики, площади которых пропорциональны концентрациям определяемых ионов. В дальнейшем, при компьютерной обработке результатов измерений, график "переворачивается" и приобретает вид, удобный для рассмотрения, с положительно расположенными пиками.
Таким образом, вариант зонного капиллярного электрофореза с модификацией поверхности капилляра и непрямым детектированием позволяет анализировать компоненты, которые в условиях проведения анализа находятся в форме анионов.
Заключение
Разумеется, в рамках элементарного введения в метод, пришлось пойти на определённые жертвы и отказаться от рассмотрения всего многообразия приёмов и методик, которые наработаны в химико-аналитической практике при использовании капиллярного электрофореза. Так, например, для регистрации сигналов в системах капиллярного электрофореза используются флуориметрические детекторы, детекторы с использованием фотодиодных линеек, масс-спектрометрические детекторы и т.п. В качестве аналитических методов, помимо капиллярного зонного электрофореза, используются мицеллярная электрокинетическая хроматография, капиллярная электрохроматография, изотахофорез, капиллярный гель-электрофорез, капиллярная изоэлектрическая фокусировка и др.
29-04-2015, 03:00