Министерство образования и науки Украины
Донецкий Национальный Технический Университет
Красноармейский индустриальный институт
Кафедра "РКК"
Контрольная работа с дисциплины
„Минералогия и петрография”
Вариант №3
Выполнил :
студентка гр. ОПГ-07-2 _____________________________________ Л.В. Бех
Проверила: ______________________________________ Н.А. Рязанцева
Красноармейск – 2008
1. Що собою являють гоніометри, яки типи гоніометрів Ви знаєте?
Для измерения природных многогранников были изобретены специальные приборы — гониометры (от греческого «гония» — угол). Ученым Каранжо был предложен простейший из них, так называемый прикладной гониометр (рис. 1). Он состоит из линейки АВ и транспортира CD. Кристалл К прикладывается так, чтобы между его гранями, линейкой и транспортиром не было просвета; величина угла фиксируется непосредственно на транспортире.
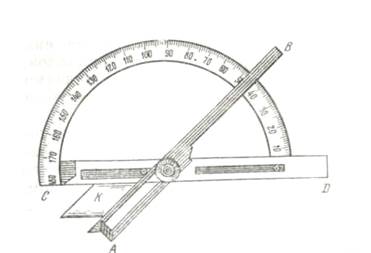
Рис. 1 Прикладной гониометр Каранжо
Неудобство этих гониометров состоит в том, что на них можно измерять углы лишь достаточно крупных кристаллов, в то время как часто приходится иметь дело с кристаллами размером в 2—3 мм и менее. Кроме того, точность измерения на прикладных гониометрах не превышает 1°.
Изобретенный впоследствии Волластоном отражательный гониометр дал возможность измерять мелкие кристаллы со значительно большей точностью. В центре лимба отражательного гониометра (рис. 2) находится кристаллоносец с кристаллом, на который через специальную трубу (коллиматор) направляется узкий пучок света. В другой, зрительной, трубе при поворотах лимба фиксируются сигналы (отсветы) от граней кристалла. Двугранный угол определяется по разности двух отсчетов, он является дополнительным до 180°.
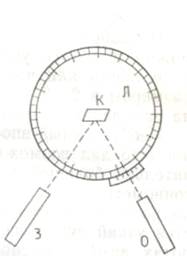
Рис. 2 Схема отражательного гониометра:
Л – лимб, К- кристалл, О – осветитель, З – зрительная труба
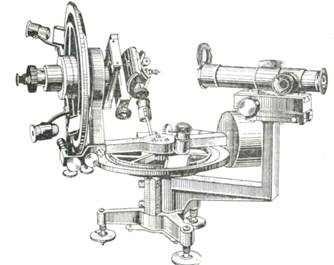 |
Е. С. Федоровым был изобретен двукружный гониометр (рис. 3), в котором имеются два круга — горизонтальный и вертикальный, что дает возможность измерять углы между любыми гранями кристалла, не меняя его положения. На этом приборе можно быстро замерить положение граней в сферических координатах даже для самых мелких кристаллов.

Рис. 3. Двукружный гониометр Е.С. Федорова конца прошлого века (вверху) и совеременный двукружный гониометр фирмы ЭНРАФ НОНИУС (внизу)
2. До якої сингонії і категорії відносяться кристали з формулами симетрії.
3 L 2 3 PC
3 L 4 4 L 3 6 L 2 9 PC
Дати назву простих форм кристалів з вище означеними формулами.
Кристал с формулой симетрии 3 L 2 3 PC относится к низшей категории, ромбической сингонии.
Название вида по наиболее простой общей форме – ромбо-дипирамидальный.
Комбинацию простых форм для кристалов ромбической сингонии рассмотрим на примере оливина (рис.4):
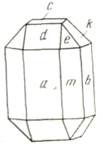
Рис. 4 Оливин. Формула симметрии 3L2 3PC. Простые формы с указанием числовых параметров граней (в пространстве): 3 пинакоида а(100), b(010), с(001), 3 ромбические призмы m(110), d(101), k(021), ромбическая дипирамида) e(111).
Кристал с формулой симетрии 3 L 4 4 L 3 6 L 2 9 PC относится к высшей категории, кубческой сингонии.
Название вида по наиболее простой общей форме – ромбо-дипирамидальный .
Комбинацию простых форм для кристалов кубической сингонии рассмотрим на примере кристала гранат (рис.5):
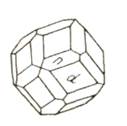
Рис.5 Гранат. Формула симметрии 3L4 4L3 6L2 9PC. Простые формы с указанием числовых параметров граней (в пространстве): ромбододекаэдр d(110) и тетрагонтриокраэдр n(211).
3. Що таке кристалоструктурний зв'язок в мінералах?
Определяющей единицей во всех кристаллических структурах является атом, состоящий из положительно заряженного ядра, окруженного отрицательно заряженными электронными оболочками. Положительно или отрицательно заряженные атомы носят название ионов, соответственно катионов и анионов. Предполагается, что атомы и ионы имеют сферическую форму и определенный объем, непроницаемый для других атомов и ионов.
Обычно выделяют четыре типа межатомной связи:
1) металлическую, характерную для металлов;
2) ионную, обычную для солей (связь между противоположно заряженными ионами);
3) ковалентную или атомную, наблюдаемую в газах и органических соединениях (связь за счет обмена электронами между атомами);
4) остаточную (или ван-дер-ваальсовую) связь, слабую, существующую между молекулами.
Типы химической связи обусловливают свойства кристаллических веществ и удобны для классификации структур. Так, выделяются металлические, ионные, атомные и молекулярные структуры. Иногда в одном и том же кристалле существуют различные типы связи. Такие кристаллические структуры Р. Эванс назвал гетеродесмическими в отличие от гомодесмических с одним типом связи.
В царстве минералов преобладают гетеродесмические и ионные структуры. Преобладающим типом связи является ионная, характерная для силикатов и других кислородных соединений. Для окислов и гидроокислов характерна ионно-ковалентная связь с преобладанием ионной. Чисто ионные структуры типичны для галогенидов. Чисто атомные структуры встречаются в минералах очень редко, такую структуру имеет, например, алмаз. Для сульфидов обычна ионно-ковалентная связь с преобладанием ковалентности. Металлические связи и металлические структуры типичны только для минералов, встречающихся в виде самородных элементов (меди, золота, платины и др.). Молекулярные структуры для минералов не характерны и принадлежат главным образом органическим соединениям.
В кристаллохимии разработано представление, согласно которому выполнение пространства атомами или ионами происходит по принципу плотнейшей упаковки шаров. При этом шары занимают 74,05 % объема, а остальное занимают пустоты. Пустоты имеют тетраэдрическую форму (между четырьмя шарами) и октаэдрическую (между 6 шарами). В пустотах обычно располагаются катионы, размеры (радиусы) которых меньше размеров анионов. Таким образом, основной объем кристаллических решеток минералов, а, следовательно, и объем вещества земной коры занимают анионы, в промежутках между которыми располагаются катионы.
Если рассматривать кристаллические структуры как плотнейшие упаковки шаров, то расстояние между центрами соседних атомов или ионов можно считать равным сумме радиусов этих атомов или ионов. Рентгеноструктурный анализ позволяет определять расстояние между атомами (ионами), благодаря чему можно определить их радиусы и, в конечном счете, структуру кристаллического вещества. Для вычисления ионных радиусов достаточно знать размер хотя бы одного иона. Н. В. Белов и Г. Б. Бокий использовали для этого размер иона кислорода О2- = 0,136 нм.
29-04-2015, 00:38
