Збільшення густини води з підвищенням температури пояснюється зближенням молекул при таненні льоду, внаслідок чого зникають міжмолекулярні порожнини. Подальше зростання температури призводить до розходження молекул Н2О, внаслідок чого густина води стає меншою від одиниці. Зміна густини води при різних температурах характеризується такими показниками:

На густину води впливає, крім температури, також кількість розчинених солей. Із зростанням мінералізації дещо підвищується і густину води. Але між температурою, мінералізацією і густина води немає лінійної залежності. Тобто, густина води зменшується в меншій мірі, ніж це можна було чекати від ступеню зростання температури води і її мінералізації. Така властивість води обумовлює виключно важливу її роль у забезпеченні стійкості водних екосистем та підтриманні якості води. Наприклад, при змішуванні вод різної температури і мінералізації утворюється змішана вода, яка має дещо більшу густину, ніж кожна з них окремо. Так, при надходженні морської солоної води в Дніпровсько-Бузький лиман, де вона змішується з прісною, спостерігається ущільнення річкової води, що і обумовлює її зосередження переважно у придонних шарах. Перехідна зона між окремими масами води, які мають різну температуру і солоність і в якій спостерігається ущільнення вод, називається гідрологічним фронтом. Така зона може виявлятись на межі між прісними і солоними водами у гирлах річок (естуарний фронт), які впадають у море.
Подібні явища спостерігаються у Чорному морі біля берегів Криму як наслідок підйому глибинних більш холодних вод на поверхню під час згону вітром вод поверхневого шару. Таке явище отримало назву апвелінг [27].
Завдяки таким процесам відбувається міграція біогенних елементів з донних відкладень у фотичний шар води (шар води, в якому достатня кількість світла для синтезу рослинами органічної речовини з використанням сонячної енергії) і, як наслідок, активізація продукційної діяльності фітопланктону, зростання біомаси як фіто-, так і зоопланктону. Фактор густини води відіграє дуже важливу роль у житті пелагічних організмів. Найбільші коливання густини води спостерігаються в місцях гідрофронтів в екотонних екосистемах, розташованих на межі змішування морських солоних і прісних вод, що надходять з річковим стоком.
На відміну від морських вод з однотипним сольовим складом, прісні води різних ландшафтних зон за складом головних іонів суттєво відрізняються.
Згідно з класифікацією О.О. Альокіна [27], природні води поділяють за сольовим складом на три класи: гідрокарбонатні (С), сульфатні (S) і хлоридні (СІ). Кожен клас за переважаючими макрокомпонентами розбивається на три групи: кальцієву, магнієву та натрієву, а кожна група, в свою чергу, за кількісним співвідношенням іонів поділяється на чотири типи (І, II, III, IV).
Води типу І утворюються або в процесі хімічного видужування вивержених порід, або при обмінних процесах Са2+ та Mg2+ на Na+. Ці води найчастіше маломінералізовані.
Води типу II — змішані. Склад їх може бути пов'язаним генетично як з осадовими породами, так і з продуктами вивітрювання вивержених порід. До цього типу належать води більшості річок, озер та підземні води малої та помірної мінералізації.
Води типу III включають деяку частину сильно мінералізованих вод або вод, що зазнали катіонного обміну Na+ на Са2+ або Mg2+. До цього типу належать води океанів, морів, лиманів, реліктових водойм та багато інших сильно мінералізованих вод.
До типу IV, для якого характерним є відсутність НСО3-, належать кислі води. Це води боліт, шахтні, вулканічні води або води, що сильно забруднені промисловими стоками.
Характеристики вод позначаються так: клас — хімічним символом відповідного аніону (С, S, СІ), група — символом катіону (Са, Na, Mg). Приналежність до типу позначається римською цифрою в нижньому індексі, до групи — символом у верхньому індексі. Наприклад, СIICa — гідрокарбонатний клас, група кальцію, тип II; CIIIMg — хлоридний клас, група магнію, тип III і т. д. Класифікація якості поверхневих вод суші та естуаріїв за критеріями іонного складу наведена таблиці 2.1.
Таблиця 2.1
Класифікація якості поверхневих вод суші та естуаріїв за критеріями іонного складу
| Класи | Гідрокарбонатні (С) води | Сульфатні (S) води | Хлоридні (СІ) води | ||||||
| Група | Са | Mg | Na | Са | Мg | Na | Са | Mg | Na |
| Тип | І II III | І II III | І II III | II III IV | II III IV | І II III | II III IV | II III IV | І II III |
Загальна характеристика поверхневих вод суші за сольовим складом здійснюється на підставі таких основних показників, як загальна мінералізація, співвідношення іонів та вміст хлоридів і сульфатів.
На більшій частині Європейського континенту води річок мають невелику або середню мінералізацією і належать переважно до гідрокарбонатного класу, кальцієвої групи. Для степових і напівпустельних зон більш характерною є підвищена мінералізація вод сульфатного класу. В Європі такі річки займають лише 3 - 4 % площ усіх річкових басейнів. Ще менше річкових басейнів, води яких відносять до хлоридного класу натрієвої групи. Як правило, такі води характеризуються високою мінералізацією.
На території України річкові води належать переважно до карбонатного класу. Основними іонами сольового складу води Дніпра та його водосховищ є гідрокарбонати та Са2+, тобто вода належить до гідрокарбонатного класу групи кальцію другого типу (СIICa).
Мінералізація і вміст окремих іонів у воді певного водного об'єкта залежить від сезону року. У пік весняної повені мінералізація води в річках знижується внаслідок надходження снігових вод. Після закінчення весняної повені вміст солей знову підвищується. Особливо таке зростання солоності води стає відчутним у літню межень та взимку, коли в річці збільшується роль живлення ґрунтовими водами.
Формування сольового складу зарегульованих річкових систем визначається не тільки складом води, яка надходить із водозбірної площі, а й характером внутрішньоводоймних процесів. При багаторічному регулюванні стоку мінералізація води може підвищуватись лише до певного рівня, тобто до встановлення сольової рівноваги. Сезонні коливання мінералізації та іонного складу води великих водосховищ обумовлюються, головним чином, притоком річкових вод, а при каскадному їх розташуванні — надходженням води з вищерозташованих водосховищ та незарегульованих ділянок річки.
Для невеликих водосховищ у формуванні іонного складу води важливу роль відіграє також змив розчинених солей із прибережних схилів, надходження ґрунтових вод та атмосферних опадів, випаровування, відбирання води на господарські потреби.
2.6 Кислотність
Активна реакція води визначається концентрацією вільних іонів водню (Н+). рН=7 - рідина має нейтральну активну реакцію, рН більше 7 характеризує лужну реакцію, рН менше 7 - кислу реакцію води. Слаболужною називають реакцію води, яка відповідає значенням рН від 7 до 8, слабокислою - рН від 6 до 7. Хоча багато риб та водних безхребетних легко переносять широкі коливання рН, але для рибоводних ставків найбільш сприятлива рН від нейтральної до слаболужної (7-8). Кисла реакція водоймищ є одним з факторів, які викликають бідність їх населення. Кисла реакція середовища шкідливо впливає на дихання та обмін речовин риб, а це призводить до неповного засвоєння живлення, порушення азотистого (білкового) обміну, що призводить до уповільнення росту. У кислому середовищі змінюється і склад крові риб. Нейтральна та слаболужна реакція притаманна більшості найбільш продуктивних водойм. При такій реакції води внесення штучних добрив у ставки дає найбільший ефект. Слаболужна реакція особливо сприяє розкладенню гумусових речовин.
Розділ 3. Аналіз динаміки гідрохімічних показників р. Стрижень за 2006 – 2008 роки
Нагальною на сьогоднішній день залишається проблема очистки стічних вод, особливо підприємств комунальної сфери у зв’язку зі зношеністю та фізичною застарілістю комплексів очисних споруд. За результатами інструментально-лабораторного контролю із 36 перевірених комплексів очисних споруд області – на 17-ти зафіксовано скид недостатньо-очищених стічних вод, що спричиняє негативний вплив на водойми.
Щорічно спостерігається поступове погіршення гідрохімічного стану малих річок, які, в основному, приймають стічні води підприємств області. Для вирішення цієї проблеми необхідним є реконструкція існуючих та будівництво ряду нових сучасних комплексів очистки господарсько-побутових та зливових вод [8].
Питання стану оздоровлення р.Стрижень, особливо у межах м.Чернігів, на сьогоднішній день є дуже актуальним. Річка знаходиться в незадовільному гідрологічному, гідробіологічному та санітарному стані, особливо на ділянках, де індивідуальна забудова досить щільно прилягає до річки, а також замулена, на окремих ділянках заросла високою водною рослинністю, що викликає обґрунтовані скарги мешканців міста.
Причиною незадовільного стану р.Стрижень є також значне захаращення берегів та водного дзеркала річки сміттям та господарсько-побутовими відходами, а також випадки самовільного будівництва у межах прибережних захисних смуг, розташування об’єктів господарської діяльності, житлової забудови, розорювання земельних ділянок в межах водоохоронних зон та прибережних захисних смуг [8, 37].
Стан окремих факторів природного середовища та направленість процесів, що в ньому відбуваються, обумовлюють загальну екологічну обстановку в басейні р. Стрижень, яка у теперішній час в цілому незадовільна.
Таблиця 3.1
Основні гідрохімічні та бактеріологічні характеристики якості води р. Стрижень на час обстеження (2006-2008 р. )
| Характеристики ( показники ) якості води | Одиниці виміру | р. Стрижень | ||
| 2006 | 2007 | 2008 | ||
| Мінералізація та головні іони: ∑ і | мг/дм3 | 336,0 | 296,0 | 502,0 |
| НСО3– | мг/дм3 | 305,1 | 244,1 | 360,0 |
| SO42– | мг/дм3 | 34,0 | 30,2 | 72,0 |
| Cl– | мг/дм3 | 14,0 | 34,0 | 60,0 |
| Са2+ | мг/дм3 | 80,2 | 56,1 | 100,2 |
| Mg2+ | мг/дм3 | 21,9 | 19,5 | 24,3 |
| Na+ + К+ | мг/дм3 | 5,3 | 24,8 | 46,2 |
| Загальна твердість | мг–екв/дм3 | 5,8 | 4,4 | 7,0 |
| Завислі речовини | мг/дм3 | 10,0 | 27,6 | 20,6 |
| Біогенні компоненти : азот амонійний ( NH4+ ) | мг/дм3 | 0,78 | 1,70 | 1,86 |
| азот нітритний ( NO2– ) | мг/дм3 | 0,08 | 0,18 | 0,44 |
| азот нітратний ( NO3– ) | мг/дм3 | 0,78 | 0,72 | 1,31 |
| залізо загальне | мг/дм3 | 0,68 | 0,52 | 0,22 |
| кремній | мг/дм3 | 5,4 | 7,5 | 7,3 |
| фосфати ( РО43– ) | мг/дм3 | 1,10 | 0,70 | 0,50 |
| фосфор загальний | мг/дм3 | - | 1,75 | 0,95 |
| Органічні показники : БСК5 | мг / дм3 | 1,70 | 5,90 | 5,50 |
| перманганатна окиснюваність (ПО) | мг / дм3 | 4,8 | 9,6 | 10,4 |
| біхроматна окиснюваність ( БО ) | мг/ дм3 | 19,0 | 21,0 | 20,0 |
| Вміст газів : кисень | мг/дм3 | 3,30 | 7,70 | 7,40 |
| СО2 | мг/дм3 | - | - | - |
| насичення води киснем | % | 36 | 86 | 76 |
| Водневий показник ( рН ) | одиниць | 7,25 | 7,61 | 7,57 |
Наведені в таблицях показники в переважній своїй більшості перебувають поза межами допустимих значень, а саме: рівень мінералізації води в р.Стрижень має завищені показники, особливо у 2008 році, спостерігається зростання біогенних компонентів (NH4+, NO2–, NO3–) у воді, також простежується зниження рівня деяких компонентів (залізо загальне, кремній, фосфати, фосфор загальний), рівень органічних, газових показників, водневий показник та витрати води зростає, що було зумовлено антропогенним навантаженням та недостатньою якістю проведення екологічних заходів щодо покращення стану води в р.Стрижень.
На рис. 3.1. представлена динаміка мінералізації та головні іони води р. Стрижень

Рис. 3.1. Мінералізація та головні іони
Середньорічні та сезонні значення основних гідрохімічних і бактеріологічних характеристик якості води р. Стрижень наведені в таблиці 3.2.
Перевищення гранично-допустимих концентрацій шкідливих речовин у поверхневих водах на час обстеження (2006-2008 р.) наведені в таблиці 3.3.
Таблиця 3.2
Середньорічні та сезонні значення основних гідрохімічних і бактеріологічних характеристик якості води р. Стрижень
| Характеристики ( показники ) якості води | Одиниці виміру | Роки | |||||||||||
| 2006 | 2007 | 2008 | Середнє значення | ||||||||||
| Витік | Сер. течія | Гирло | Витік | Сер. течія | Гирло | Витік | Сер. течія | Гирло | Витік | Сер. течія | Гирло | ||
| Мінералізація та головні іони : ∑ і | мг/дм3 | 340,0 | 368,0 | 371,0 | 248,0 | 293,3 | 254,4 | 282,0 | 293,0 | 324,3 | 290,0 | 318,1 | 316,6 |
| НСО3– | мг/дм3 | 280,0 | 311,0 | 323,0 | 184,0 | 209,0 | 207,0 | 187,0 | 195,0 | 244,0 | 217,0 | 238,9 | 258,0 |
| SO42– | мг/дм3 | 27,5 | 29,4 | 34,9 | 20,0 | 20,5 | 21,4 | 25,7 | 29,2 | 32,3 | 25,2 | 26,4 | 29,5 |
| Cl– | мг/дм3 | 23,0 | 28,4 | 32,1 | 15,0 | 20,8 | 16,5 | 22,0 | 28,6 | 33,0 | 20,0 | 25,9 | 27,2 |
| Са2+ | мг/дм3 | 61,0 | 65,0 | 70,0 | 40,8 | 48,0 | 45,0 | 53,8 | 55,0 | 69,0 | 51,9 | 56,0 | 61,3 |
| Mg2+ | мг/дм3 | 25,0 | 28,9 | 30,0 | 17,0 | 20,0 | 21,8 | 16,1 | 16,0 | 18,8 | 19,4 | 21,6 | 23,5 |
| Na+ + К+ | мг/дм3 | 16,3 | 20,5 | 22,0 | 9,6 | 9,4 | 8,9 | 11,2 | 12,8 | 14,0 | 12,4 | 14,2 | 15,0 |
| Загальна твердість | мг–екв/дм3 | 5,1 | 5,8 | 6,1 | 3,4 | 4,3 | 4,0 | 4,0 | 4,1 | 4,7 | 4,2 | 4,7 | 4,9 |
| Завислі речовини | мг/дм3 | 5,5 | 8,7 | 11,6 | 16,3 | 18,6 | 21,0 | 15,0 | 27,6 | 20,6 | 12,3 | 18,3 | 17,7 |
| Біогенні компоненти азот амонійний (NH4+ ) | мг/дм3 | 0,89 | 1,27 | 1,12 | 0,28 | 0,37 | 0,46 | 0,47 | 0,59 | 0,63 | 0,55 | 0,74 | 0,74 |
| азот нітритний ( NO2– ) | мг/дм3 | 0,005 | 0,008 | 0,025 | 0,009 | 0,021 | 0,021 | 0,050 | 0,150 | 0,450 | 0,021 | 0,060 | 0,165 |
| азот нітратний ( NO3– ) | мг/дм3 | 1,12 | 1,65 | 3,94 | 1,23 | 1,97 | 2,12 | 0,69 | 0,80 | 1,02 | 1,01 | 1,47 | 2,36 |
| залізо загальне | мг/дм3 | 0,48 | 0,34 | 0,43 | 0,40 | 0,27 | 0,35 | 0,39 | 0,28 | 0,24 | 0,42 | 0,30 | 0,34 |
| кремній | мг/дм3 | 5,3 | 6,9 | 6,2 | 5,2 | 5,7 | 5,5 | 6,1 | 7,6 | 7,4 | 5,5 | 6,7 | 6,4 |
| фосфати ( РО43– ) | мг/дм3 | 0,11 | 0,23 | 0,60 | 0,16 | 0,41 | 0,28 | 0,20 | 0,21 | 0,67 | 0,16 | 0,28 | 0,52 |
| фосфор загальний | мг/дм3 | - | - | - | - | - | - | - | - | - | - | - | - |
| Органічні показники : БСК5 | мг/дм3 | 2,80 | 3,63 | 3,58 | 3,50 | 7,81 | 5,50 | 3,90 | 8,88 | 5,14 | 3,40 | 6,77 | 4,74 |
| перманганатна окиснюваність ( ПО ) | мг/дм3 | 5,1 | 10,3 | 7,2 | 5,4 | 10,3 | 9,2 | 6,0 | 11,8 | 8,7 | 5,5 | 10,8 | 8,4 |
| біхроматна окиснюваність ( БО ) | мг/дм3 | 16,0 | 22,0 | 19,0 | 16,5 | 21,0 | 20,0 | 17,0 | 25,0 | 22,0 | 16,5 | 22,7 | 20,3 |
| Гази : кисень | мг/дм3 | 6,00 | 6,61 | 7,58 | 8,01 | 13,37 | 11,10 | 6,50 | 8,94 | 7,77 | 6,83 | 9,64 | 8,82 |
| насичення води киснем | % | 71 | 80 | 90 | 95 | 100 | 97 | 74 | 96 | 91 | 80 | 92 | 93 |
| СО2 | мг/дм3 | 4,50 | 4,50 | 4,10 | 0,33 | 0,26 | 0,24 | 2,54 | 2,45 | 2,09 | 2,46 | 2,40 | 2,14 |
| Водневий показник ( рН ) | одиниць | 7,65 | 7,87 | 7,78 | 8,01 | 8,47 | 8,30 | 8,05 | 8,43 | 8,10 | 7,90 | 8,26 | 8,06 |
За результатами таблиці 3.2. середньорічні та сезонні значення основних гідрохімічних і бактеріологічних характеристик якості води р. Стрижень. Найбільше навантаження за всіма показниками припадає на гирло р.Стрижень. Простежується зростання деяких показників, а саме азоту нітритного з 0,025 мг/дм3 до 0,45 мг/дм3, завислих речовин з 11,6 мг/дм3 до 20,6 мг/дм3, фосфат-іонів з 0,60 мг/дм3 до 0,67 мг/дм3, хлорид-іонів з 32,1 мг/дм3 до 33,0 мг/дм3, кремнію з 6,2 мг/дм3 до 7,4 мг/дм3, перманганатна окисність з 7,2 мг/дм3 до 8,7 мг/дм3. А також простежується зниження рівня навантаження на р. Стрижень за показниками магній-іонів з 30,0 мг/дм3 до 18,8 мг/дм3, твердості з 6,1 мг-екв/дм3 до 4,7 мг-екв/дм3, біогенних компонентів, заліза загального з 0,43 мг/дм3 до 0,24 мг/дм3, азоту нітратного з 3,94 мг/дм3 до 1,02 мг/дм3.
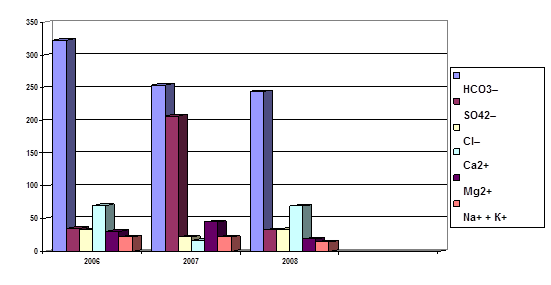
Рис. 3.2. Мінералізація та головні іони в гирлі р.Стрижень
Таблиця 3.3.
Перевищення гранично-допустимих концентрацій шкідливих речовин у поверхневих водах за час дослідження (2006-2008 р.)
| Показники | Величини перевищення ГДК, разів | ||
| 2006 | 2007 | 2008 | |
Для водних об’єктів господарчо-питного та культурно-побутового користування: NH4+ |
- |
- |
- |
| NO3– | - | - | - |
| БСК5 | - | 97 | 83 |
| Перманганатна окиснюваність (ПО) | - | - | - |
| Біхроматна окиснюваність (БО) | 27 | 40 | 33 |
| Важкі метали | - | - | - |
| Пестициди | - | - | - |
| Нафтопродукти | 33 | 490 | 433 |
| Феноли | 19 | 119 | 189 |
Як видно з таблиці 3.3. перевищення ГДК показників шкідливих речовин у поверхневих водах спостерігається, але тільки за деякими показниками. Особливо значне зростання рівня перевищення ГДК спостерігається для нафтопродуктів та фенолів. Причиною даного зростання є зростання скидання стоків з дорожньо-транспортного покриття, зростання кількості автотранспорту, неефективність очистки скидуваних стоків промислового виробництва.
Лімітуючі показники шкідливості наведені в таблиці 3.4.
Таблиця 3.4
Лімітуючі показники шкідливості
| Роки | Значення показників, ∑ С / ГДК | |||||||
| Водні об’єкти рибогосподарського призначення | Водні об’єкти господарчо-питного та культурно-побутового призначення | |||||||
| загально-санітарний | токсікологічний | санітарно-токсікологічний | органолептичний | рибогосподарчий | загально-санітарний | санітарно-токсікологічний | органолептичний | |
| 2006 | 1,83 | 6,41 | 3,43 | - | 28,0 | 2,23 | 0,74 | 23,9 |
| 2007 | 3,37 | 15,3 | 10,9 | - | 155,4 | 4,22 | 1,38 | 128,3 |
| 2008 | 3,17 | 19,8 | 10,4 | - | 222,0 | 4,10 | 1,50 | 196,9 |
Висновки
Значна кількість забруднюючих токсичних речовин потрапляють у водні екосистеми м. Чернігова зі стічними водами. Початок погіршенню екологічного стану поклали вирубка лісів у басейні, меліоративні роботи в заплаві верхньої ділянки річки на початку XX століття (що призвело до заростання очеретом і зникнення природних озер Рудка, Савкове, Купнисте, Очеретяне, скиди стічних вод підприємств та зливових стоків з урбанізованих територій, розорювання заплави.
Результати аналізу гідрохімічних показників свідчать, що р. Стрижень на сучасному етапі деградує, засмічується, замулюється і, як наслідок, зникає як природний елемент ландшафту.
В останні роки (2006-2008 рр.) дійсно погіршився гідрохімічний стан р.Стрижень, що пов’язано із значним постійним антропогенним впливом міста. Щорічно в літній та осінній періоди, внаслідок скиду великої кількості забруднених зливових вод в річку, фіксується зниження розчиненого кисню до критичного рівня, що спричиняє загибель водних живих організмів.
Зупинити процес деградації р. Стрижень, її екосистем, можливо лише впровадженням комплексу заходів, направлених, з одного боку, на зниження антропогенного тиску на річкові та заплавні екосистеми, і з другого – на відтворення природних властивостей русла, заплави і природних систем живлення річки.
Гідрохімічні показники за даними проведеного аналізу мають перевищення норми за показниками вмісту фенолів, нафтопродуктів, карбонатів та сульфатів. За 2006 р. величина перевищення ГДК спостерігається за біохромною окиснюваністю у 27 разів, нафтопродуктами – у 33 рази. Найвищий рівень показника фенолів – 19 разів. За 2007 рік значне перевищення величини ГДК в фенолів 119 разів, БПК5 – 97, біохромна окиснюваність - 40 разів, нафтопродукти – 490 разів. Найвища показники перевищення ГДК припадають на 2008 рік: феноли - 189 разів, біохромна окиснюваність - 33 рази, нафтопродукти – 433 разів, БПК5 – 83 рази.
Список використаних джерел
1. Білявський Г.О. та інші. Основи екологічних знань. - К.: Либідь, 2004. – 408 с.
2. Бойчук Ю.Д., Солошенко Е.М., Бугай О.В. Екологія і охорона навколишнього середовища. – Суми, 2002. – 284 с.
3. Вищі спорові судинні рослини Чернігівщини. / За ред. Ю.О.Карпенка. – Чернігів, 2005. – 86 с.
4. Гейнріх Д., Гергт М. Екологія. – К.: Знання-Прес, 2001. – 287 с.
5. Дедю И.И. Экологический энциклопедический словарь. – К.: Гл. ред. МСЭ, 1987. – 258 с.
6. Дивосвіт природи Чернігівщини: навчальний посібник для вчителів. / За ред Ю.О.Карпенка. - Чернігів, 2001. – 186 с.
7. Джигирей В.С. Екологія та охорона навколишнього природного середовища: Навч.посібник. – К.: Т-во „Знання”, КОО, 2004. – 309 с.
8. Доповідь про стан навколишнього природного середовища в Чернігівській області за 2008 рік. – Чернігів, 2009. – 186 с.
9. Екологія і закон: Екологічне законодавство України. Книга 1. /За ред. В.І.Андрейцева. – К.: Юрінком Інтер, 1997. – 704 с.
10. Екологія і закон: Екологічне законодавство України. Книга 2. /За ред. В.І.Андрейцева. – К.: Юрінком Інтер, 1997. – 576 с.
11. Загальна гідрологія. /За ред. С.М. Лисогора. – К.: Фітосоціоцентр, 2000. – 264 с.
12. Законодавство України про екологію. – К.: КНТ, 2004. – 440 с.
13. Заповідна справа в Україні на межі тисячоліть (сучасний стан, проблеми і стратегія розвитку): матеріали всеукраїнської конференції. / За ред. М.П.Стеценко та ін. – Канів, 1999. – 224 с.
14. Заповедники Украины и Молдавии. / Под общ. ред. В.Е.Соколова, Е.Е. Сыроечковского. – М.: Мысль, 1987. – 271 с.
15. Збереження і невиснажливе використання біорізноманіття України: стан та перспективи. / За ред. Ю.Р.Шелег-Сосонко. – К.: Хімужест, 2003. – 248 с.
16. Зелені скарби Чернігівщини. Колектив авторів. – Чернігів, 2004. - 84 с.
17. Зеленая книга Украинской ССР. / Под общ. ред. Ю.Р.Шелег-Сосонко. – К.: Наук. думка, 1987. – 458 с.
18. Злобін Ю.А., Кочубей Н.В. Загальна екологія: Навч.посібник. – суми: ВТД «Університетська книга», 2003. – 416 с.
19. Карпенко Ю.О. та інші. Дивосвіт природи Чернігівщини: Кн. 2. Луків сіверських різнотрав`я. Світ імлистих боліт і водойм: Навч. посібн. – Чернігів, 2001. – 170 с.
20. Карпенко Ю.О. та інші. Дивосвіт природи Чернігівщини: Кн. 3. Раритети мальовничої Чернігівщини. Живий світ поряд з людиною: Навч. посібн. – Чернігів, 2001. – 163 с.
21. Ковтун О.М. Законодавство України про довкілля: Посібник. – К.: Прецедент, 2005. – 144 с.
22. Кокин К.А. Экология высших водных растений. – М.: Изд-во МГУ, 1982. – 204 с.
23. Крисаченко В.С. Екологічна культура. – К.: Заповіт, 1996. – 352 с.
24. Кузьмичев А.И. Гидрофильная флора юго-запада Русской равнины и ее генезис. – СПб.: Гидрометеоиздат, 1992. – 215 с.
25. Лаптев О.О. Екологія рослин з основами біоценології. – К.: Фітосоціоцентр, 2001. – 144 с.
26. Левина Ф.Я. Болота Черноговского Полесья. // Бот. журнал СССР, ХХІІ, 1937. - № 1.
27. Макрофиты – индикаторы изменений природной среды./ Дублена Д.В., Гейне С., Гроудова З. И др.. – К.: Наукова думка,
29-04-2015, 00:48
