1. Ненаркотические анальгетики (Анальгетики – антипиретики)
Основные особенности:
1. Анальгезируемая активность проявляется при определенных видах болевых ощущений: главным образом при невралгических, мышечных, суставных болях, при головной и зубной боли. При сильной боли, связанной с травмами, полостными операциями они неэффективны.
2. Жаропонижающее действие, проявляющееся при лихорадочных состояниях, и противовоспалительное действие, выражены в разной степени у разных препаратов.
3. Отсутствие угнетающего влияния на дыхание и кашлевые центры.
4. Отсутствие при их применении эйфории и явлений психической и физической зависимости.
Основные представители:
1. Производные салициловой кислоты – салицилаты – натрия салицилат, ацетилсалициловая кислота, салициламид.
2. Производные пиразолона – антипирин, амидопирин, анальгин.
3. Производные н-аминофенола или анилина – фенацетин, парацетамол.
По фармацевтическому действию делятся на 2 группы.
1. Ненаркотические анальгетики применяются в повседневной практике, ими широко пользуются при головной боли, невралгиях, ревматоидных болях, воспалительных процессах. Поскольку они обычно не только снимают боль, но и снижают температуру тела, их часто называют анальгетиками-антиперетиками. До последнего времени для этой цели широко пользовались амидопирином (пирамидон), фенацетином, аспирином и др.;
В последние годы в результате серьезных исследований обнаружена возможность канцерогенного влияния этих препаратов. В экспериментах на животных обнаружена возможность канцерогенного влияния амидопирина при длительном применении, а также его повреждающее действие на кроветворную систему.
Фенацетин может оказывать нефротоксическое действие. В связи с этим применение этих препаратов стало ограниченным, а ряд готовых лекарственных средств, содержащих эти препараты, исключен из номенклатуры лекарственных средств (растворы и гранулы амидопирина, амидопирин с фенацетином и т. д.). Использутся до настоящего времени новомигрофен, амидопирин с бутадионом и др. Широко используется парацетамол.
2. Нестероидные противовоспалительные препараты.
Эти препараты обладают наряду с четко выраженным анальгезирующим действием и противовоспалительной активностью. Противовоспалительный эффект у этих препаратов по силе приближается к противовоспалительному действию стероидных гармональных препаратов. В то же время они не имеют стероидной структуры. Это препараты ряда фенилпропионовой и фенилуксусной кислот (ибупрофен, ортофен и др.), соединений, содержащих индольную группу (индометацин).
Первым представителем нестероидных противовоспалительных препаратов был аспирин (1889 г.), который и сегодня является одним из самых распространенных противовоспалительных, болеутоляющих и жаропонижающих средств.
Нестероидные препараты широко используются при лечении ревматического артрита, болезни Бехтерева и разных воспалительных заболеваний.
Строгого разграничения между указанными группами препаратов нет, так как и те и другие оказывают значительное антигиперимическое, противоотечное, анальгезирующее и антипирическое действия, то есть влияют на все признаки воспаления.
Анальгетики-антипиретики производные пирозолона:
производные п-аминофенола:
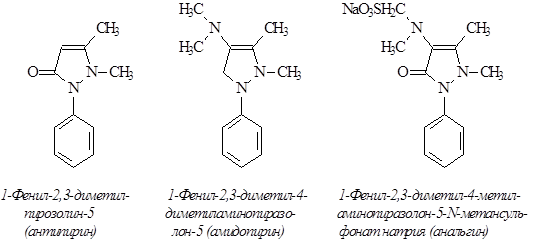
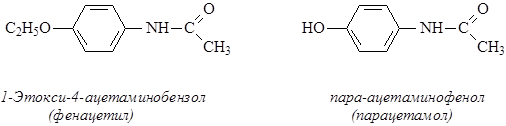
3. Способ получения антипирина, амидопирина и анальгина
В строении, свойствах, биологической активности указанных препаратов много общего. В способах получения тоже. Амидопирин получают из антипирина, анальгин из промежуточного продукта синтеза амидопирина – аминоантипирина.
При синтезе можно исходить из фенилгидразина и ацетоуксусного эфира. Однако этот способ не используется. В промышленном масштабе используют способ получения этой группы соединений исходя из 1-фенил-5-метилпиразолон-5, который является крупно0тоннажным продуктом.
Антипирин.
Широкое изучение пирозолоновых соединений и открытие их ценного фармакологического действия связаны с синтетическими исследованиями в области хинина.
Стремясь получить тетрагидрохинолиновые соединения, обладающие жаропонижающими свойствами хинина Кнорр в 1883 г. осуществил конденсацию ацетоуксусного эфира с фенилгидрозином, который проявляет слабое жаропонижающее действие, плохо растворим в воде; метилирование его привело к получению высокоактивного и хорошо растворимого препарата 1-фенил-2,3-диметилпирозолона (антипирина).
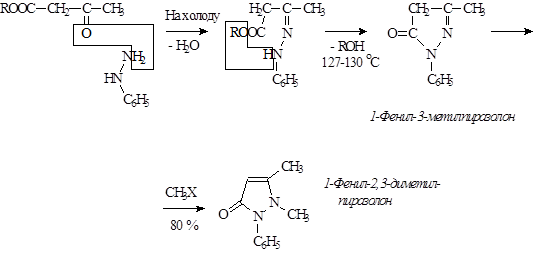
Учитывая наличие кето-енольной таутомерии АУ-эфира, а также таутомерию в пиразолоновом ядре, при рассмотрении реакции между фенилгидразином и АУ-эфиром можно предположить образование нескольких изомерных форм 1-фенил-3-метилпиразолона.
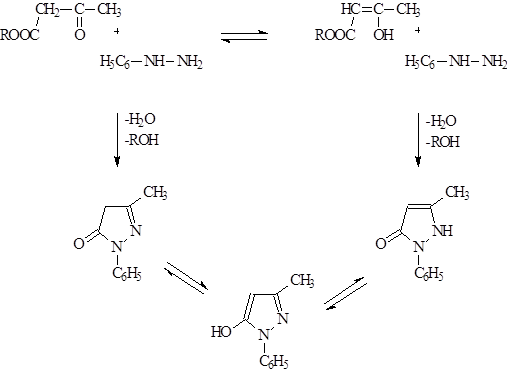
Однако, 1-фенил-3-метилпиразолон известен лишь в 1 форме. Б/ц кристаллы, температура поавления – 127 о С, температура кипения – 191 о С.
Процесс метилирования фенилметилпиразолона может быть представлен через промежуточное образование четвертичной соли, которая под действием щелочи перегруппировывается в антипирин.
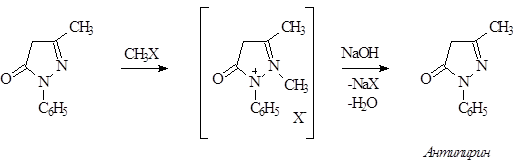
Строение антипирина подтверждено встречным синтезом при конденсации енольной формы ацетоуксусного эфира или галоидного эфира с метилфенилгидразином, так как положение обеих метильных групп определяются исходными продуктами.
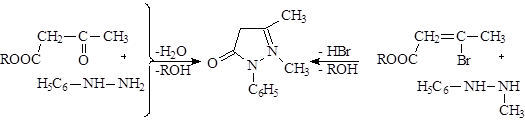
Как способ получения не применяется, так как низкий выход и малодоступные продукты синтеза.
Реакцию ведут в нейтральной среде. Если осуществить реакцию в кислой среде, то при температуре происходит отщепление не спирта, а второй молекулы воды, и образуется 1-фенил-3-метил-5-этоксипиразол.

Для получения 1-фенил-3-метилпиразолона являющегося важнейшим полупродуктом в синтезах пиразолоновых препаратов разработан также метод, в котором используется дикетон
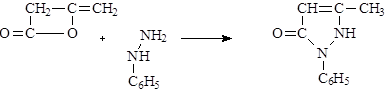
Свойства антипирина – высокая растворимость в воде, реакции с иодистым метилом, РОСl3 и др. объсняется тем, что он имеет структуру внутреннего четвертичного основания.
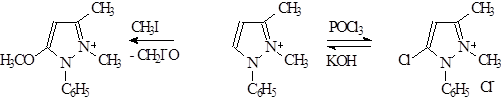
В промышленном синтезе антипирина помимо важного значения условий проведения основной конденсации между АУ-эфиром и фенилгидразином (выбор среды, нейтральная реакция, небольшой избыток ФГ и т. д.) определенную роль играет выбор метилирующего средства.:
1. Диазометан не пригоден, так как приводит к о-метиловому эфиру четвертичной соли, частично образующимся и при метилировании иодистым метилом.
2. Лучше для этих целей использовать хлористый или бромистый метил, диметилсульфат или, лучше, метиловый эфир бензолсульфокислоты, так как в этом случае нет необходимости в поглощающих автоклавах (СН3 Вr – 18 атм.; СН3 Сl – 65 атм.).
Очистка получаемого антипирина обычно осуществляется 2-3 кратной перекристаллизацией из воды; может быть использована перегонка в вакууме (200-205 о С при 4-5 мм, 141-142 о С в вакууме катодного свечения).
Антипирин – кристаллы слабогорького вкуса, без запаха, хорошо растворим в воде (1:1), в спирте (1:1), в хлороформе (1:15) хуже в эфире (1:75). Дает все характерные качественные реакции на алкалоиды. С FeCl3 дает интенсивное красное окрашивание. Качественной реакцией на антипирин является изумрудная окраска нитрозоантипирина.
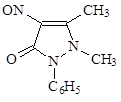
Жаропонижающее, обезболивающее, как местное кровеостанавливающее.
Изучена масса разнообразных производных антипирина.
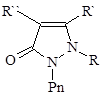
Из всех производных только амидопирин и анальгин оказались ценными анальгетиками, превосходящими по свойствам антипирин.
4 .Технология синтеза антипирина Описание основных стадий процесса.
В эмалированный реактор с масляным обогревом загружают фенилметилпиразолон и проводят его сушку в вакууме при 100 о С до полного удаления влаги. Затем повышают температуру до 127-130 о С и к раствору фенилметилпиразолона приливают метиловый эфир бензосульфокислоты. Температура реакции не выше 135-140 о С. По окончании процесса реакционную массу передавливают в кристаллизатор, куда загружают небольшое количество воды и охлаждают до 10 о С. Выпавший бензосульфонат антипирина отжимают и промывают на центрифуге. Для выделения антипирина, эту соль борабатывают водным раствором NaOH, полученный антипирин отделяют от раствора соли переосаждают в изопропиловом спирте, антипирин очищают перекристаллизацией из изопропилового спирта. Выпускается в порошках и таблетках по 0,25 г.
Амидопирин.
Если антипирин был открыт при изучении алкалоида хинина, то переход от антипирина к амидопирину связан с исследованием морфина.
Установление N-метильной группы в структуре морфина дало основание полагать, что обезболивающее действие антипирина может быть усилено введением в ядро еще одной третичной аминогруппы.
В 1893 г. был синтезирован – 4-диметиламиноантипирин – амидопирин, который по силе в 3-4 раза превосходит антипирин. В последние годы используется только в сочетании с другими препаратами, ввиду нежелательных явлений: аллергии, угнетения кроветворения.
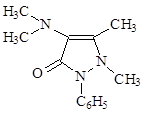
1-Фенил-2,3-диметил-4-диметиламинопиразолон-5 (в воде 1:11).
Качественная реакция с FeCl3 – сине-фиолетовое окрашивание. Получение амидопирина.
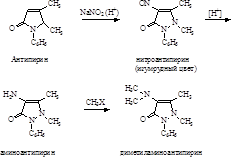
Разработано большое число методов проведения процессов восстановления и метилирования. В производственных условиях отдается предпочтение следующим:
1. Использование антипирина в виде бензолсульфокислоты:
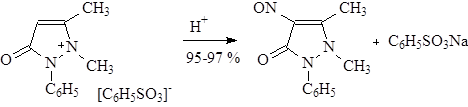
Необходимая для нитрования азотистая кислота образуемая в этом случае при взаимодействии NaNO2 с бензолсульфокислотой, связанной с антипирином.
Восстановление нитрозоантипирина в аминоантипирин (св.желтые кристаллы с Тпл.109°) проводится с высокими выходами при помощи сульфитно-бисульфитной смеси в водной среде:

Механизм реакции.
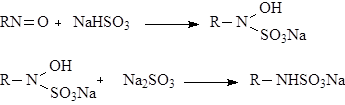
Имеются разработанные методы восстановления нитрозоантипирина сероводородом, цинком (пыль), в CH3 COOH, и др.
Очистка аминоантипирина и выделение его из различных растворов осуществляется через бензилиденовое производное (светложелтые, блестящие кристаллы, tпл 172-173 о С), легко образуется при взаимодействии аминоантипирина с бензальдегидом:
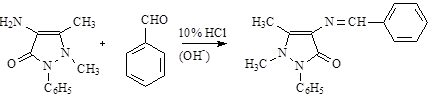
бензилиденаминоантипирин – является исходным продуктом в синтезе анальгина.
Метилирование аминоантипирина наиболее экономичным путем достигается при помощи смеси CH2 O - HCOOH.
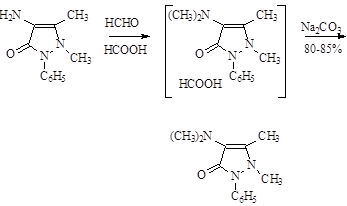
Механизм реакции метилирования:
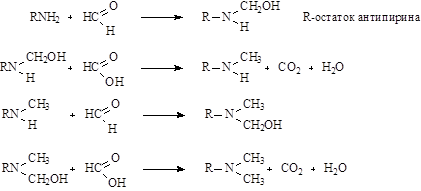
При таком способе метилирования, избегают образования четвертичных аммониевых соединений, образующихся при использовании в качестве метилирующего агента галоидозамещенного диметилсульфоната.
При использовании галоидамина, образующееся четвертичное соединение может быть превращено в автоклаве.
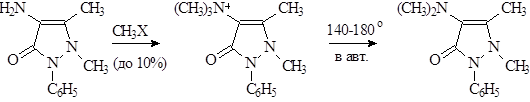
Для выделения и очистки амидопирина применяется многократная перекристаллизация из изопропилового или этилового спирта.
5. Технология синтеза антипирина
Химизм процесса

Описание основных стадий процесса.
Водную суспензию соли антипирина передавливают в нейтрализатор, охлаждают до 20 о С и постепенно приливают 20%-раствор NaNO2 . Температура реакции не должна превышать 4-5 о С. Полученную суспензию изумрудно-зеленые кристаллы нитрозоантипирина и промывают холодной водой. Кристаллы загружают в реактор, куда добавляют бисульфитно-сульфатную смесь. Смесь сначала выдерживают 3 ч. при 22-285о С, затем 2-2,5 ч. при 80 о С. раствор натриевой соли передавливают в гидролизатор. Получают гидролизат аминоантипирина, который подвергают метилированию в реакторе смесью формальдегида и муравьиной кислоты. Выделяют амидопирин из муравьинокислой соли, обработкой раствора соли при 50 о С раствором соды. После нейтрализации амидопирин всплывает в виде масла. Отделяют масляный слой и переводят его в нейтрализатор, где перекристаллизовывают из изопропилового спирта.
Анальгин.
Структурная формула анальгина
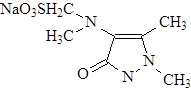
1-Фенил-2,3-диметилпиразолон-5-4-метиламинометиленсернокислый натрий.
Эмпирическая формула – C13 H16 O4 N3 SNa·H2 O – белый, слегка желтоватый кристаллический порошок, легко растворим в воде (1:1,5), трудно в спирте. Водный раствор прозрачен и нейтрален на лакмус. При стоянии желтеет, не утрачивая активности.
Анальгин – лучший препарат среди соединений пиразолонового ряда. Превосходит все анальгетики пиразолонового ряда. Малотоксичен. Анальгин входит в состав многих препаратов
Его высшая разовая доза –1 г, суточная –3 г.
Промышленный синтез анальгина основан на двух химических схемах .
1).
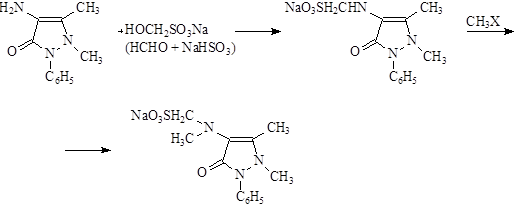
2). Производственный способ получения из бензилиденаминоантипирина.
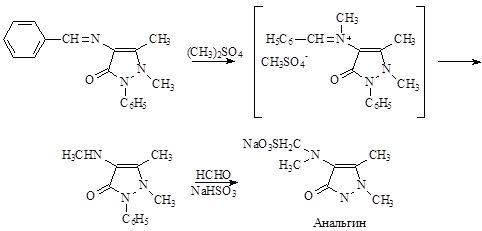
Эмпирическая формула – C13 H16 O4 N3 SNa·H2 O – белый, слегка желтоватый кристаллический порошок, легко растворим в воде (1:15), трудно в спирте. Водный раствор прозрачен и нейтрален на лакмус.
Анальгин – лучший препарат среди соединений пиразолонового ряда. Превосходит все анальгетики пиразолонового ряда. Малотоксичен.
Описание технологического процесса.
В эмалированный реактор с масляным обогревом загружают фенилметилпиразолон и проводят сушку в вакууме при 100 о С до полного удаления влаги. Температуру поднимают до 127-130 о С и к раствору ФМП приливают метиловый эфир бензосульфокислоты. Температура реакции 135-140 о С. По окончании процесса реакционную массу передавливают в кристаллизатор, куда загружают небольшое количество воды и охлаждают до 10 о С. Выпавший бензолсульфонат антипирина промывают на фильтре и подают в следующий реактор для проведения реакции нитрозирования. Там смесь охлаждают до 20 о С и постепенно приливают 20%-ный раствор NaNO2 . Температура реакции 4-5 о С. Полученную суспензию изумрудно-зеленых кристаллов фильтруют на вакуум-фильтре и промывают холодной водой. Кристаллы загружают в реактор, куда добавляют бисульфитно-сульфатнцю смесь, которую сначала выдерживают 3 часа при 22-25 о С, затем еще 2-2,5 часа при 80 о С. Образовавшуюся соль передавливают в реактор омыления, где обрабатывают раствором NaOH, в результате чего образуется динатриевая соль сульфоаминоантипирина.
Полученная соль передавливается в реактор для метилирования диметилсульфатом. ДМС подается в реактор из мерника. Реакция идет при 107-110 о С в течение 5 часов. По окончании реакции продукт реакции отделяют от Na2 SO4 на фильтре 15. Раствор натриевой соли передавливают в реактор и гидролизуют серной кислотой при 85 о С в течение 3 часов. По окончании реакции к реакционной смеси добавляют NaOH для нейтрализации кислоты. Температура реакции не должна превышать 58-62 о С. Полученный монометиламиноантипирин отделяют от Na2 SO4 на фильтре, и передают в реактор метилирования. Метилирование проводят смесью формальдегида и бисульфита натрия при 68-70 о С. В результате реакции получается анальгин, который затем очищают.
Раствор упаривают. Анальгин перекристаллизовывают из воды, промывают спиртом и сушат.
II спсоб – через бензилиденаминоантипирин..
Список использованных источников:
1. Лекарственные средства, применяемые в медицинской практике в СССР /Под ред. М.А. Клюева. – М.: Медицина, 1991. – 512с.
2. Лекарственные средства: в 2-х томах. Т.2. – 10 – изд. стер. - М.: Медицина, 1986. – 624 с.
3. Основные процессы и аппараты химической технологии: пособие по проектированию / Г.С. Борисов, В.П. Брыков, Ю.И. Дытнерский и др., 2-е изд., перераб. И дополн. М.: Химия, 1991. – 496 с.
8-09-2015, 19:30
