Содержание
1. Физико-химические свойства белков: буферные, осмотические. 2
2. Белки простые и сложные. Представление о структуре и биологической роли нуклеопротеинов. 3
3. Напишите аминокислоты, радикалы которых могут участвовать. 4
4. Витаминные коферменты (химическое строение, функции) фолиевые. 5
5. Факторы, влияющие на активность ферментов: температура, рН среды, действие ингибиторов. 6
6. Понятие о свободных радикалах, источники, биологическая роль оксида азота (NO) 9
7. Характеристика углеводов: классификация, функция. Важнейшие представители моно- и дисахаридов. 10
8. Анаэробный гликолиз. Причины перехода на менее энергетически выгодное бескислородное окисление глюкозы.. 13
9. Переваривание жиров в желудочно-кишечном тракте. Ферменты, участвующие в этом процессе. 15
10. Пути выведения холестерина из организма. Нарушения обмена холестерина (гиперлипопротеинемии, атеросклероз, желчекаменная болезнь) 17
11. Задача 1. 19
12. Задача 2. 20
13 Задача 3. 21
14. Задача 4. 21
15. Задача 5. 22
Список литературы.. 24
1. Физико-химические свойства белков: буферные, осмотические
Буферные свойства белков обусловлены обусловлены наличием в составляющих их аминокислотах (карбоксикислотах) аминогруппы (NH2-группы). Благодаря ей аминокислоты могут реагировать не только как слабые кислоты, но и как основания, то есть сами проявлять буферные свойства, присоединяя или отдавая ион водорода. Отщепляемый от карбоксильной группы протон может присоединиться к аминогруппе. В результате - молекула аминокислоты принимает дипольную форму (или форму цвиттер-иона), заряжаясь с одной стороны отрицательно, а с другой - положительно, но оставаясь в целом нейтральной. Именно в этой форме аминокислота и проявляет свои буферные свойства. При повышении концентрации протонов в среде (снижение рН) они фиксируются карбоксильной группой, а молекула оказывается положительно заряженной. Наоборот, при падении концентрации протонов третий протон с положительно заряженной стороны молекулы отдается, а вся молекула заряжается отрицательно.
NН2-R-СООН NН2-R-СОО + Н+
аминокислота диссоциирует с образованием протона и диссоциированной карбоксильной группы.
Н+ + NH2-R-СOО– NHз+-R-СOО–
аминогруппа принимает свободный протон и приобретает форму цвиттер-иона. В избытке протонов молекула заряжается положительно:
NHз-R-СОО– + Н+ NHз-R-СОО–
При дефиците протонов - молекула приобретает отрицательный заряд:
NНз-R-СОО– Н+ + NН2-R-СОО–
Буферные свойства белков проявляются в связывании не только протонов, но и других заряженных частиц. Основная масса поступающих в кровоток веществ (красители, жирные кислоты, липиды, водорастворимые наркотики, релаксанты) связывается с белками, проявляя конкурентные отношения. Естественно, при этом уменьшается буферная емкость белков в отношении протонов, и высокая концентрация последних затрудняет освобождение и ослабляет действие веществ, образующих положительные заряды (функциональная элиминация медикаментов). Одновременно продляется их циркуляция. Последующая гипервентиляция или гипероксигенация через освобождение крови от избытка протонов способствует мобилизации этих веществ и проявлению второй волны в их действии. Таков, например, общепризнанный механизм продленного действия барбитуратов и релаксантов[3.68].
Важнейшим проявлением буферных свойств белков является участие в синтезе аммиака.
Осмотическая активность белка определяется величиной доли пептидных связей, доступной для взаимодействия с водой. В результате связывания воды с белками поддерживается осмотическое равновесие клетки со средой.
2. Белки простые и сложные. Представление о структуре и биологической роли нуклеопротеинов
Белки, или протеины - это сложные органические вещества, которые являются высокомолекулярными полипептидами.
Все белки разделяют на простые и сложные. Простые белки состоят только из аминокислот. Сложные белки кроме аминокислот содержат неаминокислотные компоненты. Неаминокислотную часть сложного белка называют простетической группой. К простетическим группам относятся: гем, производные витаминов, липидные или углеводные компоненты.
В нуклеопротеинах роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. Такие комплексы ДНК с протаминами обнаружены в сперматозоидах, а с гистонами — в соматических клетках, где молекула ДНК “намотана” вокруг молекул белка-гистона.
Нуклепротеинами по своей природе являются вне клетки вирусы — это комплексы вирусной нуклеиновой кислоты и белковой оболочки — капсида.
3. Напишите аминокислоты, радикалы которых могут участвовать
Напишите аминокислоты, радикалы которых могут участвовать:
а) в гидрофобных взаимодействиях;
б) в образовании водородных связей;
в) в ионных связях.
К гидрофобным взаимодействиях способны участвовать аминокислоты, содержащие гидрофобные радикалы:
Алифатические - аланин, валин, лейцин, изолейцин
Серусодержащий метионин
Ароматические - фенилаланин, триптофан
Иминокислота пролин.
В водородных связях участвуют все аминокислоты, имеющие гидроксильные, амидные или карбоксильные группы[5.17].
Ионные (электростатические) взаимодействия между противоположно заряженными аминокислотными остатками (три радикала со знаком "+" и два со знаком "-"). Например, положительно заряженная ε-аминогруппа лизина (-NH3+) притягивается отрицательно заряженной карбоксильной группой - (СОО-) глутаминовой или аспарагиновой кислоты.
4. Витаминные коферменты (химическое строение, функции) фолиевые
Ферменты состоят как минимум из двух частей: белковая (протеиновая) часть и кофакторная часть. Специфические аминокислоты, которые составляют белковую (протеиновую) часть фермента определяются генетическим кодом. Коферментную часть полного фермента составляют или ионы минеральных солей (такие, как кальций, магний и цинку) или витамины или и те и другие в некоторых случаях. Витаминная часть обычно называется коферментом.
Фолиевая кислота и группа родственных соединений, известная в целом как витамин В5, служат в качестве коферментов, или помощников, в химических реакциях, вовлеченных в биосинтез белка и необходимых для нормального продуцирования красных кровяных клеток и клеточного деления. Итак, этот витамин чрезвычайно необходим организму для продуцирования новых клеток клеток кожи, клеток волос, иммунных белых кровяных клеток, красных кровяных клеток - всех не перечислить Но фолиевая кислота также участвует и в удалении жира, депонированного в печени, и в превращении одной аминокислоты в другую для ресинтеза белков организма, поскольку аминокислоты являются строительными блоками белка.
Фолиевая кислота (от лат. folium – лист), витамин Bc, птероилглутаминовая кислота, витамин из группы В; молекула состоит из птеридинового ядра, остатков парааминобензойной и глутаминовой кислот. Бледно-жёлтые гигроскопические кристаллы, разлагающиеся при 250 °С, малорастворимые в воде (0,001%). Фолиевая кислота к. широко распространена в природе и присутствует во всех животных, растительных и микробных клетках. Большинство микроорганизмов, низшие и высшие растения синтезируют фолиевую кислоту. В тканях человека, млекопитающих животных и птиц она не образуется и должна поступать с пищей; может синтезироваться микрофлорой кишечника. Фолиевая кислота стимулирует кроветворные функции организма. В животных и растительных тканях Ф. к. в восстановленной форме (в виде тетрагидрофолиевой кислоты и её производных) участвует в синтезе пуриновых и пиримидиновых оснований, некоторых аминокислот (серина, метионина, гистидина), холина и др. Суточная потребность в Ф. к. для взрослого человека 0,2–0,4 мг. Основной источник Ф. к. – листовые овощи, печень, дрожжи. Богата ею земляника. Ф. к. – эффективное средство лечения некоторых форм анемии и др. заболеваний. Получают Ф. к. при конденсации 2,4,5-триамино-6-оксипиримидина, 1,1,3-трихлорацетона и n-амино-бензоил-a-глутаминовой кислоты. Для лечения некоторых видов злокачественных опухолей применяют близкие по строению к Ф. к. соединения (например, аминоптерин, метотрексат), являющиеся антиметаболитами Ф. к. и оказывающие подавляющее действие на рост и развитие клеток.
5. Факторы, влияющие на активность ферментов: температура, рН среды, действие ингибиторов
Ферменты, обладающие широкой специфичностью, (например, ЩФ) способны катализировать превращение довольно большого числа субстратов. Сродство фермента к субстратам различной природы, а также скорость их превращения могут значительно отличаться. Поэтому значения активности фермента, определённые при использовании разных субстратов, могут отличаться в несколько раз, и сравнивать их нельзя[10.89].
Степень очистки субстратов, используемых в диагностических наборах, как правило, должна быть не менее 98 %. Примеси, содержащиеся в препаратах субстратов, могут влиять на активность ферментов. Например, примеси в препаратах L- кетоглутарата значительно ингибируют активность АСТ и АЛТ. Кроме того, примеси могут снижать точность измерений. Так, примеси n-нитрофенола в препаратах п-нитрофенилфосфата увеличивают оптическую плотность холостой пробы, что приводит к снижению точности измерений.
Концентрация субстрата — один из наиболее важных факторов, определяющих скорость ферментативной реакции. Концентрация субстрата, при которой достигается максимальная скорость реакции, называется насыщающей концентрацией. При снижении концентрации субстрата в реакционной смеси скорость реакции также снижается. Концентрации субстрата выше насыщающей могут привести к ингибированию фермента и снижению скорости ферментативной реакции.
Таким образом, определение активности ферментов нужно проводить при насыщающей концентрации субстрата.
В качестве буферных соединений в диагностических наборах используют растворы солей неорганических и органических кислот, амины (триоксиметиламинометан, диэтаноламин, триэтиламин, имидазол) и другие соединения. Природа буферного соединения влияет на скорость ферментативной реакции. Например, ион фосфата ингибирует активность ЩФ. Наибольшая скорость гидролиза субстратов ЩФ достигается в диэтаноламиновом буфере, более низкая — в 2-амино-2-метил-1-пропаноловом буфере. Поскольку в наборах для определения ЩФ различные фирмы используют разные буферные растворы, сравнение результатов определения активности, полученных с помощью этих наборов, не всегда возможно.
Буферные соединения, используемые в наборах, должны иметь квалификацию “чда” или “хч”, т.к. примеси ионов металлов могут как ингибировать, так и активировать многие ферменты. Некоторые примеси, например продукты окисления или распада органических соединений, могут инактивировать фермент, ингибировать его активность, или вызвать окрашивание в холостой пробе.
Концентрация буферного соединения влияет на конформацию фермента в растворе и должна быть оптимальной для каждого фермента.
Ферменты чрезвычайно чувствительны к изменениям рН среды. Для каждого фермента существует оптимальное значение рН раствора, при котором превращение субстрата происходит с максимальной скоростью. Например, для ЩФ оптимум рН лежит в области 9,9–10,3, для АСТ и АЛТ — в области 7,2–7,4 и т.д. Небольшие отклонения от оптимального значения рН могут вызвать уменьшение активности фермента в несколько раз.
В качестве активаторов ферментов в диагностических наборах используют ионы металлов (например, ионы магния для ЩФ) или органические соединения (например, пиридоксальфосфат в наборах для определения АСТ и АЛТ). В качестве стабилизаторов используют белки и их гидролизаты, полиэтиленгликоль, сахара, декстран и другие соединения. Как правило, в инструкциях по использованию наборов не указывают состав и количество добавленных стабилизаторов. Поэтому результаты определения активности ферментов наборами различных фирм, и тем более наборами, изготовленными в лаборатории, могут значительно отличаться.
Для большинства очищенных ферментов скорость ферментативной реакции пропорциональна концентрации фермента в реакционной смеси. Это справедливо, например, для реакций, катализируемых ЩФ. Некоторые ферменты (например, АСТ и АЛТ) не подчиняются этой закономерности. При уменьшении их концентрации в реакционной смеси скорость реакции не снижается пропорционально. Это связано со сложными структурными перестройками в молекулах ферментов при разбавлении.
В случае, когда активность ферментов определяют в сыворотке или других биологических жидкостях, где присутствует огромное количество различных соединений, зависимость активности фермента от его концентрации ещё более усложняется. Поэтому очень важно точно соблюдать дозировку сыворотки, указанную в инструкции, и отбор образца сыворотки проводить поверенной автоматической пипеткой.
Установлено, что скорость ферментативных реакций при изменении температуры инкубации на 10 °С изменяется в 2 раза. Например, активность АСТ в сыворотке фирмы Randox, определённая при 37 °С, составляет 35 U/л, а при 25 °C – 16 U/л. При дальнейшем понижении температуры реакционной смеси скорость реакции будет снижаться: при 15 °С активность АСТ равна 8 U/л, при 5 °С — 4 U/л. Поэтому определение активности ферментов необходимо всегда проводить при температуре, указанной в инструкции по использованию набора.
Таким образом, для получения воспроизводимых и сопоставимых данных при определении активности ферментов в биологических жидкостях необходимо учитывать всё многообразие факторов, влияющих на активность ферментов.
6. Понятие о свободных радикалах, источники, биологическая роль оксида азота (NO)
Свободные радикалы. или химические соединения с неспаренным электроном (обозначается жирной точкой), например. Парамагнитны, реакционноспособны. Короткоживущие радикалы - промежуточные частицы во многих химических реакциях. Некоторые радикалы свободные стабильны и выделены в индивидуальном состоянии. С участием радикалов свободных осуществляются важные биохимические процессы, например ферментативное окисление.
Оксид азота (NO) является одним из наиболее важных биологических медиаторов, который вовлечен в множество физиологических и патофизиологических процессов. Он представляет собой уникальный по своей природе и механизмам действия вторичный мессенджер в большинстве клеток организма. В частности, оксид азота участвует в реализации многих важных физиологических функций, таких как вазодилатация, нейротрансмиссия, снижение агрегации тромбоцитов, реакции иммунной системы, регуляция тонуса гладких мышц, состояние памяти и др., а также некоторых патологических процессов. Важная роль оксида азота в многочисленных биологических процессах в организме явилась основанием для того, чтобы назвать NO в 1991 году Молекулой Года.
Термином «оксид азота» (или «окись азота») обозначается восстановленная форма моноокиси азота (NO) с периодом полураспада от 2 до 3 представляет собой растворимый в воде и жирах бесцветный газ с уникальными физиологическими свойствами. В химическом отношении NO представляет собой маленькую липофильную молекулу, состоящую из одного атома азота и одного атома кислорода и имеющую непарный электрон, что превращает ее в высоко реактивный радикал, свободно проникающий через биологические мембраны и легко вступающий в реакции с другими соединениями[8.115].
В организме NO синтезируется клетками из аминокислоты L-аргинин [25,39]. Этот процесс представляет собой комплексную окислительную реакцию, катализируемую ферментом NO-синтазой (NOS), которая присоединяет молекулярный кислород к конечному атому азота в гуанидиновой группе L-аргинина (рис.1).
Характерной особенностью NO является его способность быстро диффундировать через мембрану синтезировавшей его клетки в межклеточное пространство и также легко (не нуждаясь в рецепторах) проникать в клетки-мишени. Внутри клетки он активирует одни энзимы и ингибирует другие.
7. Характеристика углеводов: классификация, функция. Важнейшие представители моно- и дисахаридов
Углеводы — широкий класс органических соединений, которые состоят из углерода, водорода и кислорода. В большинстве углеводов атомное соотношение водорода и кислорода одинаково с их отношением в воде, равным 2 : 1 (этим и объясняется происхождение названия «углеводы»); общая формула таких углеводов СmН2nОn. Исключение представляют дезоксисахара, которые имеют другой состав, например дезоксирибоза С5Н10О4, рамноза и фукоза С6Н12О5.
С точки зрения строения все углеводы можно рассматривать как многократно гидроксилированные альдегиды и кетоны, или как многоатомные аль-дегидо- и кетоспирты.
По числу углеводных остатков все углеводы классифицируют на:
моносахариды — углеводы, молекулы которых не могут быть разложены на более простые молекулы углеводов;
олигосахариды — углеводы, содержащие от двух до десяти одинаковых или различных моносахаридных остатков. По числу таких остатков различают дисахариды, трисахариды, тетрасахариды и т. д.;
полисахариды — углеводы, содержащие более десяти (до тысячи и выше) одинаковых или различных моносахаридных остатков.
Все олиго- и полисахариды подвергаются гидролизу с расщеплением на моносахаридные остатки, которые в результате присоединения воды образуют молекулы моносахаридов, например при кипячении в разбавленных кислых растворах. Образование олиго- и полисахаридов из моносахаридов по реакции конденсации протекает с выделением воды,
Моносахариды по виду функциональной группы (отличной от гидроксила ОН) делятся на альдозы (содержат альдегидную группу) и кетозы (содержат карбонильную группу). Все альдозы дают характерные реакции на альдегиды.
По числу атомов кислорода в молекуле (обычно оно равно числу атомов углерода) среди моносахаридов различают триозы (С3О3), тетрозы (С4O4), пентозы (С5О5), гексозы (С6О6), гептозы (С7О7) и т. д. К этим названиям при построении названий моносахаридов присоединяют функциональную приставку (альдо- или кето-), например; альдотриоза, альдотетроза, альдогексоза, альдопентоза.
Все моносахариды оптически активны, поскольку в их молекулах имеется асимметрический атом С (т. е. отсутствуют плоскость и центр симметрии молекулы). В зависимости от того, где расположена группа —ОН у предпоследнего атома С в углеродной цепи, изомерные углеводы будут D-и L-соединениями.
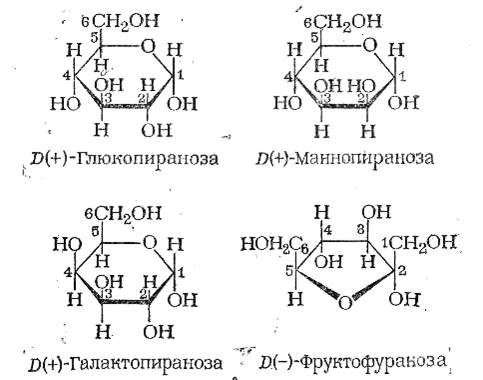
Наиболее важными представителями моносахаридов являются пентозы (арабиноза, ксилоза, рибоза) и гексозы (глюкоза, манноза, галактоза, фруктоза).
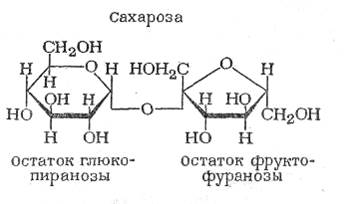
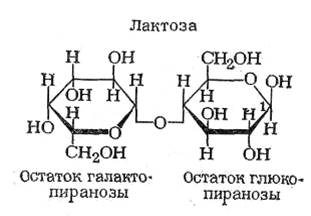
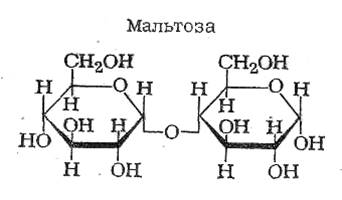
Дисахариды (простейшие олигосахариды) образуются при конденсации двух молекул моносахаридов с отщеплением воды:
С6Н12О6 + С6Н12О6 → С12Н22О11 + Н2О
Наиболее известными представителями дисахидов являются сахароза, лактоза, мальтоза.
8. Анаэробный гликолиз. Причины перехода на менее энергетически выгодное бескислородное окисление глюкозы
Под термином гликолиз понимают происходящее без участия кислорода (анаэробно) окисление глюкозы до молочной кислоты. Исходным субстратом гликолиза является глюкоза, она доставляется в мышцы кровью, или в результате распада в мышце гликогена. Глюкоза активируется соединяясь с фосфорной кислотой, модифицируется и затем в результате несложных ферментативных процессов превращается в пировиноградную кислоту (ПВК). В анаэробных условиях, т.е. в условиях абсолютной или относительной недостаточности кислорода, ПВК окисляется до молочной кислоты. Таким образом, в условиях недостатка кислорода ресинтез АТФ осуществляется в результате гликолиза с накоплением недоокисленных продуктов метаболизма, в частности молоч- ной кислоты (лактата). Интенсивность анаэробной нагрузки может составлять не более 60 минут. Количество молекул АТФ синтезируемых за один цикл 2 - 3 . Гликолиз хорош тем, что не требует повышенного снабжения организма кислородом. Кроме того, он обладает гораздо большим резервом, чем креатин-киназный путь ресинтеза АТФ. Однако, во-первых он малоэффективен (всего три молекулы АТФ на молекулу глюкозы); во-вторых запасы гликогена в организме хотя и велики, но не безграничны и легко могут быть исчерпаны; в-третьих, гликолиз способствует накоплению в организме лактата, что приводит к закислению среды и далеко не безразлично для функций организма; в-четвертых, "запуск" гликолиза требует некоторого времени, он не настолько быстрый как креатинкиназная реакция и полное его развертывание возможно только через 10-20 секунд.
Бескислородное окисление, хотя и является малоэффективным в энергетическом отношении процессом, совершенно необходимо организму для быстрого реагирования на бескислородные условия и экстремальные нагрузки. Ведь при экстремальных нагрузках организм переходит на бескислородный путь окисления только лишь потому, что кислородные транспортные системы просто не успевают, да и не могут доставить к работающему органу адекватное количество кислорода.
9. Переваривание жиров в желудочно-кишечном тракте. Ферменты, участвующие в этом процессе
В процессах пищеварения все омыляемые липиды (жиры, фосфолипиды, гликолипиды, стериды) подвергаются гидролизу на составные части, уже названные ранее, стерины же химическим изменениям не подвергаются. При изучении этого материала следует обратить внимание на отличия пищеварения липидов от соответствующих
8-09-2015, 19:55
