Введение
Мышечными тканями (textus muscularis) называют ткани, различные по строению и происхождению, но сходные по способности к выраженным сокращениям. Они обеспечивают перемещения в пространстве организма в целом, его частей и движение органов внутри организма (сердце, язык, кишечник и др.).
Свойством изменения формы обладают клетки многих тканей, но в мышечных тканях эта способность становится главной функцией.
Основные морфологические признаки элементов мышечных тканей – удлиненная форма, наличие продольно расположенных миофибрилл и миофиламентов – специальных органелл, обеспечивающих сократимость, расположение митохондрий рядом с сократительными элементами, наличие включений гликогена, липидов и миоглобина.
Специальные сократительные органеллы – миофиламенты или миофибриллы обеспечивают сокращение, которое возникает при взаимодействии в них двух основных фибриллярных белков – актина и миозина при обязательном участии ионов кальция. Митохондрии обеспечивают эти процессы энергией. Запас источников энергии образуют гликоген и липиды. Миоглобин – белок, обеспечивающий связывание кислорода и создание его запаса на момент сокращения мышцы, когда сдавливаются кровеносные сосуды (поступление кислорода при этом резко падает).
Классификация . В основу классификации мышечных тканей положены два принципа – морфофункциональный и гистогенетический. В соответствии с морфофункциональным принципом, в зависимости от структуры органелл сокращения, мышечные ткани подразделяют на две подгруппы.
Первая подгруппа – поперечнополосатые (исчерченные) мышечные ткани (textus muscularis striatus). В цитоплазме их элементов миозиновые филаменты постоянно полимеризованы, образуют с актиновыми нитями постоянно существующие миофибриллы. Последние организованы в характерные комплексы – с а р к о м е р ы. В соседних миофибриллах структурные субъединицы саркомеров расположены на одинаковом уровне и создают поперечную исчерченность. Исчерченные мышечные ткани сокращаются быстрее, чем гладкие.
Вторая подгруппа – гладкие (неисчерченные) мышечные ткани (textus muscularis nonstriatus). Эти ткани характеризуются тем, что вне сокращения миозиновые филаменты деполимеризованы. В присутствии ионов кальция они полимеризуются и вступают во взаимодействие с филаментами актина. Образующиеся при этом миофибриллы не имеют поперечной исчерченности: при специальных окрасках они представлены равномерно окрашенными по всей длине (гладкими) нитями.
В соответствии с гистогенетическим принципом в зависимости от источников развития (эмбриональных зачатков) мышечные ткани подразделяются на 5 типов: мезенхимные (из десмального зачатка в составе мезенхимы), эпидермальные (из кожной эктодермы и из прехордальной пластинки), нейральные (из нервной трубки), целомические (из миоэпикардиальной пластинки висцерального листка сомита) и соматические (миотомные).
Первые три типа относятся к подгруппе гладких мышечных тканей, четвертый и пятый – к подгруппе поперечнополосатых.
Поперечнополосатые мышечные ткани
Имеется две основные разновидности поперечнополосатых (исчерченных) тканей – скелетная и сердечная.
Скелетная мышечная ткань
Гистогенез . Источником развития элементов скелетной (соматической) поперечнополосатой мышечной ткани (textus muscularis striatus sceletalis) являются клетки миотомов – миобласты . Одни из них дифференцируются на месте и участвуют в образовании так называемых аутохтонных мышц. Другие клетки мигрируют из миотомов в мезенхиму. Они уже детерминированы, хотя внешне не отличаются от других клеток мезенхимы. Их дифференцировка продолжается в местах закладки других мышц тела. В ходе дифференцировки возникают две клеточные линии. Клетки одной из линий сливаются, образуя удлиненные симпласты – мышечные трубочки (миотубы) . В них происходит дифференцировка специальных органелл – миофибрилл. В это время в миотубах отмечается хорошо развитая гранулярная эндоплазматическая сеть. Миофибриллы сначала располагаются под плазмолеммой, а затем заполняют большую часть миотубы. Ядра, напротив, из центральных отделов смещаются к периферии. Клеточные центры и микротрубочки при этом полностью исчезают. Гранулярная эндоплазматическая сеть редуцируется в значительной степени. Такие дефинитивные структуры называют миосимпластами.
Клетки другой линии остаются самостоятельными и дифференцируются в миосателлитоциты (миосателлиты). Эти клетки располагаются на поверхности миосимпластов.
Строение . Основной структурной единицей скелетной мышечной ткани является мышечное волокно, состоящее из миосимпласта и миосателлитоцитов, покрытых общей базальной мембраной (рис.1 I, II).
 |
Длина всего волокна может измеряться сантиметрами при толщине 50 – 100 мкм. Комплекс, состоящий из плазмолеммы миосимпласта и базальной мембраны, называют сарколеммой.
Строение миосимпласта . Миосимпласт имеет множество продолговатых ядер, расположенных непосредственно под сарколеммой. Их количество в одном симпласте может достигать нескольких десятков тысяч. У полюсов ядер располагаются органеллы общего значения – аппарат Гольджи и небольшие фрагменты гранулярной эндоплазматической сети. Миофибриллы заполняют основную часть миосимпласта и расположены продольно.
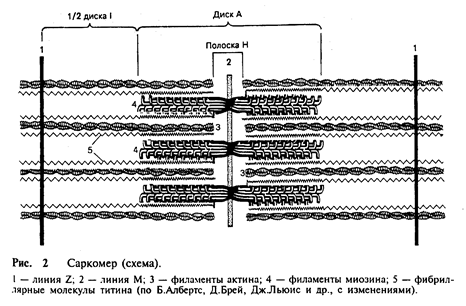 |
Саркомер – структурная единица миофибриллы. Каждая миофибрилла имеет поперечные темные и светлые диски, имеющие неодинаковое лучепреломление (анизотропные А-диски и изотропные I-диски). Каждая миофибрилла окружена продольно расположенными и анастомозирующими между собой петлями агранулярной эндоплазматической сети – саркоплазматической сети. Соседние саркомеры имеют общую пограничную структуру – Z-линию (рис. 2).
Она построена в виде сети из белковых фибриллярных молекул, среди которых существенную роль играет a-актинин. С этой сетью связаны концы актиновых филаментов. От соседних Z-линий актиновые филаменты направляются к центру саркомера, но не доходят до его середины. Филаменты актина объединены с Z-линией и нитями миозина фибриллярными нерастяжимыми молекулами небулина. Посередине темного диска саркомера располагается сеть, построенная из миомезина. Она образует в сечении М-линию. В узлах этой М-линии закреплены концы миозиновых филаментов. Другие их концы направляются в сторону Z-линий и располагаются между филаментами актина, но до самих Z-линий тоже не доходят. Вместе с тем эти концы фиксированы по отношению к Z-линиям растяжимыми гигантскими белковыми молекулами титина.
Молекулы миозина имеют длинный хвост и на одном из его концов две головки. При повышении концентрации ионов кальция в области присоединения головок (шарнирный участок) молекула изменяет свою конфигурацию. При этом (поскольку между миозиновыми филаментами расположены актиновые) головки миозина связываются с актином (при участии вспомогательных белков – тропомиозина и тропонина). Затем головка миозина наклоняется и тянет за собой актиновую молекулу в сторону М-линии. Z-линии сближаются, саркомер укорачивается.
Альфа-актининовые сети Z-линий соседних миофибрилл связаны друг с другом промежуточными филаментами. Они подходят к внутренней поверхности плазмолеммы и закрепляются в кортикальном слое цитоплазмы, так что саркомеры всех миофибрилл располагаются на одном уровне. Это и создает при наблюдении в микроскоп впечатление поперечной исчерченности всего волокна.
Типы мышечных волокон . Разные мышцы (как органы) функционируют в неодинаковых биомеханических условиях. Поэтому и мышечные волокна в составе разных мышц обладают разной силой, скоростью и длительностью сокращения, а также утомляемостью. Ферменты в них обладают разной активностью и представлены в различных изомерных формах. Заметно различие в них содержания дыхательных ферментов – гликолитических и окислительных.
По соотношению миофибрилл, митохондрий и миоглобина различают белые, красные и промежуточные волокна . По функциональным особенностям мышечные волокна подразделяют на быстрые, медленные и промежуточные . Наиболее заметно мышечные волокна различаются особенностями молекулярной организации миозина. Среди различных его изоформ существуют две основных – «быстрая» и «медленная». При постановке гистохимических реакций их различают по АТФазной активности. С этими свойствами коррелирует и активность дыхательных ферментов. Обычно в быстрых волокнах преобладают гликолитические процессы, они более богаты гликогеном, в них меньше миоглобина, поэтому их называют также белыми. В медленных волокнах, напротив, выше активность окислительных ферментов, они богаче миоглобином, выглядят более красными.
Если по активности АТФазы мышечные волокна различаются довольно резко, то степень активности дыхательных ферментов варьирует весьма значительно, поэтому наряду с белыми и красными существуют и промежуточные волокна. В мышечной ткани разные волокна часто расположены мозаично.
Сердечная мышечная ткань
Гистогенез и виды клеток . Источники развития сердечной поперечнополосатой мышечной ткани (textus muscularis striatus cardiacus) – симметричные участки висцерального листка спланхнотома в шейной части зародыша – миоэпикардиальные пластинки . Из них дифференцируются также клетки мезотелия эпикарда. В ходе гистогенеза возникает 5 видов кардиомиоцитов – рабочие (сократительные), синусные (пейсмекерные), переходные, проводящие, а также секреторные.
Рабочие (сократительные) кардиомиоциты образуют свои цепочки. Именно они, укорачиваясь, обеспечивают силу сокращения всей сердечной мышцы. Рабочие кардиомиоциты способны передавать управляющие сигналы друг другу. Синусные (пейсмекерные) кардиомиоциты способны автоматически в определенном ритме сменять состояние сокращения на состояние расслабления. Именно они воспринимают управляющие сигналы от нервных волокон, в ответ, на что изменяют ритм сократительной деятельности. Синусные (пейсмекерные) кардиомиоциты передают управляющие сигналы переходным кардиомиоцитам, а последние – проводящим. Проводящие кардиомиоциты образуют цепочки клеток, соединенных своими концами. Первая клетка в цепочке воспринимает управляющие сигналы от синусных кардиомиоцитов и передает их далее – другим проводящим кардиомиоцитам. Клетки, замыкающие цепочку, передают сигнал через переходные кардиомиоциты рабочим. Секреторные кардиомиоциты выполняют особую функцию. Они вырабатывают натрийуретический фактор (гормон), участвующий в процессах регуляции мочеобразования и в некоторых других процессах. Все кардиомиоциты покрыты базальной мембраной.
Гладкие мышечные ткани
Различают три группы гладких (неисчерченных) мышечных тканей (textus muscularis nonstriatus) – мезенхимные, эпидермальные и нейральные .
Мышечная ткань мезенхимного происхождения
Гистогенез . Стволовые клетки и клетки-предшественники в гладкой мышечной ткани на этапах эмбрионального развития пока точно не отождествлены. По-видимому, они родственны механоцитам тканей внутренней среды. Вероятно, в мезенхиме они мигрируют к местам закладки органов, будучи уже детерминированными. Дифференцируясь, они синтезируют компоненты матрикса и коллагена базальной мембраны, а также эластина. У дефинитивных клеток (миоцитов) синтетическая способность снижена, но не исчезает полностью.
Строение клеток . Гладкий миоцит – веретеновидная клетка длиной 20 – 500 мкм, шириной 5 – 8 мкм (рис.3).
 Ядро палочковидное, находится в ее центральной части. Когда миоцит сокращается, его ядро изгибается и даже закручивается. Органеллы общего значения, среди которых много митохондрий, сосредоточены около полюсов ядра (в эндоплазме). Аппарат Гольджи и гранулярная эндоплазматическая сеть развиты слабо, что свидетельствует о малой активности синтетических функций. Рибосомы в большинстве своем расположены свободно.
Ядро палочковидное, находится в ее центральной части. Когда миоцит сокращается, его ядро изгибается и даже закручивается. Органеллы общего значения, среди которых много митохондрий, сосредоточены около полюсов ядра (в эндоплазме). Аппарат Гольджи и гранулярная эндоплазматическая сеть развиты слабо, что свидетельствует о малой активности синтетических функций. Рибосомы в большинстве своем расположены свободно.
 Мышечная ткань мезенхимного типа в составе органов
Мышечная ткань мезенхимного типа в составе органов
Миоциты объединяются в пучки, между которыми располагаются тонкие прослойки соединительной ткани. В эти прослойки вплетаются ретикулярные и эластические волокна, окружающие миоциты. В прослойках проходят кровеносные сосуды и нервные волокна. Терминали последних оканчиваются не непосредственно на миоцитах, а между ними. Поэтому после поступления нервного импульса медиатор распространяется диффузно, возбуждая сразу многие клетки. Гладкая мышечная ткань мезенхимного происхождения представлена главным образом в стенках кровеносных сосудов и многих трубчатых внутренних органов, а также образует отдельные мелкие мышцы (цилиарные).
Гладкая мышечная ткань в составе конкретных органов имеет неодинаковые функциональные свойства. Это обусловлено тем, что на поверхности органов имеются разные рецепторы к конкретным биологически активным веществам. Поэтому и на многие лекарственные препараты их реакция неодинакова. Возможно, разные функциональные свойства тканей связаны и с конкретной молекулярной организацией актиновых филаментов.
Мышечная ткань эпидермального происхождения
 |
Миоэпителиальные клетки развиваются из эпидермального зачатка.
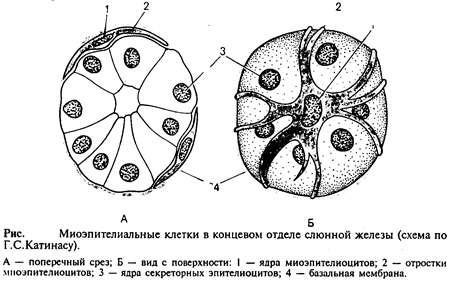
Они встречаются в потовых, молочных, слюнных и слезных железах и имеют общих предшественников с их секреторными клетками. Миоэпителиальные клетки непосредственно прилежат к собственно эпителиальным и имеют общую с ними базальную мембрану. При регенерации те и другие клетки тоже восстанавливаются из общих малодифференцированных предшественников. Большинство миоэпителиальных клеток имеют звездчатую форму. Эти клетки нередко называют корзинчатыми: их отростки охватывают концевые отделы и мелкие протоки желез (рис.4). В теле клетки располагаются ядро и органеллы общего значения, а в отростках – сократительный аппарат, организованный, как и в клетках мышечной ткани мезенхимного типа.
Мышечная ткань нейрального происхождения
Миоциты этой ткани развиваются из клеток нейрального зачатка в составе внутренней стенки глазного бокала. Тела этих клеток располагаются в эпителии задней поверхности радужки. Каждая из них имеет отросток, который направляется в толщу радужки и ложится параллельно ее поверхности. В отростке находится сократительный аппарат, организованный так же, как и во всех гладких миоцитах. В зависимости от направления отростков (перпендикулярно или параллельно краю зрачка) миоциты образуют две мышцы – суживающую и расширяющую зрачок.
Сокращение мышц
Теория скольжения нитей
Н.Е. Huxley и A.F. Huxley независимо друг от другав 1954 г. предложили для объяснения механизма мышечного сокращения теорию скольжения нитей. Согласно данной теории, укорочение саркомера, а, следовательно, и мышечного волокна в момент сокращения происходит благодаря активному скольжению тонких (актиновых) нитей относительно толстых (миозиновых) нитей. Укорочение заканчивается, когда актиновые филаменты глубоко втягиваются по направлению к центру диска, который определяет границы саркомеров. При расслаблении или растяжении мышцы область взаимного перекрывания тонких и толстых филаментов сужается.
Скользящее движение миозиновых и актиновых филаментов друг относительно друга обусловлено силами, генерируемыми при взаимодействии поперечных мостиков с актиновыми филаментами.
Поперечные мостики должны последовательно прикрепиться к актиновому филаменту, развить силу, отойти и вновь прикрепиться в другом месте. Для того чтобы поддерживать активное сокращение, поперечные мостики должны работать асинхронно, т.е. в любой момент времени часть из них прикреплена к актину, тогда как другие отсоединены. После отсоединения поперечный мостик должен вновь прикрепиться к актиновому филаменту, но уже дальше, в сторону Z-пластинок, внося тем самым вклад в активное скольжение вдоль указанного направления.
Один из основных вопросов по поводу функционирования поперечных мостиков относится к преобразованию химической энергии в механическую. Как же все-таки поперечные мостики генерируют силу для скольжения толстых и тонких филаментов друг относительно друга? По этому поводу высказан ряд гипотез. Широкое распространение получила точка зрения, что сила генерируется за счет колебания или вращения миозиновой головки и затем передается на толстую нить через шейку молекулы миозина. Шейка образует мостиковый шарнир, расположенный между головкой миозиновой молекулы и толстым филаментом. В данной гипотезе мостиковый шарнир выступает как соединение между головкой миозина и толстым филаментом, которое передает силу, развиваемую при вращении головки на актиновом филаменте.
Исследования механических свойств сокращающейся мышцы, проведенные Хаксли и Симмонсом, подтвердили такую точку зрения на функцию поперечных мостиков. Авторы показали, что основная часть упругого компонента мышцы, включенная последовательно с сократительным элементом, находится в самих поперечных мостиках, предположительно в мостиковом шарнире. Они высказали мысль, что упругое растяжение шарнира служит важным моментом в процессе запасания механической энергии при вращении головки миозина вокруг актинового филамента. В соответствии с данной гипотезой вращение генерируется несколькими центрами миозиновой головки, которые поочередно взаимодействуют с центрами на актиновом филаменте.
Упругость мостикового шарнира способствует вращению головки без заметных скачкообразных колебаний развиваемой силы. Растянувшись, мостиковый шарнир будет передавать свое усилие толстому филаменту мягко, содействуя активации скольжения филаментов. Один из главных аргументов-это то, что, по данным Хаксли и Симмонса, последовательно соединенный упругий компонент мышечного волокна пропорционален величине взаимного перекрывания тонких и толстых филаментов, а следовательно, пропорционален числу присоединенных поперечных мостиков. Авторы также установили, что внезапно возникающее небольшое укорочение сопровождается очень быстрым возрастанием развиваемого усилия; они объясняют это лишь поворотом головок поперечных мостиков, взаимодействующих с актином, в более стабильное положение.
Роль кальция в процессе сокращения
Данные о роли ионов кальция в сократительной активности мышц накапливались довольно медленно. Кальций активен в саркоплазме при такой низкой (10-6 М и менее) концентрации, что до открытия кальцийхелатных реагентов, например ЭДТА и ЭГТА, ее невозможно было поддерживать в экспериментальных растворах. Дело в том, что даже в бидистиллированной воде концентрация ионов кальция превышает 10-6 М. Самые первые доказательства физиологической роли Са2+ представлены в работах Рингера и Бакстона. Авторы обнаружили, что изолированное сердце лягушки прекращает сокращения при отсутствии кальция в омывающем растворе. Так появились раствор Рингера и другие физиологические солевые растворы.
Камада и Киносита, а затем Хейлбрун и Вертинский проверяли участие Са2+ в регуляции мышечного сокращения путем введения разных катионов внутрь мышечных волокон. Из всех изученных ионов только кальций вызывал сокращение при концентрациях, соизмеримых с концентрациями Са2+ обычно наблюдаемыми в живой ткани. Впоследствии было обнаружено, что скелетная мышца не сокращается в ответ на деполяризацию мембраны, если исчерпаны запасы кальция во внутренних депо, а подвергнутые предварительной экстракции препараты волокон скелетной мышцы не сокращаются при добавлении АТФ, если отсутствует Са2+ .
Количественная зависимость между концентрацией свободного Са2+ в саркоплазме и силой мышечного сокращения была установлена сравнительно недавно. Для проведения анализа удаляли поверхностную мембрану и оголенные миофибриллы обрабатывали растворами кальция различной концентрации. Сила возрастает от нуля при концентрации кальция около 10-8 М до максимального значения при концентрации кальция около 5х10-6 М. Данная зависимость между силой и концентрацией Са2+ аналогична зависимости между АТФазной активностью (скоростью гидролиза АТФ) гомогенизированных миофибрилл и концентрацией Са2+ . Такое совпадение характеристик наводило на мысль, что Са2+ служит кофактором АТФазной активности миозина. Но оказалось, что это не так.
АТФазная активность чистого раствора миозина довольно низкая, но сильно возрастает при добавлении очищенного актина. Это указывает на то, что АТФазный центр миозина активируется при связывании миозина с актином. В интактной мышце активация АТФазного центра миозина осуществляется при присоединении поперечного мостика к активному филаменту. Эксперименты, проведенные в лаборатории Эбаши, показали, что тропонин и тропомиозин, лежащие вдоль актиновой спирали, препятствуют присоединению миозиновых поперечных мостиков к актину. Тропонин – единственный белок в актиновых и миозиновых филаментах поперечнополосатых мышц позвоночных животных, имеющий высокое химическое сродство к Са2+
. Каждый тропониновый комплекс связывает четыре иона кальция. Тропониновые комплексы расположены вдоль актинового филамента через каждые 40 нм, прикрепляясь одновременно к актиновому
8-09-2015, 20:42
