Сказанное выше объясняет роль Са2+ в регуляции актин-миозинового взаимодействия в скелетных и сердечной мышце позвоночных животных. В большинстве других мышц роль кальция иная. Есть еще по крайней мере два механизма кальцийзависимой регуляции актин-миозинового взаимодействия. В поперечнополосатых мышцах большинства беспозвоночных животных кальций инициирует сокращение, присоединяясь к легким полипептидным цепям миозина в головках поперечных мостиков. В гладких мышцах позвоночных животных и в немышечном актомиозине сокращение контролируется кальцийзависимым фосфорилированием миозиновой головки.
Инактивация поперечных мостиков и расслабление мышцы
В мышце, находящейся в состоянии покоя, внутренняя система ограниченных мембранами компартментов, называемая саркоплазматическим ретикулумом , активно поглощает Са2+ . Благодаря этому процессу уровень свободных ионов кальция не поднимается выше 10-7 М. При такой концентрации поперечные мостики неактивны, потому что с тропонином связывается лишь очень небольшое количество кальция. Таким образом, удаление Са2+ из саркоплазмы в ретикулуме заставляет мышцу расслабляться после сокращения.
Поскольку АТФ поставляет энергию для сокращения, напрашивается вывод, что удаление АТФ тоже вызовет расслабление мышцы. Но оказалось, что этого не происходит.
Мышца становится напряженной и не поддается растяжению при исчерпании всех ее запасов АТФ и фосфагенов. Это состояние известно как трупное окоченение , и обусловлено оно тем, что поперечные мостики не могут отделиться от актиновых филаментов. О том, что для расслабления мышцы нужен Мg2 + -АТФ, известно со времени проведения первых экспериментов с экстрагированными глицерином препаратами мышц. В присутствии Са2+ и Мg2 + -АТФ глицеринизированная мышца сокращается, а при удалении Са2+ – расслабляется. Расслабление, как и сокращение, происходит только в присутствии Мg2 + -АТФ. В нормальных условиях, когда мышца обеспечена АТФ, мостики легко отделяются. Затем, если концентрация свободного саркоплазматического Са2+ становится ниже уровня, необходимого для процесса присоединения поперечных мостиков к актиновым филаментам, мышца расслабляется.
Итак, расслабление мышцы зависит от наличия Мg2 + -АТФ, необходимого для разрушения актомиозинового комплекса, и от внутриклеточной концентрации кальция, которая должна быть достаточно низкой для предотвращения нового прикрепления мостиков к актиновым филаментам.
Саркоплазматический ретикулум
С чего начинается поступление Са2+ в СР? Если мембраны СР выделить с помощью фракционирования, они образуют микроскопические везикулы диаметром 1 мкм. Везикулы способны поглощать кальций из окружающей среды. Если к ним добавить щавелевую кислоту, то внутри везикул по мере увеличения в них концентрации Са2+ будет осаждаться оксалат кальция. Это говорит об активном транспорте кальция мембраной ретикулума. В нефракционированной мышечной ткани осадок оксалата кальция можно обнаружить с помощью электронного микроскопа в терминальных цистернах. Способность СР к накоплению кальция довольно высокая, что обеспечивает поддержание концентрации свободного Са2+ в саркоплазме расслабленной мышцы ниже 10-7 М. Этот уровень Са2+ достаточен для разрушения связи кальция с тропонином и предотвращения сокращения. Способность СР поглощать Са2+ из миоплазмы зависит от активности молекул кальциевого насоса. На электронных микрофотографиях, полученных методом замораживания-скалывания, молекулы насоса плотно прижаты («плечом к плечу») в мембранах, формирующих продольные элементы СР. Как и в других активных транспортных системах, в качестве источника энергии кальциевый насос СР использует АТФ.
Высвобождение кальция саркоплазматическим ретикулумом
Как только стало известно, что в СР накапливаются ионы кальция, исследователи начали склоняться к мысли о том, что мышечное сокращение инициируется Са2+ , высвобождаемым в саркоплазму из внутренней среды цистерн СР.
Сокращение активируется кальцием, высвобожденным из СР, а поверхностный электрический сигнал, т.е. ПД, поступает в глубокие области мышечного волокна с помощью Т-трубочек. Более того, Т-трубочки образуют тесные контакты с концевыми цистернами саркоплазматического ретикулума. Но как электрический сигнал из Т-трубочек передается в СР, давая команду к высвобождению Са2+ в ответ на деполяризацию Т-трубочки, долгое время оставалось загадкой. Сейчас, кажется, на этот важный вопрос можно ответить. Очевидно, что при деполяризации Т-трубочек сигнал доставляется к концевым цистернам СР посредством внутриклеточных молекул-посредников. Недавние исследования, проведенные в Калифорнийском университете, показали, что высвобождение Са2+ из СР и последующее сокращение одиночного поперечного волокна могут индуцироваться инозитол-1,4,5- трифосфатом (ИФ3 ). Это внутриклеточная молекула-посредник, образующаяся при разложении связанного с мембраной фосфатидилинозитола, которая, как известно, стимулирует высвобождение Са2+ из внутриклеточных хранилищ в некоторых тканях. В отношении мышц есть сведения, что вещества, блокирующие образование ИФ3 , нарушают сопряжение процессов сокращения волокна и деполяризации мембран. Показано, что такими вещества мешают нормальному высвобождению Са2+ из СР в ответ на электрическое возбуждение мышцы. И наконец, вещества, блокирующие ферментативное разложение ИФ3 , напротив, усиливают эффективность ИФ3 , в инициации сокращения мышечного волокна. Такого рода данные послужили поводом для возникновения гипотезы, утверждающей, что деполяризация Т-трубочек вызывает образование ИФ3 , а уже затем ИФ3 , действует как внутриклеточный посредник, индуцирующий
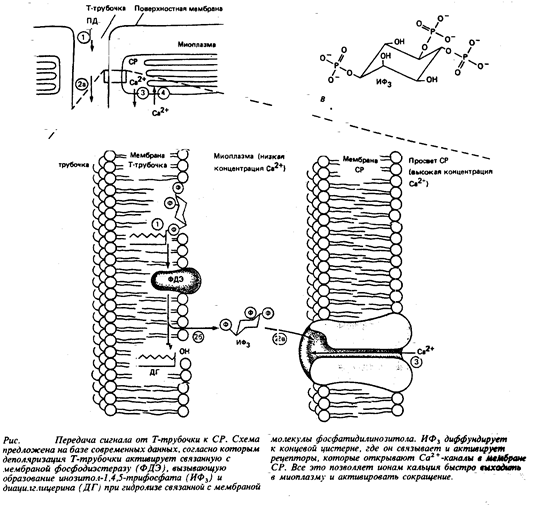 |
высвобождение Са2+ из СР (рис.5).
Согласно этой гипотезе, начальная стадия сопряжения процесса «возбуждение – сокращение» сопровождается распространением возбуждения по поверхности системы Т-трубочек и представляет собой активацию чувствительных к электрическому напряжению ферментов, расположенных на мембране данных трубочек рядом с концевыми цистернами СР. Эти гипотетические ферменты, по-видимому, столь же чувствительны к изменению электрического поля мембраны, как натриевый канал, и реагируют на это изменение конформационным сдвигом. Вызванный деполяризацией мембраны конформационный сдвиг переводит фермент из неактивной формы в активную. И уже этот активный фермент прямо или косвенно определяет образование ИФ3 . Затем ИФ3 диффундирует на короткое расстояние и достигает мембраны концевой цистерны СР, где, связавшись с рецептором, заставляет открываться кальциевые каналы. Ионы кальция, скопившиеся в относительно высокой концентрации в просвете СР, продолжают выходить наружу до тех пор, пока не произойдет ферментативное разрушение ИФ3 и каналы не закроются. Потом с помощью активного транспорта высвобожденные из СР ионы кальция возвращаются на прежнее место.
Краткое описание процессов сокращения и расслабления
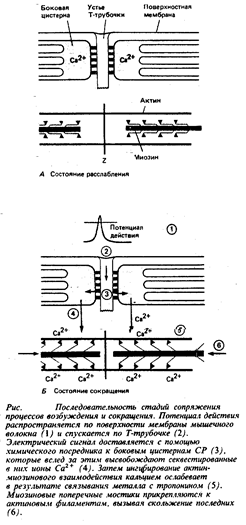 Процессы, контролирующие сокращение скелетной мышцы, изображены в общем виде на рис.6. Приведем их перечень.
Процессы, контролирующие сокращение скелетной мышцы, изображены в общем виде на рис.6. Приведем их перечень.
1. Поверхностная мембрана мышечного волокна деполяризуется под влиянием потенциала действия или (в некоторых мышцах) под влиянием синаптических потенциалов.
2. Потенциал действия поступает в глубь мышечного волокна по Т-трубочкам.
3. В ответ на деполяризацию Т-трубочек сигнал, который, вероятно, опосредуется молекулами ИФ3, распространяется от этих трубочек к концевым цистернам саркоплазматического ретикулума.
4. Этот химический посредник вызывает открытие кальциевых каналов в СР и высвобождение секвестированных там ионов кальция.
5. Концентрация свободного Са2+ в миоплазме возрастает от значения 10-7 М и ниже (в покое) до приблизительно 10-6 М и более (в активном состоянии). Кальций соединяется с тропонином, вызывая в молекуле этого белка конформационные изменения.
6. Конформационные изменения молекулы тропомиозина устраняют пространственное препятствие для присоединения поперечных мостиков к актиновым филаментам.
7. Миозиновые поперечные мостики прикрепляются к актиновым филаментам и вступают в последовательное взаимодействие с их центрами, что вызывает вращение миозиновой головки относительно актиновых филаментов и натяжение мостикового шарнира.
8. Натяжение мостикового шарнира приводит к активному вхождению актиновых филаментов в А-диск. Саркомер слегка укорачивается.
9. Прежде чем произойдет следующий цикл движения миозинового поперечного мостика, АТФ (связанная с АТФазным центром на миозиновой головке) гидролизуется и освобожденная при этом энергия запасается в виде конформационного изменения в молекуле миозина. Миозиновая головка отходит и затем вновь готова присоединиться к следующему центру, расположенному по длине актинового филамента, и повторить цикл, описанный в пп. 7 и 8. Во время одиночного сокращения каждый поперечный мостик по мере своего продвижения к Z-пластинке вдоль актинового филамента прикрепляется, подтягивается и отсоединяется множество раз.
10. Наконец, в результате активной работы СР уровень Са2+ в саркоплазме снова понижается, и тропомиозин начинает препятствовать присоединению поперечных мостиков. Мышца остается расслабленной до тех пор, пока не произойдет следующая деполяризации мембраны.
Между структурой саркотубулярной системы и функцией мышцы существует интересная связь. Те мышцы, которые сокращаются и расслабляются очень быстро, имеют высокоразвитый СР и обширную сеть Т-трубочек. А те мышцы, сокращение и расслабление которых происходит медленно, соответственно имеют менее развитый СР. Различные скорости сокращения и расслабления, по-видимому, коррелируют с эффективностью СР в регуляции изменений концентрации кальция, которые в свою очередь запускают и останавливают сократительный механизм.
Заключение
Как уже было отмечено, мышечные ткани – это группа тканей организма различного происхождения, объединяемых по признаку сократимости: поперечнополосатая (скелетная и сердечная), гладкая, а также специализированные сократимые ткани – эпителиально-мышечная и нейроглиальная, входящая в состав радужки глаза.
Поперечнополосатая скелетная мышечная ткань возникает из миотомов, входящих в состав элементов сегментированной мезодермы – сомитов.
Гладкая мышечная ткань человека и позвоночных животных развивается в составе производных мезенхимы, так же как и ткани внутренней среды. Однако для всех мышечных тканей характерно сходное обособление в составе эмбрионального зачатка в виде клеток веретенообразной формы – мышцеобразовательных клеток, или миобластов.
Сокращение мышечного волокна заключается в укорочении миофибрилл в пределах каждого саркомера. Толстые (миозиновые) и тонкие (актиновые) нити, в расслабленном состоянии связанные только концевыми отделами, в момент сокращения осуществляют скользящие движения навстречу друг другу. Выделение необходимой для сокращения энергии происходит в результате превращения АТФ в АДФ под влиянием миозина. Ферментная активность миозина проявляется при условии оптимального содержания Са2+ , которые накапливаются в саркоплазматической сети.
Список литературы
1. Гистология. Под редакцией Ю.И. Афанасьевой, Н.А. Юриной. М.: «Медицина», 1999 г.
2. Р. Эккерт, Д. Рендел, Дж. Огастин «Физиология животных» – 1 т. М.: «Мир», 1981 г.
3. К.П. Рябов «Гистология с основами эмбриологии» Минск: «Высшая школа», 1990 г.
4. Гистология. Под редакцией Улумбекова, проф. Ю.А. Челышева. М.: 1998 г.
5. Гистология. Под редакцией В.Г. Елисеева. М.: «Медицина», 1983 г.
8-09-2015, 20:42
