МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ'Я УКРАЇНИ
ЛУБЕНСЬКЕ МЕДИЧНЕ УЧИЛИЩЕ
Реферат
З педіатрії
На тему: Дефіцитні анемії. Хронічні розлади харчування в дітей раннього віку
Виконала: студентка групи Ф-31
Горбань Світлана
Лубни 2009
1. Дефіцитні анемії
1.1 Особливості розвитку залізодефіцитної анемії
Залізодефіцитна анемія (сидеропенічна) — це різновид анемій, причиною яких є дефіцит заліза в організмі, пов'язаний з недостатнім його Надходженням чи засвоєнням або надмірним виведенням. Це розвивається внаслідок недостатньої закладки запасів заліза в антенатальний період, неадекватного споживання заліза, низької його біодоступ-Ності, недостатнього вмісту в їжі, збільшеної потреби в залізі або хронічної крововтрати. Захворювання дуже поширене в дитячій Популяції і є найчастішою формою серед усіх анемій дитячого віку. Ва даними ВООЗ (1971), дефіцит заліза є у 20 % населення планети. Серед дітей поширеність дефіциту заліза становить від 17,5 % у школярів до 50 % у дітей раннього віку. Однак актуальність проблеми залізодефіцитної анемії пояснюється не тільки поширеністю цього захворювання, а й вираженими патологічними змінами, що відбуваються в зростаючому організмі. Зниження активності низки залізовмісних ферментних систем (цитохромів, каталази, пероксидази тощо) призводить до порушення клітинного й тканинного метаболізму. Це зумовлює зниження темпів синтезу гемоглобіну і зменшення насичення ним еритроцитів. Зниження концентрації гемоглобіну ініціює розвиток анемічної гіпоксії, що у свою чергу збільшує наявні в організмі Метаболічні зміни та трофічні порушення.
Метаболізм заліза в організмі. У фізіологічних умовах залізо надходить в організм тільки з їжею. Кількість засвоюваного організмом мліза залежить від вмісту і валентності заліза в харчовому продукті, Якісної характеристики продукту і стану травного тракту пацієнта. Найбільшу кількість заліза організм отримує при вживанні в їжу м'яс-1ИХ продуктів. Це пояснюється значно більшою ефективністю абсорбції гемового заліза в кишечнику порівняно з іншими сполуками харчового заліза. Біодоступність двовалентного заліза порівняно з тривалент ним значно вища. Швидкість поглинання заліза в травному тракті залежить і від білкового складу їжі. На рівень кишкової абсорбції заліза впливають як загальна кількість харчового білка, так і його якісний склад. Транспорт заліза в організмі здійснюється трансферином. Цей білок переносить залізо з травного тракту до еритрокаріоцитів кісткового мозку, у тканинні депо. Також трансферин здійснює зворотний транспорт заліза в кістковий мозок з депо і макрофагів, де відбувається реутилізація заліза із природно зруйнованих еритроцитів.

1.2 Причини дефіциту заліза в організмі
1.Антенатальні причини:
плацентарна недостатність (гестози, загроза переривання вагіт ності, гіпоксія плода);
багатоплідна вагітність;
недоношеність;
велика маса тіла новонародженої дитини;
глибокий і тривалий залізодефіцитний стан у вагітної (анемія вагітних середнього і тяжкого ступеня);
хронічна інтоксикація плода (систематичне куріння, алкоголізм, наркоманія матері, зловживання лікарськими засобами, робота з токсичними речовинами);
багаторазові вагітності (перерви між вагітностями менше ніж 1,5—2 роки).
2.Інтранатальні причини:
фетоплацентарна трансфузія;
передчасне перев'язування пуповини;
травматизація судин чи пуповини плода під час надання акушерської допомоги.
3.Постнатальні причини:
штучне вигодовування з використанням неадаптованих сумішей |
надлишкове вживання коров'ячого і козиного молока (одноманітне молочне харчування);
вегетаріанський раціон харчування в дитячому віці;
одноманітне харчування;
![]() лімфатико-гіпопластичний тип конституції (підвищена схильність за наявності факторів ризику);
лімфатико-гіпопластичний тип конституції (підвищена схильність за наявності факторів ризику);
синдром мальабсорбції (спадковий і набутий);
приймання медикаментів і продуктів харчування, що порушують метаболізм заліза в організмі;
тривалі чи хронічні соматичні захворювання;
спадкові захворювання обміну речовин;
алергія до харчових продуктів (особливо до коров'ячого молока);
голодування.
1.3 Основні клінічні та лабораторні прояви лалізодефіцитної анемії
Найхарактернішими клінічними ознаками залізодефіцитної анемії в сидеропенічний синдром (блідість шкіри та слизових оболонок, ангулярний стоматит, сухість шкіри, сухість і ламкість волосся тощо), синдром вегетативної дисфункції (тахікардія, тенденція до артеріальної гіпотензії, задишка, ослаблення тонів серця, підвищена пітливість); симптоми, пов'язані з дефіцитом заліза (підвищена стомлюваність, дратівливість, порушення сну як прояви хронічної гіпоксії, ояиаки вторинної імунної недостатності). Серед лабораторних ознак Характерні морфологічні зміни еритроцитів у вигляді анізоцитозу і Ііойкілоцитозу. Надалі при вираженому дефіциті гемоглобіну відбувається зниження абсолютної кількості еритроцитів. Нижньою межею Норми еритроцитів у дітей молодших 6-річного віку є 3,6 • 1012/л, старших 6-річного віку — 4,0 • 1012/л. Кольоровий показник, який характеризує відносний вміст гемоглобіну в еритроцитах, нижчий від 0,8, f Обто ця анемія є гіпохромною. Показники анемії залізо дефіцит ного иврактеру: рівень сироваткового заліза менший ніж 10 мкмоль/л (у Нормі 10,6—33,5 мкмоль/л), коефіцієнт насичення трансферину за-Лівом менший ніж 17 % (у нормі 20—50 %), рівень феритину сироватки менший ніж 12 мкг/л (у нормі 32—68 мкг/л), протопорфірину більший ніж 600 мкг/л (у нормі 200—400 мкг/л), загальна залізозв'я-іуюча властивість сироватки перевищує 63 мкмоль/л (у нормі 45— 12 мкмоль/л), латентна залізозв'язуюча властивість сироватки більша НІЖ 47 мкмоль/л, вміст сидеробластів у мієлограмі менший ніж 10 % (у нормі 20—30 %). Однією з давніх орієнтовних ознак наявності дефіциту заліза є бітурія: при вживанні червоного буряка з'являється ро-Швве забарвлення сечі. Це пов'язано з дефіцитом залізовмісних ферментів, що знебарвлюють харчовий барвник буряка. Тест діагностує дефіцит заліза в організмі, але не рівень гемоглобіну в еритроцитах.
1.4 Принципи терапії залізодефіцитної анемії
Принципи терапії залізодефіцитної анемії такі: 1. Відновити дефіцит заліза без лікарських залізовмісних препаратів неможливо.
Терапію залізодефіцитних станів потрібно проводити переваж но препаратами заліза для перорального вживання.
Терапію залізодефіцитної анемії не потрібно припиняти після нормалізації рівня гемоглобіну.
Гемотрансфузії (введення еритроцитарної маси) слід проводити тільки за суворими показаннями.
Лікування залізодефіцитної анемії полягає в раціональному харчуванні відповідно до віку дитини, прийманні препаратів заліза і нормалізації режиму праці та відпочинку.
Приймання препаратів заліза проводиться тривало і поділяється на два періоди: основний та підтримувальний. Основний курс пероральни-ми препаратами завжди починають із пробної дози для визначення індивідуальної толерантності організму до заліза. Тривалість основного курсу визначається за часом нормалізації рівня гемоглобіну. При успішному лікуванні цей показник приходить до норми протягом 1—1,5 міс, після чого переходять на підтримувальну терапію препаратами заліза протягом 2—3 міс. Задачею підтримувального курсу є заповнення депо заліза. Занадто раннє припинення лікування переводить захворювання у фазу латентного дефіциту заліза, коли за несприятливих умов (недостатнє харчування, захворювання) знову виникає анемія.
Протипоказання для перорального застосування препаратів залі за: гострі та хронічні кишкові інфекції; первинний і вторинний синдром мальабсорбції; виразкові процеси в травному тракті.
Дітям, які перенесли дисбактеріоз кишечнику, кишкові інфекції, оперативні втручання на органах травного тракту, разом із препара тами заліза необхідно призначати еубіотики. Дітям з доліхосигмою, хворобою Гіршпрунга для профілактики закрепів необхідно призначати препарати лактулози (дуфалак). Практично всім дітям раннього віку на фоні феротерапії з профілактичною метою доцільно признача ти пробіотик хілак, який сприяє кращому всмоктуванню заліза і запобігає порушенням з боку травного тракту.
Слід зазначити, що повноцінна дієта з підвищеним вмістом заліза може забезпечити фізіологічну потребу організму, але не усунути дефіцит заліза.
Найкраще засвоюється гемове залізо, що міститься в продуктах тваринного походження. У продуктах рослинного походження міститься негемове залізо, біодоступність якого значно нижча, ніж у продуктах тваринного походження. Тому, незважаючи на те, що рос линні продукти містять більшу кількість заліза в абсолютних цифрах, вони не можуть забезпечити потреб організму повною мірою. З продуктів тваринного походження залізо найкраще засвоюється з м'яса кроля, індика, курки і яловичини.
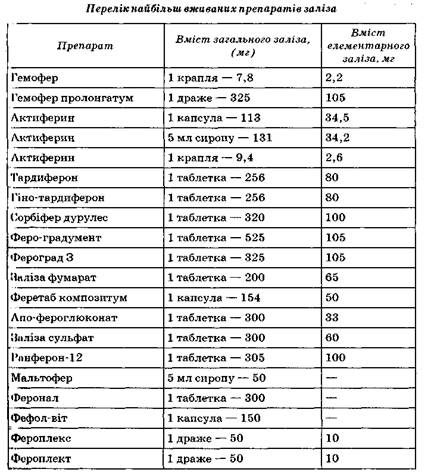

* Вміст загального заліза не вказується.
Всмоктування харчового заліза значно посилюється при підвищенні вмісту загального білка і вітаміну С у раціоні. Сповільнює всмоктування заліза приймання великої кількості сиру і молока, борошняних виробів, горіхів, міцного чаю, кави. Знижує засвоєння заліза з продуктів харчування вживання великої кількості соєвих продуктів. Нині є достатня кількість препаратів заліза, як для приймання всередину, так і для парентерального введення. Активність засвоєння і Метаболізм тривалентного заліза значно нижчі, ніж двовалентного. Крім того, на всмоктування солей тривалентного заліза значно вилиняє сталість кислотності шлунка. Найкращий ступінь засвоєння при пероральному прийманні має сульфат заліза. За ступенем усмоктування в травному тракті солі двовалентного заліза можна розташувати за порядком зниження: сульфат > глюконат > хлорид > фумарат.
Лікування залізодефіцитних анемій потрібно проводити переважно пероральними засобами. Препарати заліза призначають перораль но за ЗО—60 хв до їди чи через 2 год після їди. Розрахунок дози препарату заліза необхідно проводити за елементарним залізом. Курсова доза при пероральній терапії залізодефіцитної анемії не розраховуєть ся. Середні добові дози для пероральних препаратів (за елементарним залізом) становлять:
—дітям віком до 3 років — із розрахунку 5—8 мг на 1 кг маси тіла на добу;
—від 3 до 7 років — 100—120 мг на добу;
—понад 7 років — до 200 мг на добу.
Будь-яке призначення препаратів заліза необхідно починати з пробної дози, рівної 1/4—1/2 від розрахованої, особливо в дітей раннього віку. Середня тривалість призначення пробної дози при перорально му прийманні становить 1—2 тиж.
Застосування препаратів заліза для парентерального введення показане лише за спеціальними показаннями: при неможливості пер-орального приймання; синдромі мальабсорбції; хронічному ентероколіті; виразковій хворобі шлунка і дванадцятипалої кишки в стадії загострення; виразково-некротичному ентероколіті; спадкових за хворюваннях з порушенням всмоктування заліза в травному тракті; стані після резекції шлунка, тонкої кишки.
1.5 Особливості інших дефіцитних анемій
Основними причинами вітамінодефіцитних анемій є такі: дефіцит фолієвої кислоти та вітаміну В12, що порушує синтез амінокислот і попередників ДНК, сповільнює дозрівання всіх клітин крові в кістковому мозку, повернення до мегалобластного типу кровотворення. Роз витку дефіциту фолієвої кислоти та вітаміну В12 сприяють недоношеність дитини, хронічні захворювання кишечнику, дисбактеріо.ч![]() кишечнику, гельмінтози, ферментопатії, вегетаріанство, вживання протисудомних препаратів, а також вигодовування козиним молоком.
кишечнику, гельмінтози, ферментопатії, вегетаріанство, вживання протисудомних препаратів, а також вигодовування козиним молоком.
Клінічні прояви: астеноневротичний синдром (загальна слабкість, астенізація, парестезія); блідість шкіри з лимонно-жовтим відтінком, оубіктеричність склер; «лаковий» язик, глосит, стоматит, атрофічний гастрит; порушення функції серцево-судинної системи; диспепсичні розлади; помірна гепатомегалія; з боку нервової системи — ознаки фу-нікулярного мієлозу (атонія м'язів, відчуття «повзання мурашок», «ватних ніг», оніміння, гіперестезії тощо).
Гематологічна діагностика вітамінодефіцитної анемії: анемія гіпер-пбо нормохромна, макроцитарна, гіпорегенераторна, анізо-, пойкілоци-тоз, мегалобластоз, піизоцитоз, наявність тілець Жоллі і Кебота в еритроцитах; гігантські нейтрофіли з полісегментарністю і метамієлоцити.
Основні принципи лікування: правильний режим, раціональне харчування, препарати вітаміну В12 і фолієвої кислоти.
Білокдефіцитні анемії розвиваються внаслідок дефіциту білка в раціоні з високим рівнем вуглеводів у харчуванні. Це сприяє порушенню еинтезу глобіну і білкових транспортних сполук, зниженню продукції еритропоетинів і ураженню еритропоезу, а також недостатності вироблення гормонів і ферментів.
Клінічні прояви характеризуються дистрофічними змінами, ознаками полігіповітамінозів, порушенням пігментного обміну, пастозні-отю та набряками підшкірної жирової клітковини.
Гематологічні особливості даної анемії: тяжка норморегенератор-на анемія, нормохромна з вираженим анізо- і пойкілоцитозом, знижений рівень білка в сироватці крові, виражена диспротеїнемія.
Лікування: харчування з достатньою кількістю білка, усунення дисбактеріозу кишечнику, замісна ферментна терапія, полівітаміни, у тяжких випадках внутрішньовенно вводять плазму, альбумін.
2. Хронічні розлади харчування в дітей раннього віку
2.1 Витримка внутрішньоутробного розвитку
Затримку внутрішньоутробного розвитку діагностують у дітей, які іій момент народження мають недостатню масу тіла або недостатні масу і довжину тіла відносно їхнього гестаційного віку.
Етіологія. Виділяють 4 групи факторів ризику, що можуть призвести до затримки внутрішньоутробного розвитку:
1)материнські, до яких належать:
дефекти харчування (різкий дефіцит білків та вітамінів, цинку, селену й інших мікроелементів);
захворювання серцево-судинної системи, у тому числі гіпертонічна хвороба, хронічні захворювання нирок і легень, гемоглобінопатії;
цукровий діабет типу І із судинними ускладненнями; ожиріння; хвороби сполучної тканини;
тривалий безплідний період, викидні, мертвонародження в анамнезі, народження попередніх дітей у сім'ї з низькою масою тіла, гестози;
шкідливі звички матері: куріння, алкоголізм, наркоманія, приймання деяких медикаментів (наприклад, антиметаболітів, бета-адре-ноблокаторів, дифеніну, оральних антикоагулянтів та ін.);
2)плацентарні: недостатня маса тіла і плаценти (менше ніж 8 % маси тіла новонародженого), її структурні аномалії (інфаркти, кальциноз, фіброз, гемангіома, єдина артерія пупкового канатика, тромбози су дин, плацентит тощо) і часткове відшарування, а також аномалії при кріплення і вади розвитку плаценти;
соціально-біологічні: низький соціально-економічний рівень матері, підлітковий вік, проживання у високогірній місцевості, професійні шкідливості в матері (робота в гарячому цеху, вібрація, про никна радіація, хімічні фактори та ін.);
плодові: багатоплідна вагітність, спадкові фактори (хромосомні хвороби, деякі спадкові аномалії обміну речовин), вроджені вади розвитку, генералізовані внутрішньоутробні інфекції.
У 40 % дітей виявити причину затримки внутрішньоутробного розвитку не вдається (ідіопатична форма), при цьому у третини з них у родоводі (частіше по лінії матері) є члени сім'ї з низькою масою тіла на момент народження.
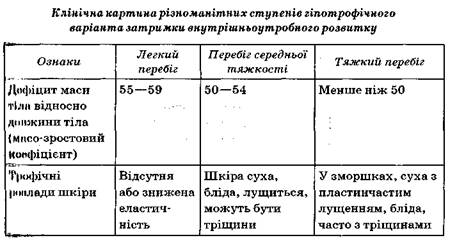
Патогенез. Різноманітність причин зумовлює гетерогенність патогенезу затримки внутрішньоутробного розвитку. Вона може виникати на різних термінах внутрішньоутробного життя. Так, мала маса на час народження в доношеної дитини свідчить про те, що фактор, який уповільнював темп його внутрішньоутробного розвитку, діяв в останні 2— 3 міс вагітності, але якщо одночасно наявний дефіцит довжини тіла (нижче 10 центилів), то несприятливі умови для плода впливали з II триместру вагітності. Перший варіант захворювання називають гіпотрофічним, другий — гіпопластичним. Найчастішою причиною затримки внутрішньоутробного розвитку за гіпотрофічним типом є тяжкий гестоз другої половини вагітності, синдром недостатності плаценти, а за гіпопластичним типом — багатоплідна вагітність, генетич но обумовлена мала маса тіла на час народження, підлітковий вік ми тері, дефіцити харчування легкого і середнього ступеня без виражених проявів гіповітамінозу.
Затримка внутрішньоутробного розвитку, що супроводжується Порушенням розвитку плода (формуванням вад розвитку, дизембріо-Генетичних стигм, порушенням пропорцій тіла — диспластичний варіант) буває в дітей із хромосомними та геномними мутаціями, гене-ралізованими внутрішньоутробними інфекціями, а також зумовлена професійними шкідливостями та шкідливими звичками матері, дією тератогенних медикаментів. Таких дітей обов'язково обстежує лікар-Генетик.
Діагностика. У діагностиці затримки внутрішньоутробного розвитку виділяють такі фактори:
—етіологічні фактори та стани ризику (материнські, плацентарні, Плодові, поєднані);
—- клінічний варіант (гіпотрофічний варіант — асиметричний; ГІпопластичний варіант — симетричний; диспластичний варіант — симетричний);
ступінь тяжкості (легкий, середньої тяжкості, тяжкий);
перебіг інтранатального і неонатального періодів (без ускладнень ібо з ускладненнями та супутніми станами — зазначити якими).
При гіпотрофічному варіанті ступінь тяжкості можна визначити на дефіцитом маси відносно довжини тіла, а в доношених дітей — за Масо-зростовим коефіцієнтом (величину маси на час народження в І'рамах розділити на показник зросту в сантиметрах), що в нормі становить 60—68. Ступінь тяжкості при гіпопластичному варіанті визначають за дефіцитом довжини тіла й обводу голови відносно терміну гестації. Ступінь тяжкості диспластичного варіанта визначається йп наявністю і характером вад розвитку, кількістю і тяжкістю стигм дизембріогенезу, станом центральної нервової системи, характером захворювання, що сприяє затримці внутрішньоутробного розвитку.
![]()
![]()
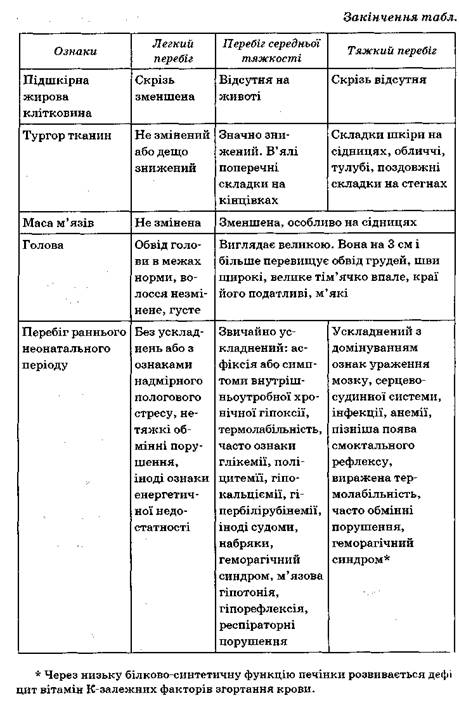
![]() Звичайно діти схильні до великої втрати початкової маси тіла і більш Повільного її відновлення. Характерними є тривала транзиторна жовтяниця в період новонародженості, повільне загоєння пупкової ранки після відпадання пуповинного залишку. Явища гормонального кризу В дітей з гіпотрофією, як правило, відсутні. У ранній неонатальний період для таких дітей типовий синдром гіперзбудливості, що обумовлений централізацією кровотоку, гіперкатехоламінемією у відповідь на внутрішньоутробну гіпоксію та тривалим метаболічним ацидозом.
Звичайно діти схильні до великої втрати початкової маси тіла і більш Повільного її відновлення. Характерними є тривала транзиторна жовтяниця в період новонародженості, повільне загоєння пупкової ранки після відпадання пуповинного залишку. Явища гормонального кризу В дітей з гіпотрофією, як правило, відсутні. У ранній неонатальний період для таких дітей типовий синдром гіперзбудливості, що обумовлений централізацією кровотоку, гіперкатехоламінемією у відповідь на внутрішньоутробну гіпоксію та тривалим метаболічним ацидозом.
При гіпопластичному варіанті затримки внутрішньоутробного розвитку діти мають пропорційне зменшення всіх параметрів фізичного розвитку у відповідному гестаційному віці — нижче ніж 10 центилів. Можуть бути поодинокі стигми дизембріогенезу (не більше 3—4). Співвідношення між обводами голови та грудей не порушені, але може бути мікроцефалія. Краї швів і тім'ячка можуть бути м'якими, шви не закриті. У ранній неонатальний період діти також схильні до швидкого охолодження, інфікування, респіраторних розладів і розвитку метаболічних синдромів.
Клінічна картина диспластичного варіанта значно залежить від етіології, але типовими є тяжкі неврологічні розлади, порушення обміну. Привертає увагу високий поріг стигматизації в дітей із цією формою гіпотрофії.
2.2 Основні дизембріогенетичні стигми (Л.Т. Журба)
| Локалізація | Характер аномалії |
| Череп | Форма черепа мікроцефалічна, гідроцефалічна, брахіцефа-лічна, доліхоцефалічна, асиметрична; низьке чоло, різко виражені надбрівні дуги, нависаюча потилична кістка, сплощена потилиця, гіпоплазія соскоподібних відростків |
| Обличчя | Пряма лінія скороченого чола і носа, монголоїдний або антимонголоїдний розріз очей, гіпо- і гіпертелоризм, сідлоподібний ніс, сплощена спинка носа, скривлений ніс, асиметрія обличчя, макрогнотія, мікрогнатія, прогенія, роздвоєне підборіддя, клиноподібне підборіддя |
| Очі | Епікант, індіанська складка повіки, низьке стояння повік, асиметрії очних щілин, відсутність слізного м'ясця (третьої повіки), дистихіаз (подвійний ріст вій), колобома, гетерохромія райдужки, неправильна форма зіниць |
| Вуха | Великі відстовбурчені вуха, малі деформовані вуха, різно-великі вуха, різний рівень розташування вух, низько розташовані вуха, аномалія розвитку завитка і протизавитка, збільшення вушної часточки, додаткові козелки |
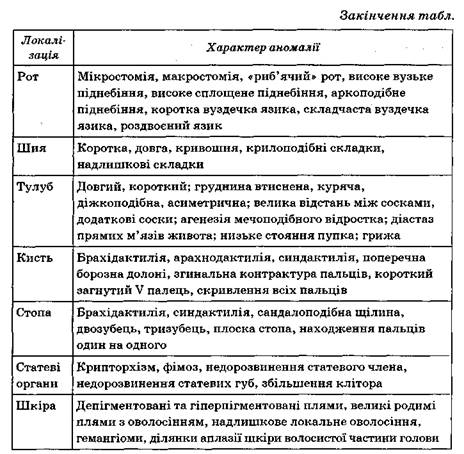
Примітка: діагностичне значення має виявлення в хворого одночасно 5 стигм і більше.
Принципи лікування такі:
Огляд дитини проводять під променистим джерелом тепла. її поміщають у кувез або зігрівають іншим способом (грілка до ніг, лампа солюкс).
За наявності смоктального рефлексу, відсутності асфіксії, вира жених неврологічних змін і зригувань після пробного давання дистильованої води дитину починають годувати зцідженим грудним моло> ком із пляшечки не пізніше ніж через 2 год після народження. Кількість молока визначають за тими самими принципами, що і в нв' доношених дітей. У разі неможливості ентерального харчування показана інфузійна терапія. Термін прикладання до грудей залежить від маси тіла на час народження, стану дитини, ускладнень.
Усім дітям із затримкою внутрішньоутробного розвитку відразу після народження парентерально вводять 1—2 мг вітаміну К. Характер і обсяг терапії залежить від перебігу пологів, наявності ускладнень, супутніх захворювань. При недостатньому збільшенні маси тіла Необхідно зробити копрограму і за її
8-09-2015, 22:00
