При проведении Международной декады заболеваний костей и суставов (2000–2010) выделены следующие заболевания, имеющие наиболее важное медико-социальное значение для общества: остеоартроз, остеопороз, боль в нижней части спины, ревматоидный артрит, травматические повреждения.
Наиболее распространенным ревматическим заболеванием является остеоартроз (ОА). Это хроническое невоспалительное заболевание суставов (суставных хрящей) и окружающих их тканей. По статистике от остеоартроза страдает от 10 до 16% населения Земного шара. Частота ОА прогрессирующе увеличивается с возрастом (5). Ревматоидный артрит (РА) - хроническое системное заболевание соединительной ткани, при котором в результате иммуновоспалительного процесса преимущественно поражаются периферические суставы с развитием в них эрозивно-деструктивных изменений (2).
Распространенность ревматоидного артрита в популяции достигает 1,0 %, а экономические потери для общества сопоставимы с таковыми при ишемической болезни сердца (1).
Возраст, в котором у большинства пациентов начинается ревматоидный артрит, составляет 30 - 50 лет. Женщины страдают РА и ОА примерно в три раза чаще. С возрастом распространенность заболевания увеличивается, а ее половые различия сглаживаются. У женщин 60 - 64 лет РА возникает в 6 раз чаще, чем у женщин 18 - 29 лет. В отсутствие эффективной терапии продолжительность жизни у больных РА ниже на 3 года у женщин и на 7 лет у мужчин (1).
Согласно современным стандартам лечения ревматоидного артрита, непосредственной целью терапии является достижение состояния продолжительной ремиссии, а также уменьшение боли в суставах, улучшение их подвижности, улучшение общего состояния больного, уменьшение повышенной температуры тела (25).
Нефармакологические методы лечения . Социальная поддержка больных
В последние годы обращается внимание на социальную поддержку и образование больных. Так, различные советы и общества по артритам в Великобритании, США, Канаде издают брошюры, обучающие больных справляться с болью (20), и организуют локальные группы самопомощи. Такие мероприятия должны являться существенной частью любого лечебного плана для больных ОА, тем более что приводятся доказательства эффективности образовательных программ для больных, таких как “ArthtritisSelf-ManagementCourse”, в уменьшении боли, числа визитов к врачу, улучшении качества жизни и поддержании функции суставов. Недавно проведенный сравнительный метаанализ образовательных программ и применения НПВП показал, что образовательные программы весьма существенно помогают больным справиться с болью (21).
Физическая терапия
Физическая терапия играет важную роль в лечении ОА. Она включает аэробные, двигательные и силовые упражнения для определенных мышечных групп, тепловые методы, ультразвук, чрескожную электростимуляцию нервов (ЧЭСН) и т.д. Так, укрепление четырехглавой мышцы бедра и аэробные упражнения в течение 6 мес. уменьшали боль и улучшали функцию коленных суставов. Результаты проведенного W.Ettinger и соавт. многоцентрового исследования (22) длительностью 18 мес. показали, что аэробные или изометрические упражнения дают лучший результат, чем комбинация фармакотерапии с образовательными программами у больных с ОА коленных суставов. Данные клинических исследований подтверждают полезность физических упражнений. ЧЭСН применяют для получения анальгетического действия, но результаты двойных слепых исследований ЧЭСН с плацебо (23) и напроксеном неоднозначны. При поражении суставов нижних конечностей для уменьшения нагрузки рекомендуется хождение с палочкой, которая почти на 50% уменьшает нагрузку на тазобедренный сустав, ношение надколенников и супинаторов. Использование подпяточных клиньев полезно при ОА медиального отдела коленного сустава, особенно у больных с легким течением заболевания.
Медикаментозное лечение ревматоидного артрита основано на четырех традиционных подходах
Первый - заключается в использовании аспирина и других нестероидных противовоспалительных препаратов (НПВС), а также анальгетиков. Эти препараты быстро уменьшают проявления заболевания, но почти не влияют на скорость его прогрессирования.
Второй - предусматривает прием низких доз глюкокортикоидов внутрь. Недавно показано, что они не только подавляют воспаление, но и замедляют деструкцию костной ткани.
Третий подход основан на использовании так называемых средств базисной терапии, приостанавливающих прогрессирование ревматоидного артрита. Кроме иммунодепрессантов и цитостатиков, в эту группу входят и другие препараты, некоторые из которых снижают уровень белков острой фазы воспаления, что говорит об их способности предотвращать повреждение тканей.
Четвертый подход - внутрисуставное введение глюкокортикоидов - позволяет добиться временного улучшения в тех случаях, когда не помогают препараты для системного применения (11).
Пятый подход – использование биологических агентов, что является наиболее существенным достижением ревматологии последнего десятилетия.
Наиболее широко применяемыми в клинической практике являются нестероидные противовоспалительные препараты – НПВП.
Таблица 1. Основные механизмы влияния неселективных и селективных ингибиторовЦОГ – 2
| Влияние | Неселективные ингибиторы ЦОГ | Ингибиторы ЦОГ - 2 |
| Артрит | Ингибируют ЦОГ - 2↓ Ингибируют ПГЕ 2 ↓ Уменьшают боль и отечность |
Ингибируют ЦОГ - 2↓Ингибируют ПГЕ2↓Уменьшают боль и отечность |
| Желудок | Ингибируют ЦОГ - 2 Ингибируют ПГЕ2 Уменьшают гастропротекцию |
Не вызывают эффекта на ЦОГ - 1 |
| Тромбоциты | Ингибируют ЦОГ - 1 и ЦОГ - 2 | Не вызывают эффект на ЦОГ - 2 |
| Сосуды | Ингибируют ЦОГ - 1 и ЦОГ - 2 | Ингибируют ЦОГ - 2↓ Ингибируют ПГЕ2↓ Уменьшаютантитромбоцитарный эффект |
Вместе с тем фармакоэпидемиологические данные показывают не только их широкое использование, но часто и неправильное применение у больных, и поэтому, чаще имеющих различные побочные реакции.
В настоящее время выделяют несколько десятков НПВП, близким по химическим и фармакологическим свойствам. Рассмотрим некоторые из них.
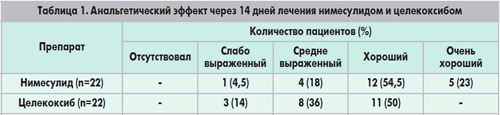
Нимесулид- это НПВП с уникальной химической структурой; принадлежит к классу сульфонамидов, обладает выраженным эффектом ингибирования циклооксигеназы (ЦОГ)-2 и меньшим воздействием на ЦОГ-1. Во многих исследованиях продемонстрировано, что нимесулид в стандартной дозе 100 мг дважды в сутки эффективен для симптоматического лечения ОА.
На сегодняшний день в клинической практике в Украине используется несколько десятков (30) разных по производителю и фармацевтическим формам препаратов нимесулида. Накоплен позитивный опыт фармакотерапии этим препаратом, причем в разных фармацевтических формах при остеоартрозе (В.Н. Коваленко. Н.М. Шуба, А.К. Галицкая, 2001). Достаточно высокую эффективность выявили исследования растворимой формы нимесулида – препарата Нимесил. Следует отметить, что благодаря своим фармацевтическим и фармакокинетическим свойствам данной фармацевтической формы нимесулид сравнительно с другими НППВ, диклофенаком натрия, например, проявляет более ранний обезболивающий эффект уже после первого приема. Использование 100 мг нимесулида провоцирует более выраженный и быстрый терапевтический эффект, чем 200 мг целекоксиба или 25 мг рофекоксиба на протяжении 3-х часов. У больных с остеоартрозом обезболивание происходит через 15 минут после приёма нимесулида, тогда как эффект целекоксиба и рофекоксиба развивается намного медленнее. Лечение нимесулидом гораздо дешевле, чем использование упомянутых выше препаратов со схожими фармакотерапевтическими препаратами. (8).
Целекоксиб (Ревмоксиб) – это сульфонамид, принадлежащий к группе селективных ингибиторов ЦОГ-2. В клинических исследованиях показано, что целекоксиб в дозировке 200 мг способен устранять симптомы ОА.
За период между сентябрем 2004 г. и ноябрем 2005 г. в исследование отобрали 44 пациента (6 мужчин и 38 женщин), у 24 из которых был болевой синдром в коленном суставе без синовиального выпота и у 20 – с выпотом.
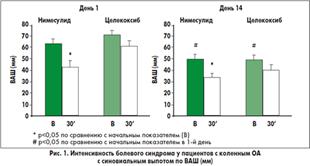
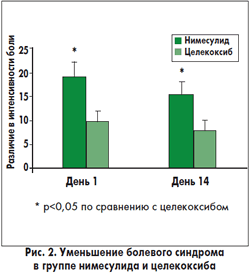
У пациентов с синовиальным выпотом анальгетический эффект нимесулида был более выраженным, чем целекоксиба. В группе пациентов, получавших нимесулид, показатели по ВАШ через 30 мин после приема лекарства были достоверно ниже, чем до приема препарата (рис. 1), тогда как в группе целекоксиба эта разница не была статистически значимой. Болевой синдром в группе нимесулида уменьшался значительно больше, чем в группе целекоксиба (рис. 2). С другой стороны, эффективность лечения обоими препаратами была сравнимой у пациентов без синовиального выпота.
В последний день лечения у всех пациентов перед приемом препаратов оценивали интенсивность болевого синдрома по ВАШ. В обеих группах исследования интенсивность боли была ниже, чем до начала лечения. Такие результаты наблюдали и у пациентов с синовиальным выпотом, и без выпота (рис. 1 и 2). Через 30 мин после приема препаратов интенсивность боли в группе нимесулида была достоверно ниже, чем до приема лекарства, тогда как статистически достоверной разницы в группе целекоксиба не обнаружено. Также уменьшение между аналогичными показателями болевого синдрома было достоверно выше в группе нимесулида (рис. 2).(7)
L-лизина эсцинат - это препарат выбора в профилактике и лечении отечно-болевого синдрома, который, начиная с 1998 г. используют в Институте травматологии и ортопедии АМН Украины (11). Эсцин понижает активность лизосомальных гидролаз, что предупреждает расщепление мукополисахаридов в стенках капилляров и в соединительной ткани, которая их окружает, и таким образом нормализует повышенную сосудисто-тканевую проницаемость и оказывает антиэкссудативное (противоотечное), противовоспалительное и обезболивающее действие. Препарат повышает тонус сосудов, оказывает умеренный иммунокорригирующий и гипогликемический эффекты (12).
Суточная выраженность боли под влиянием лечения L-лизина эсцинатом
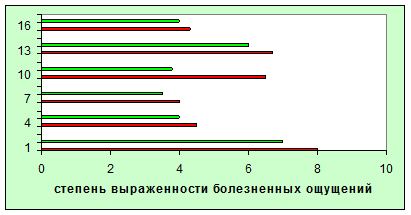
Обозначения :
Красным цветом - до лечения;
Зеленым – после.
1-ходьба по ровной поверхности;
4-ходьба по ступенькам вниз;
7-постоянная боль;
10-ночная боль;
13-боль при продолжительной ходьбе;
16-стартовая боль.
Таблица. Сравнительная анальгетическая активность и переносимость классических НПВП на модели ацетилхолинового абдоминального теста у мышей
| Препарат | ЕД 50, мг/кг | УД 50, мг/кг | ИП, УД 50/ЕД 50 | Относительная безопасность по диклофенаку натрия |
| АСК | 50(28±90) | 240(178±324) | 4,8 | 0,8 |
| Динклофенак натрия | 8(5±14) | 48(33±71) | 6 | 1 |
| Индометацин | 4(3±6) | 10(5±19) | 2,5 | 0,42 |
| Ибупрофен | 20(11±38) | 310(230±419) | 15,5 | 2,6 |
| Кетопрофен | 53(28±101) | 62(36±108) | 1,2 | 0,2 |
| Пироксикам | 36(23±57) | 36(25±53) | 1 | 0,17 |
Пометки: ЕД-эффективная доза, ИП- индекс переносимости. (17).
Побочные эффекты нестероидных противовоспалительных препаратов
Наиболее главным побочным эффектом НПВП является поражение слизистой оболочки желудка, что проявляется в виде так называемой гастропатии, вплоть до появления язвенной болезни и ее осложнений в виде перфорации. Это связано с тем, что при приеме внутрь НПВП вызывают раздражение слизистой желудка. Чтобы снизить этот эффект НПВП эти препараты назначаются обычно только после еды. Кроме того, существуют таблетированные формы с оболочкой, которая растворяется не в желудке, а в кишечнике.
Также, снизить раздражение слизистой желудка можно и путем назначения инъекций этих препаратов.
Среди признаков осложнений со стороны желудка во время приема НПВП можно отметить:
-тошноту,
-диспепсию,
-желудочно-кишечное кровотечение,
-диарею.
Побочные эффекты, наблюдавшиеся в контролируемых клинических испытаниях (результаты 12 исследований), при применении целекоксиба в дозах 100–200 мг ежедневно у пациентов с ОА или РА (безотносительно причинной связи с приемом препарата) представлены в таблице.
Побочные реакции, отмеченные с частотой ≥2% случаев в премаркетинговых контролируемых испытаниях у пациентов с артритом, получавших целекоксиб, по сравнению с плацебо.
| Системы организма / побочные эффекты | Частота побочных реакций | |
| Боль в животе | 4,1 | 2,8 |
| Диарея | 5,6 | 3,8 |
| Диспепсия | 8,8 | 6,2 |
| Метеоризм | 2,2 | 1 |
| Тошнота | 3,5 | 4,2 |
| Организм в целом | ||
| Боль в спине | 2,8 | 3,6 |
| Периферические отеки | 2,1 | 1,1 |
| Случайная травма | 2,9 | 2,3 |
| Нервная система | ||
| Головокружение | 2 | 1,7 |
| Головная боль | 15,8 | 20,2 |
| Инсомния | 2,3 | 2,3 |
| Респираторные | ||
| Фарингит | 2,3 | 1,1 |
| Ринит | 2 | 1,3 |
| Синусит | 5 | 4,3 |
| Инфекция верхних дыхательных путей | 8,1 | 6,7 |
| Кожа | ||
| Сыпь | 2,2 | 2,1 |
В результате применения НПВП не часто встречаются отек лица и ног, внезапное снижение мочеиспускания. Эти эффекты обычно встречаются у пожилых больных и людей с другими серьезными заболеваниями.
НПВП вызывают в организме задержку солей и воды, что приводит как к отекам, так и к повышению артериального давления (артериальная гипертензия).
Сравнительно редко возникают следующие осложнения со стороны почек: интерстициальный нефрит, нефротический синдром, острая почечная недостаточность и острый сосочковый некроз.
Кроме того, многие НПВП вызывают уменьшение свертываемости крови, что также нужно учитывать больным со склонностью к кровотечениям.
Кортикостероиды – это группа препаратов противовоспалительного свойства. Они являются производными естественного гормона человека – кортизола. Их эффект заключается в устранении воспаления. Данные препараты не обладают непосредственно обезболивающим эффектом, но, разрешая воспаление, они тем самым устраняют и боль.
Применяются эти препараты в тех случаях, когда нестероидные противовоспалительные препараты и мышечные релаксанты оказываются неэффективными.
Побочные эффекты кортикостероидов
Среди умеренно выраженных побочных эффектов этих препаратов отмечаются:
-Головная боль, иногда выраженная
-Головокружение
-Усиление боли в спине или ноге
В редких случаях могут быть более серьезные побочные эффекты:
-Воспаление в области спинномозгового нерва или другой ткани
-Дегенерация ткани в месте постоянного введения препарата
-Повреждение спинномозговых корешков (14).
Хондропротекторы . Согласно рекомендациям Ассоциации ревматологов Украины они, наряду с нестероидными противовоспалительными препаратами (НПВП), являются основой терапевтического подхода у больных остеоартрозом. Основными хондропротекторами являются глюкозамин и хондроитин сульфат. Они являются естественными компонентами суставного хряща, входят в состав протеогликанов и гликозаминогликанов хрящевой ткани.
В многочисленных исследованиях фармакологических эффектов глюкозамина установлено благоприятное влияние на метаболизм хряща — усиление анаболических и ослабление катаболических процессов. Установлены стимуляция глюкозамином синтеза протеогликанов и коллагена, повышение продукции компонентов внеклеточного матрикса, при этом свойства гликозаминогликанов и протеогликанов (по данным хроматографического анализа) были близки к физиологическим. В большинстве проведенных краткосрочных (4-6 недель) клинических исследований эффективность глюкозамина в дозах 800-1500 мг/сут у больных остеоартрозом превышала таковую плацебо и была эквивалентна эффективности ибупрофена и диклофенака. Глюкозамин несколько уступал НПВП по скорости наступления обезболивающего и противовоспалительного действия, однако обладал отчетливым последействием. Заметное улучшение клинических симптомов (по оценке в баллах боли при ходьбе и в покое, выраженности синовита, функционального индекса Лекена) проявлялось через 2-3 недели от начала лечения с сохранением эффекта в течение месяца и более после отмены лечения, что позволяет проводить прерывистые курсы лечения.
В длительных исследованиях, когда терапия глюкозамином в дозе 1500 мг/сут у больных остеоартрозом продолжалась в течение 1-3 лет, хороший и отличный результат был получен у 50-60% больных, удовлетворительный — у 25-30% больных. При этом отмечено, что для четкой оценки результатов лечения следует принимать глюкозамин не менее 6-12 недель, что вполне объяснимо с учетом особенностей кровоснабжения суставов и темпов обмена веществ в тканях сустава.
В исследованиях, посвященных переносимости глюкозамина, установили отсутствие токсичности и наличия тяжелых побочных эффектов, а также клинических, биохимических или гематологических изменений при длительном его приеме.
В клинических исследованиях продемонстрирована эффективность хондроитин сульфата в отношении влияния на болевой синдром и функциональное состояние суставов.
В большинстве клинических исследований, в которых сравнивался эффект хондроитин сульфата и НПВП отмечалось, что хондроитин сульфат в дозе 1200 мг/сут так же эффективен, как диклофенак и ибупрофен в терапевтических дозах, и более эффективен, чем плацебо в отношении уменьшения боли и увеличения подвижности суставов у больных остеоартрозом. Хотя эффект хондроитин сульфата наступал несколько позже (на 6-8-й неделе лечения) по сравнению с действием НПВП (на 1-2-й неделе лечения), он держался более длительно после прекращения лечения (см. рис.).
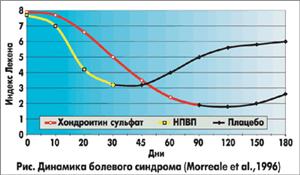
Немаловажным преимуществом препарата является хорошая переносимость, побочные проявления при его приеме незначительны и нечасты — около 1-3% случаев, тогда как при приеме НПВП они более серьезны (прежде всего, желудочно-кишечные кровотечения, изъязвления и т.п.) и встречаются у 30-40% лиц. Как правило, переносимость хондроитин сульфата и плацебо была одинаковой (16).
Особенное внимание среди хондропротекторов заслуживает ХС – 4,6, зарегистрированный в Украине как препарат Структум производства компании «Пьер Фабр», Франция. Препарат проявляет высокую биодоступность по отношению к хрящу, хорошо переносится больными (17). Структум принадлежит к препаратам замедленного действия. Эффект наступает не одномоментно, а по мере накопления хондроитин сульфата в хряще. Уменьшение боли наблюдается на протяжении 1 мес. лечения и в последующие месяцы вначале стихает боль в состоянии покоя, а затем – боль при движениях. Это дает возможность уменьшить дозу анальгетиков или НПВП (18). При постановке диагноза ОА показано проводить 14-дневный курс НПВП до начала действия структурно-модифицирующих препаратов, после чего рекомендуется постоянная и длительная терапия хондропротекторами (17).
Биологические агенты. В отличие от традиционных БПВП и глюкортикоидов, для которых характерны неспецифические противовоспалительные и/или иммуносупрессивные эффекты, биологические агенты оказывают более селективное действие на гуморальные и клеточные компоненты воспалительного каскада, лежащего в основе иммунопатогенеза РА.
Среди чрезвычайно широкого спектра противовоспалительных медиаторов, принимающих участие в развитии РА, особое внимание привлечено к фактору некроза опухоли (ФНО-а), который рассматривается как основная мишень для терапии некоторых воспалительных реакций человека. Это послужило основанием для разработки препаратов, блокирующих биологическую активность именно ФНО-а.
Существует ряд стандартных биологических агентов, предназначенных для лечения ревматоидного артрита:
-Ембрел
-Хумира
-Кинерет
-Ремикад
-Ритуксан
-Оренция
Остальные биологические агенты подвергаются клиническим испытаниям относительно их воздействия на различные формы артрита.
Адалимубаб (Хумира, «Эббот Лэбораториз») является первым и пока единственным препаратом, представляющим собой полностью человеческие рекомбинантные моноклональные антитела к ФНО-а. В настоящее время лечение адалимубабом получают свыше 110 000 пациентов более чем в 67 странах мира. При тяжелом или среднетяжелом РА его применяют в режиме монотерапии или в комбинации с метотрексатом (МТ) или другими базисными противовоспалительными препаратами. Кроме того, адалимубаб можно применять как препарат первого ряда у пациентов с ранним быстро прогрессирующим тяжелым РА, а также псориатическим артритом и анкилозирующим спондилитом (1).
Было проведено многоцентровое рандомизированное, двойное слепое клиническое исследование по оценке эффективности препарата Adalimumab (Humira), моноклонального антитела, действующего на фактор некроза опухоли, для раннего лечения 799 пациентов с ревматоидным артритом (РА) средней и тяжелой степени. Исследование было организовано компанией-производителем Abbot Laboratories (CША). Через 1 год лечения значительное улучшение состояния наблюдалось у больных, получавших комбинированную терапию Adalimumab и метотрексатом, по сравнению с группами пациентов, находившихся на монотерапии Adalimumab или метотрексатом: 62, 41 или 46% соответственно. Через 2 года достигнутые результаты сохранялись: 59, 37 или 43% соответственно. Не было различий в количестве наблюдавшихся серьезных побочных явлений. Исследователи считают, что у пациентов с прогрессирующим РА, никогда не получавших метотрексат, можно достичь хороших терапевтических результатов при раннем комбинированном лечении препаратом Adalimumab и метотрексатом (24).
Побочные действия адалимубаба. Очень часто сообщалось о реакциях в месте введения (большинство реакций были легкими и не требовали прекращения введения); часто сообщалось об инфекциях верхних и нижних дыхательных путей, кандидозе, бактериальных инфекциях (включая инфекции мочевого тракта), лимфопении, головокружении, головной боли, расстроиствах чувствительности (включая парастезию), раздражении или воспалении глаз,диарее,боли в животе, стоматите, тошноте, повышении уровней печеночных ферментов, сыпи, дерматите, зуде, скелетно-мышечной боли. Сообщалось о развитии тяжелых инфекций (редко с фатальным исходом) – туберкулеза и инвазивных оппортунистических инфекций, анафилаксии, ангионевротическом отеке.
К сожалению, ревматоидный артрит продолжает оставаться заболеванием, при котором все еще отсутствуют методы, позволяющие добиться полного излечения.
Чем раньше будет назначено лечение ревматоидного артрита, направленное
8-09-2015, 22:20
