Пигментный обмен
Под пигментным обменом подразумевают обычно все процессы образования, превращения и распада пигмента крови (гемоглобина), точнее его пигментной небелковой части, и главного деривата этого пигмента— желчного пигмента (билирубина). В настоящее время однако известны и другие пигменты, которые по хим. составу по – видимому, близки НЬ — это-НЬ мышц, цитохромы, дыхательный фермент Варбурга (Warburg) и другие еще весьма мало изученные пигменты. Отделить процессы образования, превращения и распада этих пигментов от процессов обмена НЬ пока невозможно. В более широком смысле под П..о. можно подразумевать процессы образования, превращения и распада всех пигментов организма, т. е. как вышеперечисленных пигментов, группы НЬ, так и всех других пигментов— меланина, липохромов и т. д.
ФИЗИОЛОГИЯ ОБМЕНА БИЛИРУБИНА
Процесс превращения свободного (непрямого) билирубина, образующегося при разрушении эритроцитов и распаде гемоглобина в органах ретикулоэндотелиальной системы (РЭС), в билирубин-диглюкуронид (связанный, или прямой билирубин) в печеночной клетке (рис. 1) осуществляется в три этапа (на рисунке обозначены римскими цифрами):
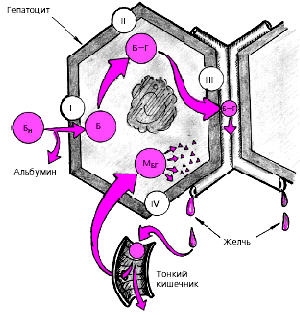
Рис. 1. Процессы обезвреживания свободного (непрямого) билирубина и мезобилиногена (уробилиногена) в печеночной клетке.
Бн - свободный (непрямой) билирубин; Б-Г - билирубин-глюкуронид (связанный, или прямой билирубин); Мбг - мезобилиноген (уробилиноген).
Римскими цифрами обозначены этапы обезвреживания
1. I этап — захват билирубина (Б) печеночной клеткой после отщепления альбумина;
2. II этап — образование водорастворимого комплекса билирубин-диглюкуронида (Б-Г);
3. III этап — выделение образовавшегося связанного (прямого) билирубина (Б-Г) из печеночной клетки в желчные канальцы (проточки).
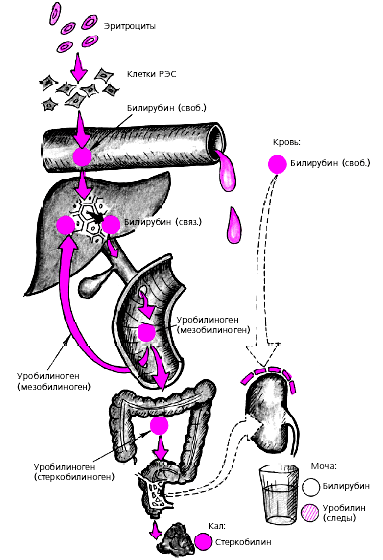
Дальнейший метаболизм билирубина связан с поступлением его в желчные пути и кишечник. В нижних отделах желчевыводящих путей и кишечнике под воздействием микробной флоры происходит постепенное восстановление связанного билирубина до уробилиногена. Часть уробилиногена (мезобилиноген) всасывается в кишечнике и по системе воротной вены вновь попадает в печень, где в норме происходит практически полное его разрушение (см. рис. 1). Другая часть уробилиногена (стеркобилиноген) всасывается в кровь в геморроидальных венах, попадая в общий кровоток и выделяясь почками с мочой в незначительных количествах в виде уробилина, который часто не выявляется клиническими лабораторными методами. Наконец, третья часть уробилиногена превращается в стеркобилин и выделяется с калом, обусловливая его характерную темно-коричневую окраску.
Методы определения билирубина и его метаболитов
Определение билирубина в сыворотке крови
В клинической практике используются различные методы определения билирубина и его фракций в сыворотке крови.
Наиболее распространенным из них является биохимический метод Ендрассика-Грофа . Он основан на взаимодействии билирубина с диазотированной сульфаниловой кислотой с образованием азопигментов. При этом связанный билирубин (билирубин-глюкуронид) дает быструю («прямую») реакцию с диазореактивом, тогда как реакция свободного (не связанного с глюкуронидом) билирубина протекает значтельно медленнее. Для ее ускорения применяют различные вещества–акселераторы, например кофеин (метод Ендрассика-Клеггорна-Грофа), которые освобождают билирубин из белковых комплексов («непрямая» реакция). В результате взаимодействия с диазотированной сульфаниловой кислотой билирубин образует окрашенные соединения. Измерения проводят на фотометре.
ХОД ОПРЕДЕЛЕНИЯ
В 3 пробирки (2 опытные пробы и холостая) вводят реактивы, как указано в таблице. Диазореакция
| Ингридиенты | Опытная проба мл | Холостая проба мл | |
| Общий билирубин | Связанный билирубин | ||
| Сыворотка | 0,5 | 0,5 | 0,5 |
| Кофеиновый реактив | 1,75 | - | 1,75 |
| Раствор хлорида натрия | - | 1,75 | 0,25 |
| Диазосмесь | 0,25 | 0,25 | - |
Для определения связанного билирубина измерение проводят спустя 5—10 мин после добавления диазосмеси, так как при длительном стоянии в реакцию вступает несвязанный билирубин. Для определения общего билирубина пробу для развития окраски оставляют стоять 20 мин, после чего измеряют на фотометре. При дальнейшем стоянии окраска не изменяется. Измерение проводят при длине волны 500—560 нм (зеленый светофильтр) в кювете с толщиной слоя в 0,5 см против воды. Из показателей, полученных при измерении общего и связанного билирубина, вычитают показатель холостой пробы. Расчет производят по калибровочному графику. Находят содержание общего и связанного билирубина.Метод Ендрассика, Клеггорна и Грофа прост, удобен в практике, не связан с применением дефицитных реактивов и является наиболее приемлемым для практических лабораторий.Определение рекомендуется приводить сразу же после забора проб, чтобы избежать окисления билирубина на свету. Гемолиз сыворотки снижает количество билирубина пропорционально присутствию гемоглобина. Следовательно, сыворотка крови не должна быть гемолизирована.
Ряд веществ — гидрокортизон, андрогены, эритромицин, глюкокортикоиды, фенобарбитал, аскорбиновая кислота — вызывают интерференцию.
Постоение калибровочного графика при методе ендрассика.
Способ I — Шелонга-Вендес использованием стабилизирующего свойства белка сыворотки крови. Основной раствор билирубина: в колбе вместимостью 50 мл растворяют 40 мг билирубина в 30—35 мл 0,1 моль/л раствора карбоната натрия Na2 CO3 . Хорошо взбалтывают, не допуская образования пузырьков. Доводят до 50 мл 0,1 моль/л раствором Nа2 СО3 и несколько раз перемешивают. Раствор стоек только в течение 10 мин от начала приготовления. В дальнейшем происходит окисление билирубина. Рабочий раствор билирубина: к 13,9 мл свежей негемолизированной сыворотки здорового человека добавляют 2 мл свежеприготовленного основного раствора билирубина и 0,1 мл 4 моль/л раствора уксусной кислоты. Хорошо перемешивают. При этом выделяются пузырьки углекислого газа. Рабочий раствор стоек в течение нескольких дней. Этот раствор содержит точно на 100 мг/л, или 171 мкмоль/л, билирубина больше, чем сыворотка, взятая для приготовления раствора. Чтобы исключить при расчетах количество билирубина, содержащегося в этой сыворотке, при измерении на фотометре из величин экстинкции калибровочных проб вычитают величины экстинкции соответствующих разведений компенсационной жидкости. Для приготовления компенсационной жидкости смешивают 13,9 мл той же сыворотки, которая использовалась для приготовления калибровочного раствора билирубина, 2 мл 0,1 моль/л раствора карбоната натрия и 0,1 мл 4 моль/л раствора уксусной кислоты. Для построения калибровочного графика готовят ряд разведений с различным содержанием билирубина. К полученным разведениям прибавляют по 1,75 мл кофеинового реактива и по 0,25 мл диазосмеси. При появлении помутнения можно добавить по 3 капли 30%-ного раствора едкого натра. Измерение проводят при тех же условиях, что и в опытных пробах, через 20 мин. Из компенсационной жидкости готовят разведения, аналогичные калибровочным (как указано ниже), и далее обрабатывают их так же, как калибровочные пробы.
Таблица. Определение связанного билирубина
| № пробирки | Рабочий раствор билирубина мл | Изотонический раствор NaCl, мл | Количество билирубина в пробе | Концентрация билирубина в сыворотке крови, мкмоль/л | |
| мг | мкмоль | ||||
| 1 | 0,05 | 0,45 | 0,005 | 0,00855 | 17,1 |
| 2 | 0,1 | 0,4 | 0,01 | 0,0171 | 34,2 |
| 3 | 0,15 | 0,35 | 0,015 | 0,02565 | 51,3 |
| 4 | 0,2 | 0,3 | 0,02 | 0,0342 | 68,4 |
| 5 | 0,25 | 0,25 | 0,025 | 0,04275 | 85,5 |
· Способ второй – выстраивать калибровочный график по готовому набору реактивов.(Например, набор Билирубин –эталон фирмы Лахема, включающий в себя билирубин лиофилизированный (точная концентрация билирубина приведена на этикетке флакона); и альбумин лиофилизированный.)
Определение билирубина в сыворотке крови прямым фотометрическим методом
Определение общего билирубина прямым фотометрическим методом чрезвычайно просто, удобно, не требует венепункции (исследуется капиллярная кровь), может повторяться неоднократно в течение суток. Недостатком метода является невозможность определить фракции билирубина, меньшая точность при выраженном гемолизе.
Несмотря на то, что при этом определяется только общий билирубин, этот подход представляет значительный интерес в неонатологии, так как у новорожденных детей преобладает одна производная билирубина, практически равная концентрации общего билирубина. Билирубин представляет собой пигмент с ярко выраженной желтой окраской. Его спектральная кривая поглощения имеет максимум на длине волны 460 нм (синяя область спектра). Измеряя поглощение на этой длине волны можно было бы определить концентрацию общего билирубина в крови. Однако ряд факторов усложняют такое измерение. Билирубин является сильным поглотителем и поэтому оптимальная для построения фотометра плотность 0,3-0,5 Б оптической плотности достигается в кювете с длиной оптического пути примерно 250 микрометров (0,25 мм).
Изготовить такую кювету непросто. Кроме того, фотометрирование непосредственно крови усложняется присутствием форменных элементов крови, рассеянием света на них, а также интерференцией билирубина с гемоглобином, который частично поглощает свет в синей области спектра. Поэтому для фотометрирования необходимо, во-первых, получить образцы плазмы крови, а, во-вторых, нужно исключить влияние гемоглобина, присутствующего в небольшом количестве в плазме. Плазму для фотометрирования получают на лабораторных центрифугах в гепаринизированных гематокритных капиллярах.
Фотометрирование можно проводить на спектрофотометрах на двух длинах волн 460 и 550 нм, на которых гемоглобин имеет одинаковые коэффициенты поглощения, а билирубин имеет максимум поглощения на длине волны 460 нм и не поглощает на длине волны 550 нм. Именно это позволяет исключить влияние гемоглобина при измерении концентрации билирубина.Однако спектрофотометры общего назначения мало пригодны для таких рутинных измерений, так как необходимо иметь специальные кюветы с малой оптической длиной. Примером такого специалиированного фтометра может служить фотометр Билимет К-анализатор билирубина фотометрический неонатальный (тип средства измерения АБФ-04).
Определение концентрации общего билирубина анализатором БИЛИМЕТ К производится методом прямого фотометрирования плазмы крови в тонком стеклянном капилляре. Для разделения крови в капилляре на фракции используется устройство для получения плазмы крови УППК-01-НПП ТМ или подходящая гематокритная центрифуга. Оптическая плотность исследуемого образца вычисляется как логарифм отношения световых потоков на двух длинах волн. Двухволновая методика измерения выбрана для уменьшения погрешностей измерения и устранения влияния присутствия в капилляре остаточной лизированой крови, которая даёт окраску раствора в красной части спектра.
Перед определением билирубина на анализаторе Билимет К необходимо наполнить капилляр кровью (чаще всего из пятки новорожденного) и получить на центрифуге плазму дисплее. Фотометрирование пробы длится доли секунды. После фотометрирования каретка автоматически выдвигается из прибора. Результат измерения фиксируется либо вручную, либо распечатывается печатающим устройством УП-02.

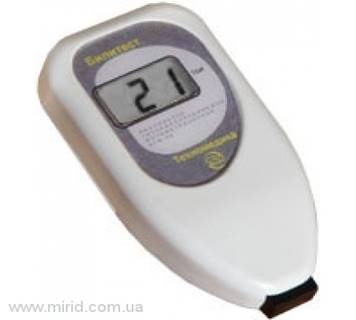
Транскутанная билирубинометрия как метод диагостики гипербилирубинемии новорожденных
Практика неинвазивной оценки билирубина не является в принципе новой. Опытный врач по пожелтению кожного покрова может оценить наличие и степень гипербилирубинемии. Однако такая оценка весьма субъективна: кроме личного опыта на восприятие цвета кожи ребенка оказывают влияние тип освещения и наличие оттенков кожи, вызванных различными клиническими факторами, что обусловливает необходимость лабораторного тестирования.
Значительный прогресс в области анализагипербилирубинемии новорожденных был достигнут с появлением в 1980 г. транскутанного билирубинометра фирмы «Минолта» (Япония) [6]. Десятилетний опыт применения прибора фирмы' «Минолта» в ряде стран показал, что врач, пользующийся прибором, обладает, несомненно, эффективным средством диагностики.
Положительный опыт медицинского применения транскутанного билирубинометра фирмы «Минолта» обусловил разработку и серийное производство отечественного аналога - фотометрического анализатора гипербилирубинемии «Билитест» (типа АГФ-02). Прибор «Билитест» прошел в установленном порядке все необходимые испытания и рекомендован к промышленному выпуску решением комиссии Минздрава СССР от 25 июня 1991 г.
Транскутанная билирубинометрия основывается на явлении обратной диффузии билирубина из крови в окружающую ткань (дерма). Увеличение концентрации билирубина в крови приводит к увеличению концентрации билирубина в дерме, и наоборот, уменьшение концентрации билирубина в крови (например, при переливании крови) приводит к обратному движению билирубина из дермы в кровь до тех пор, пока между этими двумя системами не наступит равновесие.
Поскольку билирубин обладает ярко выраженной желтой окраской, цвет кожи меняется в зависимости от содержания билирубина в дерме. Желтая окраска билирубина связана с наличием в нем полосы поглощения света в синей области спектра с максимумом на длине волны 460 нм.
Как известно, существует логарифмическая зависимость между концентрацией поглощающего вещества и интенсивностью прошедшего через него света. Прибор «Билитест» по своему принципу является фотометром отраженного света и измеряет логарифм отношения интенсивностей отраженного света на двух длинах волн. Прибор снабжен миниатюрной лампой-вспышкой и двумя фотоприемниками с узкополосными светофильтрами, позволяющими выделять из всего отраженного потока света излучение на длинах волн 460 и 550 нм. Выбор второй длины волны в желто - зеленом диапазоне обусловлен отсутствием в нем поглощения света билирубином и одновременно наличием примерно такого же, как на длине волны 460 нм, поглощения в гемоглобине крови. Это позволяет практически полностью исключить влияние капиллярных подкожных сосудов на результаты измерений.
Важной особенностью прибора является то, что он регистрирует свет, отраженный только из глубины тканей, и не допускает попадания на фотоприемники света, отраженного от поверхности кожи, за счет плотного прилегания к ней подвижной световодной головки. Тем самым значительно ослабляется мешающее влияние пигментации кожи.
По существу прибор «Билитест» определяет концентрацию билирубина в дерме путем прямого фотометрирования. Поскольку стандарты концентрации билирубина в дерме отсутствуют (и вряд ли могут быть созданы), прибор отградуирован в условных единицах, которые названы в соответствии с международной практикой «транскутанным билирубиновым индексом» (ТБИ). Клиническая значимость ТБИ определяется его хорошей корреляцией с концентрацией билирубина в крови новорожденных.
Прибор откалиброван таким образом, чтобы при измерении в области лба новорожденного концентрация общего билирубина в сыворотке (плазме) крови (в микромолях на 1 л) примерно соответствовала показателю ТБИ, умноженному на 10. Эта калибровка прибора «Билитест» устанавливалась для новорожденных без ярко выраженной пигментации кожи (белая раса). В других случаях соответствие между ТБИ и концентрацией билирубина в крови должно определяться пользователями прибора самостоятельно путем сравнения показаний с данными лабораторных исследований.
Особенности транскутанной билирубинометрии
Метод транскутанной билирубинометрии является скрининговым и служит для выделения группы риска по развитию тяжеленной гипербилирубинемии. Использование устройства "Билитест-М" дозволяет ограничить круг новорожденных, у каких требуется взятие крови для исследования на билирубин. Прибор "Билитест-М" дает возможность детализированного наблюдения за динамикой желтухи новорожденных и эффективностью проведения терапии.
Контроль. Для проверки правильности показаний устройства в комплекте поставки имеются особые светофильтры (контрольные меры). Никакие другие средства не требуются для контроля работоспособности устройства.
Технические характеристики:
| диапазон измерений | 0-40 ед. ТБИ (0-400 мкмоль/л) |
| коэффициент корреляции с сывороточным билирубином | не менее 0,9 |
| число разрядов на цифровом табло | 2 |
| погрешность измерения, ед. ТБИ | ± 2 |
| размеры, мм | 171х70х37 |
| вес, кг | 0,3 |
| источник питания | 3 элемента типа ААА |
| число измерений без замены питания | не менее 100 000 |
Определение билирубина в моче
Различные качественные методы обнаружения билирубина в моче основаны на превращении этого вещества под действием окислителей в биливердин, имеющий зеленую окраску, или билирубинпурины (красное окрашивание).
Проба Розина. В пробирку с 4–5 мл мочи осторожно по стенкам наливают 1% спиртовой раствор йода. При наличии в моче билирубина на границе мочи и раствора йода образуется зеленое кольцо.
В качестве окислителей используют также растворы трихлоруксусной кислоты (проба Фуше), диазотированную сульфаниловую кислоту (проба Готфрида) и другие окислители.
У здорового человека с мочой выделяются минимальные количества связанного (прямого) билирубина, которые не определяются описанными качественными реакциями.
Метод «сухой химии» с помощью диагностических полосок
Диагностические полоски на билирубин наиболее разумно использовать в следующих случаях:
1. Как часть общего анализа мочи;
2. Раннее выявление обтурационной желтухи;
3. Для дифференциальной диагностики желтух;
4. Для контроля при лечении обтурационного и вирусного гепатита;
5. При обследовании рабочих, контактирующих с гепатотоксическими препаратами;
6. В качестве скрининг-теста у пациентов, принимающих потенциально гепатотоксические препараты.
Принцип теста
Реакционная зона содержит р-нитрофенилдиазониевый-р-толуолсульфонат, натриевый бикарбонат и сульфосалициловую кислоту. Тест на билирубин в моче является одним из самых специфичных и чувствительных. При контакте с конъюгированным билирубином через 30 секунд появляется сиреневато-бежевая (сиреневато-розовая) окраска, интенсивность которой зависит от количества определяемого билирубина.
Специфичность и чувствительность
Тест является специфичным для конъюгированного билирубина. Сиреневато-бежевая (сиреневато-розовая ) окраска реакционной зоны тест-полоски появляется уже при концентрации билирубина 2,5 - 3 мг/л или 4-5 мкмоль/л (Плива-Лахема [Иктофан и др], Биосенсор АН [Урибилир, Уриполиан-2 и др.]). У некоторых производителей (YD-Диагностика, FDI и др.) чувствительность зоны составляет 8-9 мкмоль/л.
Влияние посторонних факторов
Аскорбиновая кислота в очень высоких концентрациях (примерно 500 мг/л) вызывает слабое розовое окрашивание, которое можно принять за положительный тест. В присутствии уробилиногена в концентрации свыше 60 мг/л, т.е. 102 ммоль/л цвет реагирующей на билирубин реактивной зоны принимает слабо-оранжевый оттенок. В этом случае рекомендуется считывать тест не раньше, чем через 2 минуты после смачивания реакионной зоны.
Оценка теста
Положительным результат теста считается в том случае, если меняется цвет реакционной зоны. В присутствии связанного билирубина исходный светло-кремовый цвет переходит в сиреневато-бежевый (сиреневато-желтый в зависимости от производителя). Интенсивность появляющейся окраски сравнивается с цветной шкалой на упаковке. Если цвет попадает между цветами соседних этикеток, то результат должен оцениваться следующим образом.
Пример цветовых шкал различных фирм-производителей:
отрицательный положительный
![]()
![]()
![]()
![]()
0,0 9,0 17,0 50,0 мкмоль/л
neg+ ++ +++
отрицательный положительный
![]()
![]()
![]()
![]()
0,0 9,0 17,0 50,0 мкмоль/л
neg+ ++ +++
Список авторитетных производителей и наименование их продукции:
Bayer (Мультистикс), Roche (Комбур-Тест), Биосенсор АН (Урибилир, Уриполиан-2), Macromed (Макромед), DFI (Сайбоу), Плива-Лахема (Иктофан, Пентафан), YD Diagnostic (Урискан), Biosite (), IND Diagnostic (IND), Macherey-Nagel (Меди-Тест), Dirui (Уристик).

Определение уробилина в моче
Определение уробилина в моче также основано на образовании окрашенных в розовый или красный цвет соединений при взаимодействии уробилина с HCl, сульфатом меди или реактивом Эрлиха (парадиметиламинобензолальдегидом).
Проба Нейбауэра. К 3–4 мл свежевыпущенной мочи добавляют 3–4 капли реактива Эрлиха (парадиметилбензолальдегида). Окрашивание мочи в красный цвет свидетельствует о диагностически значимом повышении концентрации уробилина в моче.
У здорового человека с мочой выделяются следы уробилина (не более 5–6 мг в сутки), которые не выявляются обычными качественными реакциями.
Определение стеркобилина и билирубина в кале
В норме у взрослого человека с калом выделяется за сутки около 300–500 мг стеркобилина, придающего испражнениям характерную коричневую окраску. (Стеркобилин является конечным продуктом восстановления билирубина, выделяющегося в кишечник из общего желчного протока. Эта реакция протекает под действием нормальной микробной флоры кишечника. Характерно, что у новорожденных и детей грудного возраста с калом выделяется неизмененный билирубин, в связи с чем испражнения имеют характерный зеленоватый цвет).
Качественное определение
стеркобилина в кале основано на реакции этого вещества с двуххлористой ртутью (сулемой), в результате которой образуется
8-09-2015, 23:30
