Реферат студентки II лечебного факультета Аветян А.С
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
ВВЕДЕНИЕ
При введении в организм животных и человека чужеродных макромолекулярных веществ — белков или полисахаридов (антигенов) в крови появляются защитные белки - антитела, для которых характерна необыкновенная, уникальная специфичность. Каждое антитело узнает только свой антиген, -точнее, одну его детерминантную группу. Детерминантная группа состоит из нескольких аминокислот (обычно из 6—8), образующих пространственную структуру, характерную для данного белка.
В одном белке, состоящем из нескольких сот аминокислот имеется несколько (5-15) разных детерминант, поэтому к одному белку образуется целое семейство различных по своей специфичности антител. Даже к одной детерминанте образуется целый спектр антител, отличающихся по структуре, степени специфичности и прочности связывания с ней. То же относится и к полисахаридным антигенам, детерминантные группы которых образуются 3—6 остатками моносахаридов.
Таким образом, при введении антигена возникает большое семейство антител, направленных к разным его детерминантам и различающихся так же внутри группы антител, направленных к одной и той же детерминанте. В крови иммунизированных животных появляется богатый и уникальный по составу спектр антител, который и обеспечивает абсолютную специфичность в распознавании данного антигена.
Антитела давно и широко используются для нейтрализации бактериальных токсинов (дифтерийного, столбнячного), змеиных ядов (кобры, гадюк) вирусов, попавших в кровь (особенно эффективно вируса кори), и для идентификации индивидуальных белков (и других антигенов), находящихся в клетке или сложнейших тканевых экстрактах. Однако иногда требуются не многокомпонентные смеси антител, возникающие в крови в ответ на введение антигена, а отдельные, элементарные составляющие этой смеси, направленные лишь к одной детерминанте антигена и имеющие одни и те же характеристики. Такие антитела бывают нужны как для изучения их собственной природы, так и для практического использования, например для ставки в опухоли токсических веществ.
КАК ПОЛУЧИТЬ ТАКИЕ АНТИТЕЛА?
Очевидно, что путем иммунизации, то есть введением животному индивидуального антигена или только одной его детерминантной группы, это сделать, как правило, невозможно. Почему? Дело в том, что в организме в процессе созревания антителообразующих клеток (АОК) образуется большое количество — миллионы генетически однородных семейств клеток — клонов, каждый из которых специализируется на синтезе только одного варианта антител, и в этом причина большого разнообразия антител, индуцируемых даже одним антигеном. Таких клонов много больше, чем требуется антител для распознавания любого, случайно взятого антигена. Антиген, попадая в организм, стимулирует размножение тех клонов, которые продуцируют антитела к его детерминантам.
Казалось бы, выход прост: надо вырастить отдельные клоны антителообразующих клеток в пробирке - в культуре тканей - и они будут продуцировать моноклональные антитела, то есть антитела одной строго определенной специфичности, продукт одного клона. Но и это оказалось невозможным: нормальные клетки смертны, вскоре после высаживания в культуру они погибают. Дело не доходит до образования клонов АОК. Добавление в культуру факторов роста несколько продлевает их жизнь, но тоже не решает проблемы.
ДОРОГУ УКАЗЫВАЮТ ОПУХОЛИ
Путь решения проблемы неожиданно указали злокачественные опухоли. Уже давно известны опухоли у человека — плазмоцитомы, вырабатывающие и секретирующие в кровь иммуноглобулины, по структуре своей неотличимые от антител. Причем каждое такое "антитело" слегка отличалось от другого, вырабатываемого другой плазмоцитомой. Образовывалась как бы коллекция случайных антител к неизвестным антигенам. Когда накопились сотни таких "антител" и они были испытаны с сотнями наугад взятых антигенов, оказалось, что в этой коллекции обнаружились специфически реагирующие пары "антиген—антитело".
Почему именно опухоли указали на возможность получения моноклональных антител? Есть несколько причин, и все они коренятся в самой природе опухолевой клетки. Она всегда или почти всегда сохраняет свойства и функции клетки, из которой произошла. Плазмоцитома происходит из "юных" плазматических клеток, то есть как раз из тех клеток, которые синтезируют антитела. Это свойство сохраняется в опухолях, возникших из соответствующих клеток. Очень важной особенностю опухолей является их возникновение из одной генетически измененной (мутантной) клетки. Поэтому опухоль возникает и развивается как клон, в нашем случае как клон иммуноглобулинобразующих клеток. Причем они образуют строго однородный по всем свойствам моноклональный иммуноглобулин.
Нормальные плазматические клетки (или их предшественники - лимфоциты) смертны, их срок жизни - несколько дней. Опухоль, и в этом ее принципиальное отличие от нормальных предшественников, бессмертна. Ее можно культивировать в пробирке или пересаживать от одного животного другому неограниченное число раз и в течение неограниченного времени. В отличие от нормальной ткани опухоль автономна, организм "хозяина" неспособен (за очень редкими исключениями) остановить неограниченный рост злокачественного опухолевого клона.
Плазмоцитомы возникают не только спонтанно, то есть непредсказуемо, как бы случайно, но их можно довольно легко индуцировать у мышей и крыс и получить, таким образом, бессмертный, неограниченно растущий, перевиваемый клон клеток, продуцирующих иммуноглобулины, иногда обладающие специфичностью антител, причем антител моноклональных. Вполне естественно было желание иммунологов научиться получать плазмоцитомы, продуцирующие антитела заданной специфичности. Для этого мышей вначале интенсивно иммунизировали, а затем индуцировали у них плазмоцитомы, чтобы получить опухоли и из тех клонов, которые производили антитела к антигенам, использованным для иммунизации, но это практически не удавалось. Слишком редки были совпадения. Тогда попробовали индуцировать опухоли антителообразующих клеток опухолеродными вирусами. Результаты были лучше, однако создать простой и универсальный метод получения моноклональных антител на этом пути также не оказалось возможным.
КАК ЭТО БЫЛО СДЕЛАНО?
Успех пришел, как всегда, неожиданно, как побочный продукт исследования, имевшего иные цели. В начале 70-х годов молодой немецкий иммунолог Георг Кёлер, получивший стипендию для работы в знаменитом Базельском институте иммунологии, заинтересовался вопросом о генетической изменчивости антител. В то время можно было ожидать, что антитела мутируют (генетически изменяются) с большей частотой, чем другие белки. Для исследования надо было изолировать клон АОК, продуцирующий антитела определенной специфичности, получить из него стабильную клеточную линию, поддерживаемую в пробирке (в культуре), и проследить, с какой частотой появятся там генетически измененные варианты. Для реализации проекта Кёлер поехал в Англию, в лабораторию Цезаря Мильштейна, изучавшего клоны плазмоиитом, и они вместе разработали оригинальный подход к этой проблеме: решили получить гибрид нормальной АОК и опухолевой клетки. В случае успеха такой гибрид унаследовал бы от нормальной клетки способность к синтезу антител, а от опухолевой — бессмертие и способность к неограниченному и бесконтрольному росту. Это им удалось осуществить?
ГИБРИДОМЫ
Методы гибридизации соматических (то есть не половых) клеток к тому времени были хорошо известны и широко применялись для разных целей. Для этого использовали вирус, способствующий слиянию клеток. Разнородные клетки, у которых слились оболочки, образовывали двуядерные гибриды, которые сохраняли способность к клеточным делениям. В процессе клеточного деления хромосомы обоих ядер перемешивались и образовывали общее ядро. Таким образом, возникал истинный гибрид, потомок двух соматических клеток, или гибридома. Гибридому можно получить и между нормальной АОК и опухолевой, плазмоцитомной клеткой. Плазмоцитома была взята потому, что она больше всего соответствовала АОК по типу дифференцировки. Весь ее синтетический аппарат был настроен на синтез иммуноглобулинов. Проблема заключалась в том, как отделить заданную гибридому от присутствующих в системе отдельных неслившихся клеток и от гибридов иного состава или иной специфичности, чем требуемые.
Для достижения этой цели авторы разработали специальную схему, использующую отбор клеток в селектирующей среде. Прежде всего был получен особый мутант мышиной плазмоцитомы, рост которого можно было контролировать составом питательной среды. Для получения мутанта использовали особенности синтеза нуклеиновых кислот (ДНК и РНК), имеющихся во всех клетках и необходимых для их существования. Известно, что имеются два пути синтеза предшественников нуклеиновых кислот: основной и резервный. Основной — это путь новообразования нуклеотидов, звеньев, входящих в состав нуклеиновых кислот. Этот путь включает несколько этапов и блокируется противоопухолевым препаратом аминоптерином (А). Однако клетки не гибнут от этого препарата, поскольку обладают резервным путем — способностью синтезировать нук-леотиды и нуклеиновые кислоты, реутилизируя продукты распада ранее синтезированных нуклеиновых кислот: гипоксантина (Г) и тимидина (Т). Добавление Г и Т в питательную среду, содержащую А, снимает токсический эффект последнего.
Для селекции гибридом надо было получить мутант плазмоцитомы, не способный пользоваться резервным путем и, следовательно, погибающий в среде, содержащей Г, Т и А (ГАТ-среда). Такой мутант получили путем добавления в среду токсических аналогов Г и Т. Все клетки, способные усваивать Г и Т, включали их токсичные аналоги и погибали. Выживали лишь те редкие мутанты, которые неспособны усваивать Г и Т, то есть были лишены резервного пути. Из потомства этих клеток дополнительно отбирали еще и такие мутанты, которые утратили способность к синтезу собственных иммуноглобулинов. Теперь все было готово для получения гибридом, то есть гибридов нормальных плазмоцитомных клеток (рис. 1).
Мышей интенсивно иммунизировали определенным материалом — белком, бактериальной или клеткой животного происхождения. Когда в их крови появлялись антитела, у них брали селезенку и лимфатические узлы (места скопления АОК), и из них готовили взвесь клеток.
К ней добавляли в избытке клетки мутантной плазмоцитомы и полиэтиленгликоль (ПЭГ). После короткой инкубации, требующейся для слияния клеток, их отмывали от ПЭГа и помещали в среду, содержащую Г, Т и А (ГАТ-среда). Теперь в системе находились гибриды АОК и АОК, АОК и плазмоцитомы, а также оставшиеся свободными АОК и клетки плазмоцитомы. Из них нужно было отобрать только гибриды АОК и плазмоцитомы. После недолгого (несколько дней) культивирования одиночные АОК, а также гибриды АОК и АОК погибали, так как нормальные клетки смертны и быстро погибают в культуре. Плазмоцитомные клетки и их гибриды также погибали, так как А блокировал основной путь синтеза предшественников нуклеиновых кислот, а Г и Т их не спасали. Выживали, следовательно, только гибриды АОК и плазматических клеток, так как бессмертие они унаследовали от плазмоцитомы, а резервный путь - от нормальной клетки. Такие гибриды, гибридомы, сохраняли способность синтезировать и секретировать антитела.
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
Следующий этап после получения гибридом — клонирование и отбор нужных клонов. Выжившие в ГАТ клетки рассевали в специальные пластиковые планшеты, содержащие обычно 96 лунок емкостью примерно по 0,2 см3 . В каждую лунку помещали в среднем по 10 гибридомных клеток, которые культивировали в присутствии "кормящих" клеток, не имеющих отношения к гибридомам, но способствующих их росту. После нескольких дней культивирования содержимое каждой лунки проверяли на присутствие антител нужной специфичности. Для этого использовали микрометоды выявления антител к соответствующему антигену. Клетки из лунок, содержащих нужные антитела, клонировали, то есть повторно рассевали по таким же лункам, но из расчета 1 клетка на лунку, вновь культивировали и проверяли на присутствие нужных антител. Процедуру повторяли 1-2 раза. Таким образом, отбирали клоны, продуцирующие антитела только одной нужной специфичности, то есть моноклональные антитела. Полученные клоны можно заморозить при -70°С и хранить до того, пока они не потребуются. Их можно культивировать и накапливать антитела в культуральной среде, а можно привить мышам (так как гибридомы - это опухолевые клетки), где они будут расти и накапливать колоссальные количества моноклональных антител. От одной мышки можно получить антител не меньше, чем от кролика. Эти антитела не содержат посторонних антител и настолько однородны физико-химически, что могут рассматриваться как чистые химические реактивы.
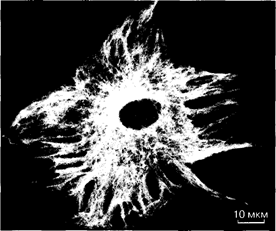
Рис. 2. Иммунофлуоресцентное окрашивание клетки соединительной ткани (фибробласта) моноклональным антителом к тубулину - белку микротрубочек, образующих скелет клетки.
ПРИМЕНЕНИЕ
Области применения моноклональных антител:
- идентификация субпопуляций лимфоцитов человека
- истощение клеточных популяций
- выделение клеток
- установление функций молекул клеточной поверхности
- определение группы крови - диагностика опухолей
- локализация опухолей
- иммунорадиометрический анализ
- анализ сложных смесей антигенов
- анализ эмбрионального развития
- моноклональные мутантные антитела
- квадромы
- анализ иммунного ответа
- искусственные ферменты.
Обычные поликлональные антитела давно и широко применяются для определения биологически активных веществ - белков крови и других биологических жидкостей, гормонов, ростовых факторов, клеточных рецепторов, медиаторов воспаления и иммунитета, бактериальных и вирусных антигенов, различных ядов и т.п. Моноклональные антитела из-за высочайшей специфичности, стандартности и технологичности получения успешно вытесняют и заменяют иммунные сыворотки.
Далее гибридомы создают уникальные возможности в аналитических целях: их можно применять как "иммунологический микроскоп" с чрезвычайно высоким разрешением. Так, например, если нужно сравнить две клеточные линии, отличающиеся одним или немногими антигенами, и надо выявить такие антигены, то метод гибридом предоставляет для этого исключительные возможности. Проиммунизировав мышей одной из линий и получив сотни гибридом, продуцирующих антитела к антигенам этой линии, можно найти одну или две с антителами только к данной линии. Размножив такую гибридому в пробирке или вырастив ее на мышах, можно получить огромное количество антител к уникальному антигену (или детерминантной группе), затерянному среди других компонентов клетки подобно иголке в стоге сена. Это будет продукт одного клона. В крови иммунизированного животного среди множества других антител он никак не проявится из-за чисто количественных отношений. Благодаря же гибридомам его можно не только обнаружить, но и вывести в линию и получить любое количество соответствующих антител. С помощью гибридом можно обнаружить антигены, характерные для опухолей определенных тканей, получить к ним антитела и использовать их для диагностики и типирования опухолей.
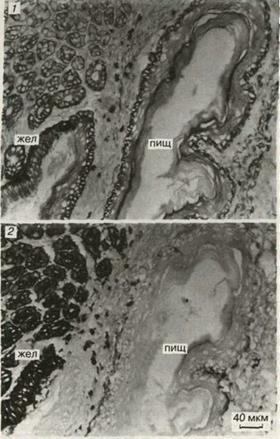
Рис. 3. Последовательные срезы через желудок (жел) и пищевод (пищ) мыши, окрашенные двумя моноклональными антителами: 1 - первое моноклональное антитело реагирует с эпителием пищевода и слабее с эпителием желудка; 2 - второе моноклональное антитело реагирует только с эпителием желудка.
Такие моноклональные антитела нашли широкое применение в онкологической клинике. Наконец, во всем мире ведутся активные исследования по использованию моноклональиых антител в качестве специфических переносчиков токсических веществ в опухолевые клетки. Пока же с помощью моноклональных антител в опухоль и ее метастазы доставляются радиоактивные вещества, позволяющие обнаружить небольшие узелки опухоли по локализации в них радиоактивности.
Гибридомы сыграли и продолжают играть огромную роль в фундаментальной и прикладной иммунологии. Они созданы на основе клонально-селекционной теории иммунитета и явились самым ярким и окончательным доказательством этой теории. Гибридомы сделали реальностью предполагаемые клоны антителообразующих клеток и позволили даже обнаружить их существование в организме до введения соответствующего антигена. Гибридомы революционизировали иммунологическую промышленность и создали в ней совершенно новые области. Благодаря гибридомам возникли методы диагностики многих заболеваний и появились новые пути для изучения злокачественных опухолей. И хотя гибридомы скорее относят к гениальным изобретениям, а не к открытиям, они были отмечены в 1984 году Нобелевской премией, высшей научной наградой, присуждаемой за выдающиеся открытия. (Келер и Мильштейн)
К настоящему времени получено громадное количество гибридом-продуцентов моноклональных антител к различным, в том числе к опухоле-ассоциированным антигенам. Наиболее популярными препаратами МКА в настоящее время являются Мабтера и Герцептин (Швейцария). Первый применяется для лечения некоторых злокачественных заболеваний крови человека, второй - при раке молочной железы. Эти антитела специфически связываются с антигеном злокачественных клеток, вызывая их гибель в результате каскада иммунологических реакций. Первые клинические результаты применения Мабтера показали, что у 50% пациентов с большими опухолями и рецидивами при неблагоприятном прогнозе заболевания наступает стабилизация процесса. Герцептин сравнительно недавно вошел в арсенал терапевтических средств, применяемых в онкологии, но уже зарекомендовал себя как эффективный препарат при раке молочной железы, устойчивом к обычному лечению. Использование Герцептина у больных раком молочной железы вместе с химиопрепаратами позволяет повысить эффективность лечения особенно в тех случаях, когда заболевание не поддается обычной химиотерапии. Интенсивные работы по получению новых моноклональных антител и разработке на их основе лекарственных и диагностических средств ведутся и в нашей стране. Перспективным является еще одно направление. Это - использование моноклональных антител для создания иммуномагнитного фильтра, "сорбента". Сущность метода состоит в том, что привязанные к ферромагнитным микрочастицам моноклональные антитела, находясь в магнитном поле, могут высоко специфично извлекать клетки, например, из костного мозга или из опухоли. Затем иммуномагнитный сорбент отделяют и остаются только извлеченные клетки. С помощью такого сорбента можно связывать и удалять клетки (например, злокачественные) или получать из костного мозга здоровые клетки - родоначальники кроветворения, которые могут использоваться для введения этому же больному в случае повреждения кроветворения.
ЛИТЕРАТУРА
1. Кеннет Р.Г., Мак-Керн Т.Дж., Бехтол К.Б.
Моноклональиые антитела: Гибридомы: новый уровень логического анализа. М.: Медицина, 1983.
2. Роит А. Основы иммунологии. М.: Мир, 1991.
3. А.Ю. Барышников, Е.Р. Полосухина. Моноклональные тела в онкологии.
4. Г.И. Абелев. Моноклональные антитела.
8-09-2015, 23:44
