Реферат.
Дипломная работа на тему: «Биохимические показатели крови человека при сальмонеллезной интоксикации» содержит 46 страниц печатного текста, таблиц, 8 рисунков, 59 использованных источников литературы, из них 10 иностранных.
Перечень ключевых слов: сальмонеллез, перекисное окисление липидов, циркулирующие иммунные комплексы, каталаза, молекулы средней массы, сывороточный альбумин, эндогенная интоксикация.
Объект исследования: сыворотка крови практически здоровых людей и больных сальмонеллезом г. Пензы.
Практическое применение: в здравоохранении.
Список сокращений.
ПОЛ – перекисное окисление липидов;
ЦИК – циркулирующие иммунные комплексы;
ЧСА – человеческий сывороточный альбумин;
МДА – малоновый диальдегид;
ПЭГ – полиэтиленгликоль;
АОС – антиокислительная способность;
АТ – антитело;
АГ – антиген;
ИК – иммунный комплекс;
ЛПС – липополисахаридный комплекс;
МСМ – молекулы средней массы;
ТБК – тиобарбитуровая кислота;
ЭКА – эффективная концентрация альбумина;
ОКА – общая концентрация альбумина;
ТХУ – трихлоруксусная кислота;
ЦНС – центральная нервная система;
ц-АМФ – циклический аденозинмонофосфат;
АФК – активные формы кислорода;
LOOH, HOOH – гидроперекиси;
СОД – супероксиддисмутаза.
Содержание.
Введение……………………………………………………………….. 1. Обзор литературы ………………………………………………... 1.1. Биохимическая характеристика интоксикации при сальмонеллезной инфекции…………………………..…….. 1.2. Молекулярные механизмы развития эндогенной интоксикации при сальмонеллезе……………………..….. 1.3. Показатели уровня эндогенной интоксикации организма при сальмонеллезе………………………………. 2. Материалы и методы исследования…………………………. 2.1. Материалы исследования……………………………………. 2.2. Методы исследования………………………………………… 3. Результаты и обсуждение………………………………….…… 3.1. Определение показателей уровня интоксикации в сыворотке крови практически здоровых людей…….. 3.2. Определение показателей уровня интоксикации в сыворотке крови больных сальмонеллезом………….….. Список использованных источников……………………….….. Выводы…………………………………………………………………. Приложения……………………………………………………………. |
5-6 7-19 7-11 11-14 14-19 20-25 20 20-25 26-34 26-27 28-34 35-40 41 42-46 |
Введение
Успехи в борьбе с инфекционными заболеваниями в нашей стране общепризнанны. Вместе с тем в инфектологии еще остаются проблемы, имеющие серьезное социально-экономическое значение для всех стран мира. К их числу относятся острые кишечные инфекционные заболевания [1].
Сальмонеллез – группа острых кишечных инфекционных болезней, вызываемых бактериями рода Salmonella, характеризующихся значительным полиморфизмом клинического течения, частым наличием интоксикации, лихорадки, признаков поражения желудочно-кишечного тракта [2].
Крупные достижения отечественных и зарубежных исследователей, установивших патогенетическое значение нарушения биологической регуляции при острых кишечных инфекциях, дали новый импульс в изучении патогенеза сальмонеллеза [3].
Иммунная система представляет собой сложную многокомпонентную систему из быстроделящихся и покоящихся клеток. Она является высокочувствительной к воздействию токсинов бактерий. Это приводит к нарушению иммунорегуляторных процессов.
Наиболее информативными являются показатели состояний прооксидантно-антиоксидантного равновесия, которое при усилении действия на организм токсинов смещается в сторону активизации ПОЛ, уровня холестерина, ЦИК, Ит, МСМ.
ПОЛ – это фундаментальный универсальный молекулярный механизм, лежащий в основе устойчивости и адаптационных возможностей организма. В норме ПОЛ обеспечивает условие для жизненно важных функций клетки, в случае же интоксикации становится пусковым механизмом патобиохимических изменений в организме человека.
Целью моей дипломной работы является изучение биохимических показателей эндотоксикоза в динамике патологического процесса. В задачи исследования входило:
1. Определение содержания МДА, уровня холестерина, ЦИК, Ит, МСМ и активности каталазы в группе контроля, которую составили практически здоровые люди.
2. Определение содержания МДА, уровня холестерина, ЦИК, Ит, МСМ и активности каталазы у больных сальмонеллезом.
3. Исследование изменения изучаемых показателей у больных в зависимости от степени тяжести заболевания.
1. Обзор литературы
1.1. Биохимическая характеристика интоксикации при сальмонеллезной инфекции
Сальмонеллезы принадлежат к числу инфекционных заболеваний, весьма широко распространенных на всех континентах мира. Возбудителем сальмонеллезов являются микроорганизмы, принадлежащие к роду Salmonella, семейства кишечных Enterobacteriaceae.
Сальмонеллы – это мелкие бактерии вытянутой формы с закругленными концами длиной от 1 до 3 и диаметром 0,5-0,8 нм [4].
Сальмонеллез встречается чаще у жителей городов, чем сел, что связывается с лучшей регистрацией заболеваемости, наличием множественных детских учреждений, широким употреблением пищевых полуфабрикатов. Заболевание отмечается круглый год, но максимальное число регистрируется в теплое время года, что объясняется благоприятными условиями размножения сальмонелл в пищевых продуктах и реализации инфекции [5].
Таблица 1.1.1.
Статистические данные больных сальмонеллезом г. Пензы.
| Год | Количество больных г. Пензы |
На 100 тыс. населения, % | Кол-во больных Пензенской области |
На 100 тыс. населения, % |
| 1996 | 187 | 34,9 | 362 | 23,1 |
| 1997 | 140 | 26,1 | 316 | 20,3 |
| 1998 | 230 | 43,0 | 448 | 28,8 |
В возникновении сальмонеллеза ведущую роль играют живые бактерии, гибель которых в организме больного сопровождается развитием эндотоксинемии. Принято выделять два вида токсичных продуктов жизнедеятельности микробов-экзотоксии и эндотоксии. К экзотоксинам отнесены токсичные продукты жизнедеятельности бактерий, активно (при жизни) секретируемые в окружающую среду, а к эндотоксинам – те ядовитые для макроорганизма продукты жизнедеятельности, которые освобождаются только при лизисе микробной клетки [6].
Кроме токсина палочка имеет ряд антигенов клеточной стенки. О-антиген расположен на поверхности микробной клетки и представляет собой фосфолипидно-полисахаридный комплекс, включающий 60 % полисахарида, 20-30 % липида и 3-4,5 % гексозамина. Н-антиген определяется жгутиками. Поверхностные антигены клеточной стенки провоцируют типоспецифический антительный ответ, а глубинные – видоспецифический [6,7].
При сальмонеллезе развитие и тяжесть симптомов обусловлены интоксикацией и обезвоживанием. По мнению А.Ф. Билибина интоксикация – явление сложное, сводящееся к изменению нервнорефлекторной деятельности и гуморальной регуляции с обменными сдвигами. К.В. Бунин в основу синдрома интоксикации ставит воздействие токсина на :
1) падение артериального давления, снижение сократительной способности миокарда;
2) гормональную регуляцию водно-солевого обмена с изменениями биосинтеза гормонов в коре надпочечников с угнетением процесса их метаболизма;
3) функцию почек (снижение клубочковой фильтрации, повышение канальцевой реабсорбции воды, снижение концентрации очищения мочевины) [8].
Сальмонеллезная интоксикация возникает как результат патологии первичного ответа на инфекционный агент вследствие значительных потерь воды и электролитов с рвотой и жидким стулом. По мере увеличения дефицита воды и электролитов на первый план выступают симптомы обезвоживания и поражения ЦНС. Если процесс прогрессирует, обезвоживание нарастает, появляются признаки недостаточности кровообращения, которые при интоксикации имеют клинику шока. Частая рвота и понос – первые признаки интоксикации [9].
Обязательным условием развития заболевания являются наличие большого количества возбудителей и их токсинов, массовое проникновение антигенов в кровь. Наибольшей токсичностью отличается липид А, вызывающий следующие основные реакции: активацию лейкоцитов и макрофагов, стимуляцию выброса эндогенного пирогена, антогониста глюкокортикоидов, интерферона, интерлейкинов, подавление тканевого дыхания, активацию системы комплемента, тромбоцитов, факторов свертывания крови другие [10,11], [рис. 1.1.1].
Главной причиной развития шока при сальмонеллезе считается не повреждающее действие самих микробов или их токсинов, а своеобразный ответ организма на них. Под токсико-инфекционным шоком следует понимать экстремальное состояние организма, наступающее в результате действия токсичных субстанций возбудителей, патогенных иммунных комплексов на органы и ткани организма, сопровождающееся острым нарушением метаболизма в них [12].
Схематическое изображение липополисахаридов
стенок микробов.
 |
Рис. 1.1.1.
С.А. Степанов с помощью аспирационной биопсии обнаружил в тонкой кишке больных сальмонеллезом изменение эпителия, острое воспаление слизистой оболочки, нарушение микроциркуляции и сосудистой проницаемости. К.Х. Ходжаев в эксперименте на крысах показал, что сальмонеллезная инфекция вызывает нарушение процесов тканевого дыхания и фосфорилирования. Состояние поджелудочной железы изучено Белянской Т.А. В острый период болезни отмечено снижение ферментативной активности панкреатического сока – уровень трипсина был снижен в 71 % случаев, липазы в 55 %, амилазы – в 66 %.
Таким образом эндотоксин вызывает активацию синтеза, преимущественно протеолитических ферментов, задержку экструзии секретируемых проэнзимов, что приводит к секреции и поступлению ферментов в лимфатическое и кровеносное русло [13,14].
При сальмонеллезе развивается обезвоживание, обусловленное потерей внеклеточной жидкости, а при тяжелом течении заболевания и части клеточной. Дегидратация в большинстве случаев имеет изотонический характер, сочетаясь с развитием сгущения крови, дефицитом электролитов, метаболическим ацидозом в капиллярной и венозной крови [15], [рис. 1.1.2].
1.2. Молекулярные механизмы развития эндогенной
интоксикации при сальмонеллезе
Явления интоксикации вызывают заболевания, сопровождающиеся повышенным распадом тканей, усиленными процессами катаболизма, недостаточностью функции печени и почек, снижением процессов микроциркуляции [16].
В ответ на действие первичного патогена, которым являются эндотоксины, сальмонелл, в организме развиваются типовые каскадные реакции, что лежит в основе современной концепции СЭИ.
На Международном симпозиуме в Санкт-Петербурге (1994 г) было дано определение этого синдрома как клинического синдрома с проявлением симптомов интоксикации при патологических состояниях неоднородных по этиологии и обуславливающих накопление в тканях и биологических жидкостях организма продуктов патологического обмена веществ, метаболитов, деструкции клеточных и тканевых структур, разрушения белковых молекул [17,18].
Шано В.П. с соавторами подчеркивает, что токсическое влияние липополисахаридной субстанции эндотоксина проявляется комплексом нарушений, обусловленных повреждением как циркулирующих клеток в кровотоке, так и эндотелиоцитов, эозинофилов, нейтрофилов, макрофагов, следствием чего является выброс в кровоток ряда биологически активных веществ – цитокинов, интерлейкинов. Главной точкой приложения эндотоксина являются эндотелиальные клетки, активация их приводит к высвобождению простациклина, выделению эластазы, токсических метаболитов кислорода, факторов активации тромбоцитов и комплемента с высвобождением терминального комплекса комплемента, брадикинина с последующим формированием синдрома повышенной проницаемости капилляров. Это приводит к тому, что в очаг воспаления начинают входить компоненты крови, прежде всего фибриноген и тромбоциты. Фибрин способствует агрегации тромбоцитов, полимеризации фибрина и – возникновению тромбов. Следствием тромбоза являются нарушения микроциркуляции с последующей гипоксией, что приводит к дальнейшим повреждениям клеток в очаге воспаления. Метаболическим результатом этого является изменение аэробного метаболизма клеток на анаэробный, повышенное продуцирование лактата и протонов, снижение показателей рН [19].
Среди тканевых (клеточных) медиаторов воспаления важное место занимают простагландины. Исходными продуктами для биосинтеза простагландинов являются ненасыщенные жирные кислоты: линолевая, арахидоновая, пентаноевая. Наибольшее значение имеет в организме арахидоновая кислота, которая содержится в фосфолипидах клеточных мембран.
Простагландины вызывают сильное диуретическое и натрийуретическое действие, оказывают разнообразное действие на желудочно-кишечный тракт. Они могут стимулировать и тормозить сокращение и секреторную активность тонкой кишки, тормозят секрецию соляной кислоты слизистой оболочки желудка. Простагландины вызывают секрецию воды и электролитов в просвет кишки, вызывая диарею, повышают концентрацию ц-АМФ в слизистой оболочке тонкой кишки, влияют на прочность и упругость эритроцитарной мембраны [20, 21, 22, 49].
1.3. Показатели уровня эндогенной интоксикации
организма при сальмонеллезе
Анализируя данные литературы за последние десятилетия, можно сказать, что основными показателями интоксикации при сальмонеллезе являются ПОЛ, уровня холестерина, ЦИК, ИТ, МСМ и активность каталазы. При развитии интоксикации на фоне сальмонеллеза происходит активный хемотаксис нейтрофиллов в очаг воспаления, где они поглощая и переваривая чужеродный агент, изменяют свою метаболическую активность, характеризующуюся усилением поглощения кислорода, повышенной утилизацией глюкозы и гиперпродукцией АФК (![]() ) [23, 24].
) [23, 24].
Перекисное окисление является универсальным механизмом взаимодействия кислорода со многими органическими субстратами, в том числе с липидами. Внедрение кислорода в молекулы окисленного субстрата приводит к образованию реакционно-способных промежуточных продуктов – свободных радикалов, гидроперекисей, которые в дальнейшем вызывают повреждение других классов соединений – белков, нуклеиновых кислот, углеводов (рис. 1.3.1).
Метаболизм супероксидного радикала в норме
и при патологии (Владимиров Ю.Я., 1998)
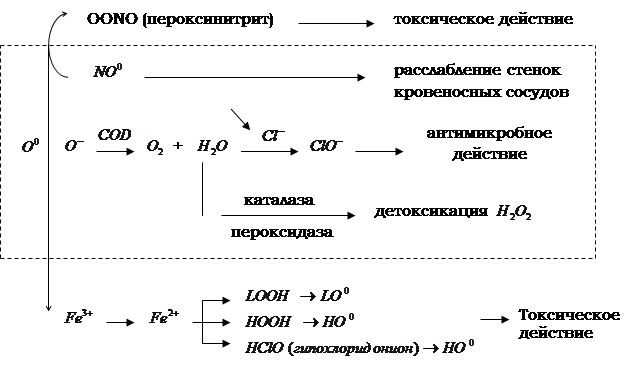
Рис. 1.3.1.
Накопленные к настоящему времени данные литературы позволяют сделать вывод о том, что свободнорадикальное окисление липидов при сальмонеллезной инфекции играет определенную патогенетическую роль [25, 50].
Установлено, что при развитии ПОЛ в биомембранах понижается содержание легкоокисляемых полиненасыщенных жирных кислот и изменяются физико-химические свойства: микровязкость, текучесть, мембранный потенциал, полярность внутренних областей мембран. Таким образом, изменяются транспортные свойства мембраны и активность ферментов [26].
Регуляция свободнорадикального окисления обеспечивается в клетке системой антиоксидантной защиты. Так, накапливающаяся в процессе ПОЛ перекись водорода обезвреживается с помощью каталазы, присутствующей во всех тканях организма. Каталаза (КФ 1.11.1.6.) представляет собой гемсодержащий фермент с молекулярной массой около 250000 Д, локализованный в пероксисомах клеток [27].
Митохондриальная каталаза участвует в оксидазном пути окисления, сопровождающемся запасанием энергии в виде АТФ. Блокирование транспорта электронов в дыхательной цепи приводит к стимуляции пероксисомального окисления. При потологиях, связанных с нарушением энергетических процессов, каталаза пероксисом может выходить из них и участвовать в окислении на мембранах эндоплазматического ретикулума [28, 53].
В работе Л.Б. Оконенко с соавторами о состоянии антиоксидантной системы судили по активности СОД, глутатионпероксидазы и каталазы, анализ данных выявил дефицит антиоксидантов [29, 30].
При инфекционном токсикозе в мембранах эритроцитов резко снижается содержание общих фосфолипидов, но увеличивается количество НЭЖК и лизофосфотидилхолина, что косвенно указывает на повышение активности фосфолилаз, которые избирательно разрушают липиды мембран. Холестерин подвергается как активному, так и пассивному обмену в мембранах эритроцитов [29]. Фермент лецитинхолестеролацил трансфераза превращает эфиры холестерина в свободный холестерин и тем самым регулирует уровень свободного холестерина в плазме, что способствует проникновению его в мембраны. Следовательно, инактивация этого фермента в результате гипоксии при эндотоксикозе ведет к повышению уровня эфиров холестерина в мембранах эритроцитов [31,32].
Наряду с уровнем МДА, активности каталазы и уровня холестерина для диагностики заболевания и его прогноза имеют значение и другие неспецифические показатели – ЦИК, Ит, МСМ.
Синтезирующиеся при формировании иммунитета специфические антитела обладают способностью взаимодействовать с антигенами возбудителей и тем самым вызывать нейтрализацию патогенных микробов и их токсинов. Эта реакция сопровождается образованием иммунных комплексов антиген – антитело [33, 34, 54, 55]. При патологических состояниях образование ИК выходит из под контроля, в результате чего развивается та или иная болезнь ИК [рис. 1.3.2.].
Патогенетические механизмы болезней иммунных
комплексов (Сура В.В., 1987)
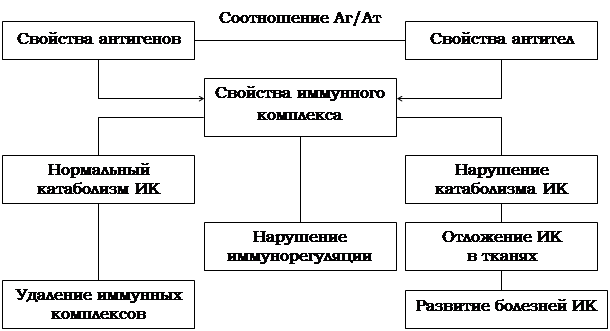 |
Рис. 1.3.2.
В результате развития эндотоксемии при сальмонеллезе организм длительное время контактирует с избытком АГ как экзогенного (компоненты микробных клеток), так и эндогенного (компоненты разрушенных клеток самого организма) происхождения. Вместе с тем наблюдается угнетение системы комплемента, ответственного за лизис микробных клеток. В этих условиях значительного избытка АГ и недостаточности выработки АТ может привести к образованию ИК, которые способны откладываться в определенных тканях и вызывать острые воспалительные реакции. При значительных отложениях наблюдаются функциональные и морфологические повреждения органов и тканей [35].
Связываясь с клеточной мембраной ЦИК вызывают выделение в окружающую среду протеолитических ферментов и основных пептидов. Эти вещества повреждают протеогликановые компоненты тканей, действуют на базальную мембрану и вызывают некроз эндотелиальных клеток [36].
ЦИК наряду с продуктами ПОЛ вызывают нарушение проницаемости мембран, вплоть до их разрыва, что в конечном итоге может привести к гибели клетки. В результате появляются различные вещества пентидной природы. Из них наибольший интерес представляют молекулы средней массы.
Являясь олигопептидами с молекулярной массой 300-5000 Дальтон, они расцениваются как универсальный критерий эндогенной интоксикации и влияют на ее уровень и прогноз [37, 38].
МСМ образуются в организме под воздействием повреждающих эндогенных или экзогенных факторов различного генеза, являются промежуточными продуктами протеолиза. [39, 57].
Пристальное внимание исследователей к МСМ объясняется высокой биологической активностью их отдельных фракций, которые ингибируют гликолиз, глюконеогенез, пентозный цикл, синтез гемоглабина, нуклеиновых кислот, мембранный транспорт, дагоцитов, эритропоэз, микроциркуляцию, обладают иммунодепрессивным, цитотоксическим, нейро- и психотропным свойствами. Сейчас, квалификационная оценка степени тяжести состояния больных при сальмонеллезе немыслима без определения МСМ [40].
Установлено, что значительная часть циркулирующих в крови СМ не только растворена в плазме крови, но и связана с альбумином.
Человеческий сывороточный альбулин (ЧСА) – важнейший транспортный белок, осуществляющий перенос эндогенных метаболитов и ксенобиотиков в плазме крови, межклеточной жидкости, в лимфе.
Универсальность транспортной функции ЧСА обеспечивается его уникальной способностью связывать лиганды различной химической природы. Интенсивная лигандная нагрузка молекул альбулина приводит к изменению их структуры и связывающей способности. Такие модификационные формы ЧСА обнаруживаются при патологии [41].
О величине токсического действия вредных веществ можно судить по ЭКА, которая снижается после того, как токсические вещества займут центры связывания в молекуле альбулина, что приводит к снижению детоксикационных свойств организма. Изучение свойств альбулина является важным с точки зрения как диагностики, так и лечения [42].
2. Материалы и методы исследований
2.1. Материал исследований
Уровень интоксикации оценивался по изменениям в крови больных эффективной и общей концентраций сывороточного альбулина, малонового диальдегида, как одного из продуктов ПОЛ, уровня холестерина, ЦИК, МСМ и активности каталазы.
Для всех исследований бралась сыворотка крови. Исследовано 30 больных сальмонеллезом в возрасте от 17 до 46 лет. Для контроля набиралась группа 51 человека разного пола в возрасте от 20 до 46 лет.
Кровь бралась из локтевой вены, преимущественно натощак в количестве не менее 5 мл. Центрифугируем 1500 об/мин 10 минут. Для выполнения анализов сыворотки необходимо использовать сразу или заморозить и хранить при t=-20![]() С.
С.
2.2. Методы исследований
2.2.1. Определение МДА с тиобарбитуровой кислотой
(Конюхова В.С., 1989)
Об изменении интенсивности ПОЛ судим по изменению уровня вторичного продукта ПОЛ – малонового диальдегида.
Метод основан на том, что при высокой температуре в кислой среде МДА реагирует с 2-ТБК, образуя окрашенный розовый триметиновый комплекс с максимумом поглощения при 535 им.
Ход работы: К 0,2 мл сыворотки крови добавить 0,2 мл дистиллированной воды, 1 мл 0,6 % ТБК в ледяной уксусной кислоте. Кипятить 30 минут, охладить и добавить 1 мл 5№ КОН и 2 мл изопропанола. Центрифугируют при 6000 об/мин 20 минут. Колориметрируют при 535 нм и 580 нм против контроля, содержащего вместо плазмы воду.
Расчет: ![]() (мкМоль/л), где Е – оптическое поглащение изопропилового экстракта; 106 – коэффициент пересчета оптической плотности.
(мкМоль/л), где Е – оптическое поглащение изопропилового экстракта; 106 – коэффициент пересчета оптической плотности.
Пример расчета: больной Максимов С., 19 лет
![]()
концентрация МДА = ![]() (мкМоль/л).
(мкМоль/л).
2.2.2. Определение активности каталазы
(Королюк М.А., 1988)
Метод основан на способности перекиси водорода образовывать с солями молибдена стойкий окрашенный комплекс.
Ход определения: Реакция запускается добавлением 0,1 мл сыворотки крови к 2 мл 0,03 % раствора перекиси водорода. В холостую пробу вместо сыворотки вносят 0,1 мл дистиллированной воды. Реакцию останавливают через 10 минут добавлением 1 мл 4% молибдата аммония. Интенсивность окраски измеряют на
8-09-2015, 23:59
