Реферат
на тему:
"Гормональные регуляторные системы в женском организме"
Донецк 2009
1. Регуляция секреции пролактина
Продукция и выделение пролактина лактотропными б-клетками передней доли гипофиза находится под контролем целого ряда регуляторных центров гипоталамуса. Наиболее важными компонентами данной системы являются обладающие ингибиторным эффектом дофаминовые нейроны тубулоинфундибулярной системы и стимулирующие серотонинэргические нейроны, взаимоотношение между которыми можно расценивать как антагонистическое взаимодействие ПИФ и ПРФ.

Поскольку дофамин оказывает выраженный ингибиторный эффект на секрецию пролактина, ПИФ и дофамин, по мнению многих исследователей, идентичны. Освобождение ПИФ находится под контролемnucleusdorsomedialis. Помимо дофамина ингибиторным воздействием на секрецию пролактина обладают: норадреналин, ацетилхолин и г-аминомасляная кислота. Производные тиреолиберина и триптофана, такие как серотонин и мелатонин, выступают в роли ПРФ. Помимо прочего, модулирующее влияние на систему оказывают эндогенные опиоидные пептиды. Таким образом, морфин также способен оказывать стимулирующее влияние на секрецию пролактина через опиоидные рецепторы нервных окончаний дофаминэргических нейронов, расположенных в eminentiamediana. Данный эффект может быть подавлен агонистом дофамина бромокриптином.
К факторам-стимуляторам секреции пролактина, относятся эстрогены, тиреолиберин, физический и психоэмоциональный стресс, определенные лекарственные средства и помимо этого тактильная стимуляция, например сосательный рефлекс при кормлении грудью и пальпация при медицинском обследовании.


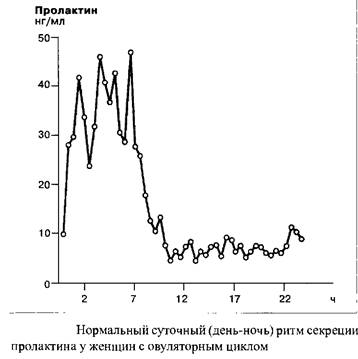
Посредством отрицательной обратной связи пролактин ингибирует свою собственную секрецию и секрецию люлебирина, блокируя, таким образом, секрецию ЛГ и ФСГ.
Секреция пролактина носит эпизодический характер, высвобождение происходит импульсами с разными интервалами. Кроме того, существует четкий ритм секреции пролактина, с наивысшими показателями уровня гормона в часы сна. Уровень пролактина у новорожденных поднимается до возраста шести недель.
Под действием эстрогенов, в течение беременности концентрация пролактина в крови достигает уровня, в 10–20 раз превышающего таковой у небеременной женщины детородного возраста. В период кормления уровень пролактина определяется частотой кормлений. Наблюдаемые при кормлении высокие уровни пролактина подавляют овуляцию, обеспечивая таким образом физиологическую контрацепцию. Исследования последних лет указывают на то, что пролактин индуцирует в печени протеин – «синлактин», выполняющий в женском организме роль субстанции-посредника, как в случае дуализма соматотропина и соматомедина.
2. Гормональные профили в течение менструального цикла
Менструальный цикл имеет продолжительность 28±4 дня и подразделяется на фолликулярную фазу, которая заключает в себе все стадии созревания фолликула, овуляторную фазу и заключительную люте-иновую фазу, т.е. стадию цикла, продолжающуюся от овуляции до момента децидуации эндометрия и таким образом отражающую полный период жизни желтого тела. Началом менструального цикла считается первый день менструального кровотечения.
В начале цикла уровень ФСГ выше, чем в заключительных стадиях фолликулярной фазы. Пик концентрации гормона наблюдается в середине цикла, одновременно с овуляторным пиком ЛГ; абсолютные значения концентрации ФСГ значительно ниже таковых для ЛГ.

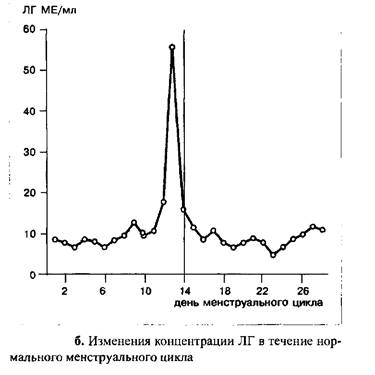
После овуляции уровень ФСГ падает и вновь достигает значений, наблюдаемых в ранних стадиях фолликулярной фазы только к концу цикла.
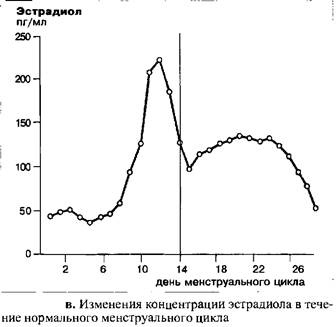
В течение менструального цикла уровень ЛГ остается низким, за исключением его подъема в середине цикла. Примерно за 12 часов до возникновения пика ЛГ, в середине цикла, ему предшествует преовулярный пик эстрадиола, в то время как сама овуляция происходит примерно 12–20 часов спустя становления максимальной концентрации ЛГ.
Уровень эстрадиола остается низким в начале и середине фолликулярной фазы менструального цикла. За три-пять дней до возникновения пика ЛГ уровень эстрадиола начинает расти и достигает максимальных значений примерно за 12 часов до пика ЛГ. После резкого падения, с наименьшими значениями, наблюдаемыми спустя 48 часов после пика ЛГ, уровень эстрадиола начинает снова подниматься. Максимальная концентрация достигается на девятый день после овуляции и затем к концу цикла концентрация гормона вновь падает по мере атрезии желтого тела.
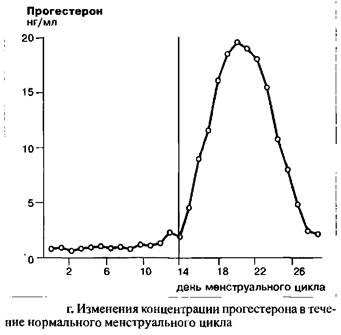
До момента окончания пика ЛГ концентрация прогестерона остается крайне низкой. Тем не менее, одновременно с пиком ЛГ в середине цикла, наблюдается небольшой, но достоверный подъем концентрации прогестерона с последующим снижением. Параллельно с эстрадиолом, уровень прогестерона начинает снова подниматься во вторую половину цикла, это означает, что лютеинизация завершена. К концу цикла концентрация прогестерона снова падает и достигает значения первой, фолликулярной фазы, в которой воздействие желтого тела практически отсутствует. Данное резкое падение концентрации прогестерона вызывает менструальное кровотечение.
3. Гипоталамо-гипофизарно-яичниковая регуляторная система
Менструальный цикл в целом, с характерными циклическими изменениями в яичниках и эндометрии находится под контролем тесно взаимосвязанной эндокринологической сети, связывающей гипоталамус, гипофиз и яичники. Регуляция в этой системе идет по механизму обратной связи.
Люлиберин, секретируемый nucleusarcuatusв области медиобазального гипоталамуса, транспортируется по аксоном нейронов в капиллярную сеть системы воротной вены в гипофизарной ножке и, таким образом, с током крови достигает гонадотропных клеток передней доли гипофиза. Люлиберин взаимодействует со специфическими поверхностными рецепторами. Это стимулирует синтез и накопление ФСГ и ЛГ во внутриклеточных секреторных гранулах, равно как и их освобождение.
Освобождение люлиберина, так же как и последующее высвобождение ЛГ и ФСГ происходит в виде импульсов и регулируется нейротрансмиттерами. Норадренолин, например, стимулирует секрецию люлиберина, в то время как дофамин, кортиколиберин, окситоцин, вазопрессин, серотонин и эндогенные опиоиды обладают ингибиторным эффектом.
Индивидуальная частота и амплитуда импульсных выбросов люлиберина и ФСГ/ЛГ являются одной из функций менструального цикла. В течение фолликулярной фазы, например, импульсная частота освобождения ЛГ находится в диапазоне 60–120 в минуту. В течение лютеиновой фазы данная частота прогрессивно замедляется. Наибольшие интервалы между секреторными импульсами ЛГ наблюдаются незадолго до лютеиновой регрессии. Существует связь между концентрацией прогестерона в сыворотке крови и замедлением частоты секреторных импульсов ЛГ. С началом падения уровня прогестерона, примерно с 23 дня цикла, т.е. одновременно с началом лизиса желтого тела, частота импульсов секреции ЛГ прогрессивно растет.
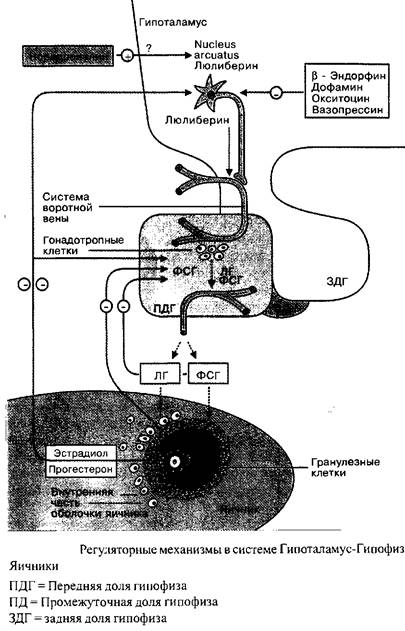
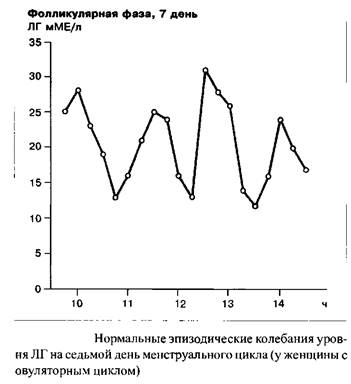
Еще раз: люлиберин контролирует синтез и освобождение ФСГ и ЛГ. Циклические вариации соотношения ФСГ/ЛГ являются следствием различий чувствительности гипофиза к люлиберину, это определяется половыми стероидами и фолликулярным ингибином.
Гонадотропины ФСГ и ЛГ являются гормонами второго порядка. В органе-мишени, яичниках, их активность проявляется двояко: стимуляция роста фолликулов и стимуляция секреции половых стероидов. Механизмом «короткой» обратной связи ФСГ и ЛГ контролируют свою собственную секрецию. Яичниковые половые стероиды, в свою очередь, оказывают модулирующий эффект на гормональную систему гипоталамус-гипофиз-яичники посредством длинной связи. Таким образом, они вносят вклад в синхронизацию гормональных профилей на протяжении менструального цикла.
Эстрогены и прогестерон имеют двойную функцию: они могут выступать и как ингибиторы и как стимуляторы. Например, в конце фолликулярной фазы эстрадиол стимулирует синтез, везикулярное накопление и освобождение ЛГ, по всей видимости, усиливает освобождение ЛГ и ФСГ, вызванное эстрадиолом. Позже, во второй половине цикла, после созревания желтого тела, прогестерон начинает оказывать ингибиторное воздействие.
Молекулярно-биологические аспекты стероид-опосредованной обратной связи являются областью, полной неразрешенных проблем. После того, как в гипоталамусе были обнаружены рецепторы половых стероидов, появилась концепция, в соответствии с которой в основе данного механизма лежит регуляция синтеза нейротрансмиттеров, которые косвенно воздействуют на освобождение люлиберина. Более того, предполагается, что половые стероиды активируют люлиберин-разрушающие пептидазы.
Помимо этого, половые стероиды и фолликулярный ингибин воздействует на гипофизарно-яичниковую систему, селективно ингибируя секрецию ФСГ.
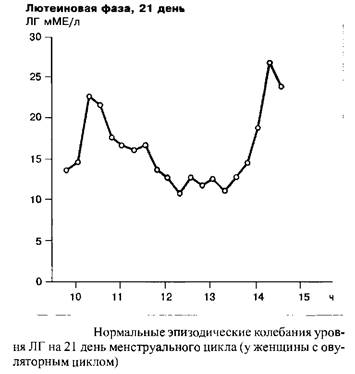
Необходимы дальнейшие исследования с целью выяснения модулирующего влияния СССГ и КСГ, связывающих половые стероиды, на регуляторную связь, существующую между гипоталамусом, гипофизом и яичниками. То же относится к метаболической способности печени и накопительным и метаболическим свойствам периферических органов-мишеней половых стероидов.
4. Овариальный цикл и регуляция биосинтеза половых стероидов в яичниках
Из 7 миллионов оогоний, примордиально присутствующих в женском организме, примерно 300–400 за период половой зрелости женщины, развиваются от стадии примордиального фолликула до полностью зрелой яйцеклетки. Примордиальный фолликул состоит из ооцита и максимум 10 гранулезных клеток с общим размером 0,1 мм. Нижеследующие стадии развития фолликула называются: стадия первичного, вторичного и третичного фолликула. Третичный фолликул в преовуляторную стадию содержит примерно 50–60 миллионов гранулезных клеток, заполненную жидкостью фолликулярную полость, называемую антрум, а также слой клеток оболочки, охватывающей гранулезные клетки.
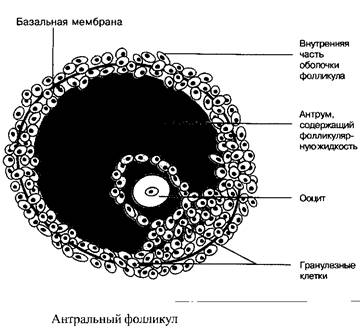
Созревшая и готовая к овуляции яйцеклетка имеет диаметр примерно 20 мм.
В течение овариального цикла, как правило, только один примордиальный фолликул развивается до стадии полного созревания. По мнению многих исследователей, главной причиной подобного состояния вещей является регуляторная роль гормонального фона. Большинство неселективно развивающихся примордиальных фолликулов претерпевают атрезию. Селективный стимул, определяющий какой именно фолликул должен достигнуть зрелости, по всей видимости, берет свое начало в лютеиновой фазе предыдущего менструального цикла в форме гормонального сигнала. Подъем концентрации ФСГ, наблюдаемый в конце цикла одновременно с падением уровня прогестерона, вероятно, является ключевым инструментом выбора очередного примордиального фолликула и сенсибилизации его к дальнейшим гормональным импульсам.
Секреция эстрадиола повышается с началом созревания фолликула. Вслед за этим запускается нижеследующие механизмы: эстрадиол совместно с ФСГ индуцирует рецепторы, расположенные на поверхности гранулезных клеток. Результатом этого становится рост связывающей способности, что ведет к повышению чувствительности фолликулярного аппарата к ФСГ, вызывая тем самым дополнительный рост. Далее ФСГ активирует ароматазу, присутствующую в гранулезных клетках, тем самым запуская процесс превращения андрогенов в эстрадиол. На этой стадии эволюции созревающий фолликул, содержащий фолликулярную жидкость, богат ФСГ и эстрадиолом. Концентрация гормонов в фолликулярной жидкости является необходимым и достаточным для полноценного роста фолликула и его созревания, несмотря на то, что уровень эстрадиола, нарастающий вплоть до конца фолликулярной фазы, вызывает прогрессивную блокаду гипофизарной секреции ФСГ. Остальные фолликулы, достигшие только ранней стадии эволюции, лишаются ФСГ-стимуляции и погибают.

От начала до середины фолликулярной фазы гранулезные клетки практически лишены специфических рецепторов к ЛГ. Таким образом, эффект ЛГ на этой стадии менструального цикла ограничивается воздействием только на клетки внутренней оболочки стенки фолликула. Под действием ЛГ из эфиров холестерина образуются андрогены, которые транспортируются в гранулезные клетки в качестве предшественников эстрадиола.
Под действием ФСГ, к концу первой половины цикла, происходит усиленная индукция рецепторов ЛГ, расположенных на поверхности гранулезных клеток.
Решающее значение для процесса нормального созревания фолликула имеет пропорция стимулированных ЛГ андрогенов и стимулированного ФСГ эстрадиола. Избыточное количество андрогенов ведет к атрезии, и только сбалансированное доминорование эстрогенной стимуляции позволяет фолликулу полностью созреть.
Массированный выброс ЛГ, основанный на преовуляторном пике, вызывает лютеинизацию гранулезных клеток и переводит биосинтез стероидов на продукцию прогестерона. Одновременно, примерно 28–36 часов спустя массированного выброса ЛГ, инициируется овуляция. В дополнение к синтезу прогестерона, желтое тело также секретирует эстрадиол и андрогены.
Продолжительность синтеза прогестерона, равно как и его высвобождение на протяжении лютеиновой фазы, находятся в прямой зависимости от количества рецепторов к ЛГ, максимальное число которых наблюдается на 22 и 24 дни цикла. После начала менструального кровотечения ЛГ-рецепторы в желтом теле не определяются. В регуляторный механизм также вовлекается и ингибитор связывания ЛГ; присутствующий в клетках желтого тела и фолликулярной жидкости.

Не вызывает сомнений, что полноценное функционирование желтого тела может иметь место только в случае оптимальной гормональной стимуляции преовуляторного доминантного фолликула. Концентрация рецепторов к ЛГ является наиболее важным показателем нормального развития желтого тела, однако, поскольку индукция рецепторов ЛГ опосредуется ФСГ, транзиторное подавление ФСГ в течение фолликулярной фазы цикла может автоматически привести к снижению уровней эстрадиола и прогестерона, равно как и к редукции клеточной массы желтого тела. Применительно к клинической практике, главным выводом из вышесказанного может стать то, что лечение недостаточности желтого тела должно проводиться в течение фолликулярной фазы цикла, нежели чем заместительно в течение лютеиновой фазы.
Овуляция, представляющая собою выброс cumulusoophorus, провоцируется сочетанием повышения внутрифолликулярного давления, простагландин-опосредованной активации коллагеназ с последующей частичной деструкцией фиброзных структур стенки фолликула, а также сократительными стимулами.
9-09-2015, 00:40
