Примечание:
Если для одного из веществ, входящих в раствор, фактор показателя преломления неизвестен или не значительная его концентрация не позволяет получить точных данных, то готовят контрольный раствор, содержащий это вещество в той концентрации, которая была определена титрометрическим методом.
· Натрия бромида 2,0
Магния сульфата 5,0
Раствора глюкозы 20% - 200,0 мл В этом случае натрия бромид определяют методом аргентометрии (титрант - 0,1 н. раствор нитрата серебра, индикатор - бромфенольный синий), магний сульфат - методом комплексонометрии (титрант - 0,05 М раствор трилона Б, индикаторная смесь кислотного хром-черного специального). Глюкозу в присутствии натрия бромида целесообразно определить рефрактометрическим методом. Расчет содержания глюкозы в процентах (С глк) выполняют по формуле:
· С глк = [n - (n0 + Cnabr* Fnabr+ Cmgso4)] / Fглк, где n - показатель преломления раствора n0 - показатель преломления воды очищенной, измеренный при той же температуре С nabr - концентрация натрия бромида в растворе, определенным методом Fnabr - фактор показателя преломления раствора натрия бромида для найденной концентрации Cmgso4 - концентрация магния сульфата (mgso4 * 7H20) в растворе, определенным методом комплексонометрии Fmgso4 - фактор показателя преломления раствора для найденной концентрации Fглк - фактор показателя преломления раствора глюкозы Раствор глюкозы 10 % - 100 мл.
Подлинность.
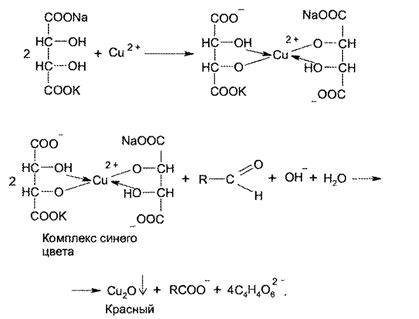
0,05-1 г смеси растворяют в 1-2 мл воды, прибавляют по 2-3 капли пергидроля и раствора аммиака и кипятят 2-3 минуты. После охлаждения добавляют 1 мл реактива Фелинга и снова нагревают. Реактив Фелинга состоит из 2 растворов. Раствор №1 представляет собой водный раствор меди сульфата, подкисленный серной кислотой. Раствор №2 - это щелочной раствор калия-натрия тартрата. Реактивом служит смесь равных объемов обоих растворов. Образуется кирпично-красный осадок.
Количественное определение.
Проводят методом рефрактометрии.
Показатель преломления глюкозы: 1,3473.
По рефрактометрической таблице находим, что фактор преломления F для растворов глюкозы равен 0,00142, показатель преломления воды равен 1,333.
С = (1,3473 - 1,3330) /0,00142 = 10, 07 %
Относительное отклонение:
10,07 - 10/10 *100% = 0,7 %
Допустимое отклонение + - 2%
Вывод.
В соответствии с приказом № 305 от 16.10.97 отклонение укладывается в норму допустимых отклонений. Лекарственная форма приготовлена удовлетворительно.
· Раствор Магния сульфата 25% - 100 мл.
Подлинность.
Магний-ион:
К 2-3 каплям раствора прибавляют 1 мл воды, по 0,5 мл раствора аммония хлорида, натрия фосфата и аммиака; образуется белый кристаллический осадок, растворимый в разведенной уксусной кислоте и нерастворимый в избытке раствора аммиака.
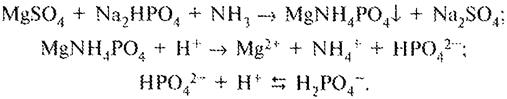
Сульфат-ион:
К 2-3 каплям раствора прибавляют 3-5 капель воды и 2-3 капли раствора бария хлорида; образуется осадок, нерастворимый в разведенных минеральных кислотах.
![]()
Количественное определение.
Измеренный показатель преломления составил 1,3551.
Находим в рефрактометрической таблице ближайшие значения - 1,3550 и 1,3560.
Им соответствуют концентрации 24,7% и 25,92%.
Рассчитываем, насколько изменяется концентрация при изменении преломления на 0,0001:
(25,92% - 24,7%) / 10 = 0,122%
Отсюда, показателю преломления 1,3551 соответствует концентрация:
24,7% + 0,122% = 24,82%.
Допустимое отклонение в соответствии с приказом № 305 от 16.10.97 составляет +-2%
Относительное отклонение:
24,82-25/25 * 100% = 0,7 %
Вывод.
В соответствии с приказом № 305 от 16.10.97 отклонение укладывается в норму допустимых отклонений. Лекарственная форма приготовлена удовлетворительно.
· Натрия бромида 2,0
Магния сульфата 5,0
Раствор глюкозы 20% - 200 мл Подлинность.
Магний-ион:
К 2-3 каплям раствора прибавляют 1 мл воды, по 0,5 мл раствора аммония хлорида, натрия фосфата и аммиака; образуется белый кристаллический осадок, растворимый в разведенной уксусной кислоте и нерастворимый в избытке раствора аммиака.
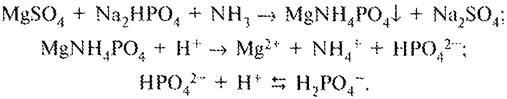
Сульфат-ион:
К 2-3 каплям раствора прибавляют 3-5 капель воды и 2-3 капли раствора бария хлорида; образуется осадок, нерастворимый в разведенных минеральных кислотах.
![]()
Глюкоза:
0,05-1 г смеси растворяют в 1-2 мл воды, прибавляют по 2-3 капли пергидроля и раствора аммиака и кипятят 2-3 минуты.
После охлаждения добавляют 1 мл реактива Фелинга и снова нагревают.
Реактив Фелинга состоит из 2 растворов. Раствор №1 представляет собой водный раствор меди сульфата, подкисленный серной кислотой. Раствор №2 - это щелочной раствор калия-натрия тартрата. Реактивом служит смесь равных объемов обоих растворов. Образуется кирпично-красный осадок.
Схемы реакций см. стр.15.
Натрия бромид:
Натрий-ион:
Небольшое количество ЛФ внесенное в пламя горелки, окрашивает его в жёлтый цвет.
Бромид-ион:
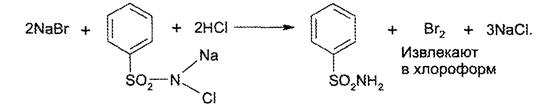
0,5 мл ЛФ помещают в пробирку, добавляют 2-3 капли разведенной хлороводородной кислоты, 3-5 капель раствора хлорамина, 1 мл хлороформа и взбалтывают.
Наблюдаем окрашивание хлороформного слоя в желтый цвет.
Количественное определение.
Количественное определение натрия бромида:
Аргентометрия.
Методика количественного определения:
0,5 мл испытуемого раствора поместили в пенициллиновый флакон, добавили 2 капли хромата калия, титруем 0,1М раствором нитрата серебра до окрашивания осадка в оранжево-бурый цвет.
![]()
Т=0,01029
а=0,5
VТ=0,49
x = (0,01029 x 0,49 х 100%) / 0,5 = 1,0%
Допустимое отклонение (пр. № 305) ± 5%
Количественное определение магния сульфата:
Комлексонометрия.
Методика количественного определения:
0,5 мл испытуемого раствора поместили в пенициллиновый флакон, добавили 1-2 капли индикатора кислотный хром черный. Титруем раствором Трилона Б до перехода окраски из фиолетового в голубой. Добавляем аммиачный буфер для поддержания pH среды.
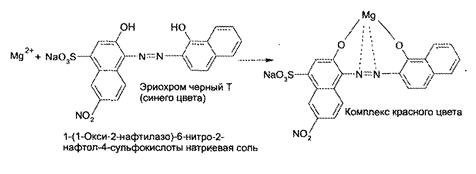
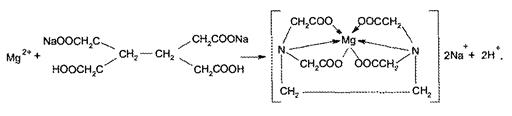
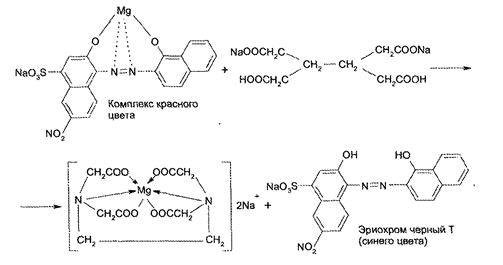
Т=0,01232
а=0,5
VТ=0,4
x = (0,01232 x 1,0 х 100%) / 0,5 = 2,46%
Допустимое отклонение (пр. № 305) ± 5%
Относительное отклонение: 2,46 - 2,5/2,5 * 100% = 1,44%
Количественное определение глюкозы целесообразно проводить рефрактометрически.

С = (1, 3651 - (1.333 + 1 * 0.00131 +2,46* 0,00095) /0,00142 = 19,8%
Допустимое отклонение: + - 5%
Относительное отклонение:
19,8 - 20/20 *100% = 1 %
Вывод.
В соответствии с приказом № 305 от 16.10.97 отклонение укладывается в норму допустимых отклонений. Лекарственная форма приготовлена удовлетворительно.
· Кислоты аскорбиновой 0,1
Глюкозы 0,5
Подлинность:
Кислота аскорбиновая:
0,05 - 1 г смеси растворяют в 1-2 мл воды, добавляют 1-2 капли аммиачного раствора серебра нитрата. Выпадает темный осадок.
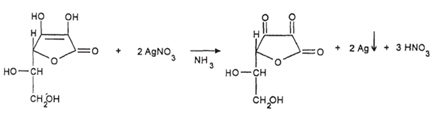
Глюкоза:
0,05-1 г смеси растворяют в 1-2 мл воды, прибавляют по 2-3 капли пергидроля и раствора аммиака и кипятят 2-3 минуты. После охлаждения добавляют 1 мл реактива Фелинга и снова нагревают. Реактив Фелинга состоит из 2 растворов. Раствор №1 представляет собой водный раствор меди сульфата, подкисленный серной кислотой. Раствор №2 - это щелочной раствор калия-натрия тартрата. Реактивом служит смесь равных объемов обоих растворов. Образуется кирпично-красный осадок.
Схемы реакций см. стр.15.
Количественное определение:
Кислота аскорбиновая 0,05 г порошка растворяют в 1-2 мл воды и титруют 0,1н раствором натрия гидроксида до розового окрашивания (индикатор - фенолфталеин).
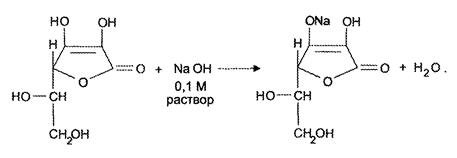
Глюкоза Растворяют 0,3 г порошка в 1-1.5 мл воды, объем доводят водой до 2 мл и определяют показатели преломления раствора и воды.
Если на титрование кислоты аскорбиновой в навеске массой 0,05 г (а1) (М=176,13 г/моль) израсходовано 4,25 мл 0,1 моль/л раствора натрия гидроксида (К=1,01), а показатель преломления раствора, полученного растворением в 2,0 мл воды навески массой 0,3 г (а2) - 1,3544
Фактор показателя преломления раствора кислоты аскорбиновой (F1) - 0,00160; безводной глюкозы (F2) - 0,00142. Показатель преломления воды - 1,333. По результатам титрования необходимо рассчитать содержание кислоты аскорбиновой (m1) в пересчете на массу порошка по прописи (Р).
Фактор эквивалентности кислоты аскорбиновой в методе нейтрализации равен 1.
Титр натрия гидроксида по кислоте аскорбиновой:
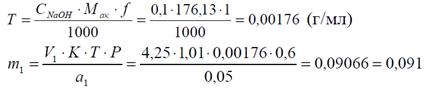
Затем рассчитывают концентрацию кислоты аскорбиновой (С1) в приготовленном для рефрактометрии растворе по формуле:
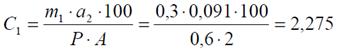
Содержание глюкозы (m2), в пересчете на массу порошка по прописи равно:
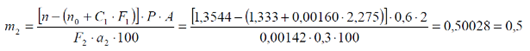
Вывод.
В соответствии с приказом № 305 от 16.10.97 отклонение укладывается в норму допустимых отклонений. Лекарственная форма приготовлена удовлетворительно.
Вывод:
Вывод из всего написанного выше следует такой:
Рефрактометрический метод анализа, прост, быстр и удобен. Но наибольшее значение он имеет все же для пищевой промышленности и медицины (например, для определения белка).
Список литературы
1. Рефрактометрия в анализе лекарственных средств аптечного изготовления. Контроль качества лекарственных средств, изготовляемых в аптеках / ГОУ ВПО Нижегородская государственная медицинская академия Российского федерального агентства и социального развития. Кафедра фармацевтической химии и фармакогнозии - Нижний Новгород, 2008г.,19 с.
2. Компания ЕвроЛаб [Сайт компании]; http://www.eurolab.ru/refraktometriya (Дата обращения 20.12.2010)
3. Компания ЕвроЛаб [Сайт компании]; http://www.eurolab.ru/refraktometry (Дата обращения 20.12.2010)
4. Березина Е.С., Киселева А.А., Филиппова Ю.В. / Вестник Пермской государственной фармацевтической академии №2 - Пермь, 2007 г., с.123-125
5. Компания Аквилон хроматография [Сайт компании]; http://www.prochrom.ru/ru/? idp=127 (Дата обращения 20.12.2010)
8-09-2015, 19:11
