Механизм разрушения ацетилхолина преимущественно связан с работой фермента — ацетилхолинэстеразы, который располагается на постсинаптической мембране и быстро гидроли-зует медиатор после взаимодействия с рецепторами. В глутаматергическом синапсе механизм удаления нейромедиатора заключается преимущественно в поглощении L-глутамата окружающими глиальными клетками. L-глутамат превращается в глутамин с помощью фермента глутаминазы, находящейся в глиальных клетках. В ГАМК-ергическом синапсе преобладает система обратного захвата медиатора.
7. ОБЩИЕ ВОПРОСЫ НЕЙРОРЕЦЕПТИИ
В биохимии и физиологии нервной системы длительное время доминировала точка зрения, согласно которой местом активных пластических изменений нейронов является пресинапти-ческая мембрана. Были представлены многочисленные свидетельства, касающиеся сдвигов количества квантов нейромедиатора в процессе обучения, памяти, выработки условных рефлексов и др. Постсинаптическим мембранам отводилась либо пассивная роль, либо они вообще не рассматривались в качестве активных участников событий в нервных клетках. Впоследствии стало ясно, что процессы, происходящие в плазматической или синаптической мембране нейрона, являются одними из ключевых для понимания интегративных функций ткани мозга, решения проблем обеспечения эффективного взаимодействия между нервными клетками. В последние десятилетия особое внимание было обращено на изучение структурных компонентов постсинаптических мембран, в частности нейрорецепторов. Исследования тонкой структуры и функции нейрорецепторов показали их важную роль в трансформации химического сигнала в биоэлектрические потенциалы и в передаче информации на внутриклеточные реакции, которые определяют метаболизм нервной ткани.
Следует отметить, что нейрорецепторы расположены как на мембранах нейронов, так и на мембранах глиальных клеток. Однако у последних они имеются в ограниченном наборе и числе. Рецепторные системы, расположенные на глиальных элементах, отличаются от нейрональных весьма важным моментом — они не способны продуцировать ответные реакции клеток в виде оперативных единиц информации. Иными словами, они не генерируют потенциалов действия. Как правило, глиальные клетки реализуют свое действие через внутриклеточные и межклеточные трофические регуляторные реакции, участвуя в метаболизме нейронглия.
Несмотря на огромное разнообразие клеточных рецепторов на мембране нейрона, их можно подразделять на два основных класса, которые различаются по механизмам действия и скорости проведения сигналов. Существуют быстродействующие ионотропные и медленнодействующие метаботропные рецепторы скорость действия первых составляет миллисекунды, в то время как у последних они находятся в секундно-минутном диапазоне. Время действия нейрорецепторов определяется структурной организацией рецепторных компонентов.
Быстродействующие рецепторы содержат в своей структуре ионный канал, открывающийся при контакте с нейромедиатором. Медленнодействующие рецепторы представляют собой комплекс из нескольких белков, которые при воздействии нейромедиатора последовательно меняют конформацию и в конечном счете активируют синтез или выход вторичного, уже внутриклеточного, медиатора. Эти два класса рецепторов обозначают нередко как рецепторы I и II класса. Для правильного восприятия терминологии целесообразно также указать, не рассматривая пока детали, что рецепторы класса II содержат в числе белков, передающих сигнал, так называемые G-белки. Их нередко упоминают, обозначая рецепторы этого класса.
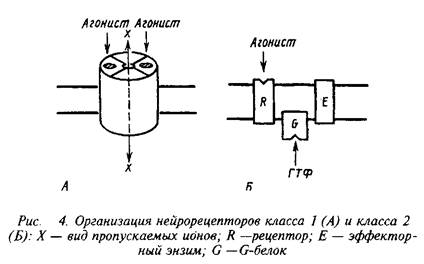
Кроме охарактеризованных выше двух классов рецепторов существуют еще три особые группы рецепторов, которые хотя и присутствуют в нервной системе, но пока представляются не связанными прямо со специфическими функциями последней. К ним относятся рецепторы, переносяшие свои лиганды через мембрану, рецепторы, обладающие собственной тирозинкиназной активностью и, наконец, своеобразная группа, которая при взаимодействии с лигандом претерпевает частичное протеолитическое расщепление. В настоящем руководстве мы не рассматриваем эти группы рецепторов.
К первому классу рецепторов принадлежат никотиновые рецепторы ацетилхолина, рецепторы ГАМКА , глицина, а также часть рецепторов глутамата и аспарагиновой кислоты. Рецепторы катехоламинов, серотонина, ГАМКВ и ряда пептидных соединений, а также мускариновые рецепторы ацетилхолина и некоторые из рецепторов глутамата относят ко второму классу. Последние типы рецепторов через систему вторичных посредников вызывают изменения в активности проте-инкиназ, способных фосфорилировать мембранные белки, включая ионные каналы.
Таблица 1
Структура, общий характер и функции рецепторов класса I
| Тип рецептора | Преимуществен -ная функция | Мг, кД | Субъединицы |
| Холинергический | Возбуждающая | 250 | а 40-50 Р 50-54 у 56-60 6 58-65 |
| ГАМКА | Тормозная | 230-260 | |
| Глутаматный | Возбуждающая | 240-400 | 90-10 |
| Глициновый | Тормозная | 246 | а 48 Р 58 |
Таблица 2
Масса белков рецепторов класса II
| Рецептор | Мг, кД |
| Ад рене р ги чески й | 58-80 |
| Глутаматер гически й | 90-110 |
| Холинергический | 85-105 |
| Дофаминовый | 72-94 |
| Опиатный | 53-65 |
| Серотониновьш | 67 |
Следует отметить, что в последние годы обнаружена группа нейрорецепторов, связь которых с ионными каналами осуществляется через G-белки, не сопряженные с перечисленными выше вторичными мессенджерами. Хотя в такую систему рецепции и не включены протеинкиназы, тем не менее участие G-белка в трансформации сигнала значительно увеличивает время действия по сравнению с нейрорецепторами класса 1.
Фундаментальным свойством всех нейрорецепторов является их лабильность и высокая скорость синтеза самого рецептора. Это свойство рецепторов конрастирует с более жесткой запрограммированностью синтеза белковых компонентов мембран, которая обычно наблюдается у других типов тканей. В нейронах развиты механизмы непрерывного синтеза рецепторов и их быстрой утилизации либо путем интернализации, либо с помощью пиноцитоза. Высокая скорость обновления нейрорецепторов обусловлена, по-видимому, необходимостью изменения "информационной емкости и "пропускной способности" нейрона. В этом случае генетический аппарат клетки способен, интегрируя всю приходящую информацию, "принять решение" путем перестройки синтеза белковых компонентов мембран. В этом скрыта одна из причин уникального свойства нейронов и нервной ткани в целом — пластичности.
Таким образом, основная роль нейрорецепторов сводится к созданию специфических информационных входов, организующих единый функциональный ансамбль нейронов. Именно совокупность рецепторов определяет лицо клетки и ее реакции на поступление разнообразных химических сигналов.
Молекулярные механизмы, лежащие в основе модуляции эффективности синаптической передачи, в которых важную роль играют рецепторные процессы, имеют альтернативу. С одной стороны, это изменение чувствительности к рецептору, с другой — увеличение или снижение количества активных рецепторов на мембране. Заслуживают внимания и гипотезы, касающиеся посттрансляционной модификации нейрорецепторов, которая позволяет изменить количественные параметры их функционирования.
Внимание к проблемам нейрорецептии со стороны биохимиков, фармакологов и физиологов обусловлено еще и тем, что причиной многих дисфункций нервной системы является нарушение целостности мембранных компонентов как нейронов, так и глиальных клеток. Отметим, что существующие успехи в лечении некоторых нервно-психических заболеваний связаны в большей мере с прогрессом в исследовании именно молекулярных свойств ряда рецепторов. Оказалось, что многие нейрорецепторы выполняют роль избирательных мишеней действия известных лекарственных препаратов. Исследования в этой области нейробиологии служат сейчас постоянным источником для целенаправленного поиска и создания новых классов фармакологических средств, обладающих улучшенными терапевтическими свойствами.
8. БИОХИМИЧЕСКИЕ МЕТОДЫ ИЗУЧЕНИЯ МЕХАНИЗМОВ НЕЙРОРЕЦЕПТИИ
Наиболее широко распространенным и разработанным методическим подходом для количественного анализа взаимодействия нейромедиаторов со своими рецепторами на мембране клетки является радиолигандный метод. Суть этого метода заключается в изучении параметров связывания радиоактивного лиганда с мембранно-связанными или изолированными рецепторными белками. В настоящее время существует хорошо развитая кинетическая теория рецептии и методы определения физико-химических параметров процесса образования комплекса лиганд-рецептор. Такой физико-химический анализ позволяет сделать определенные заключения о структуре активных центров нейрорецепторов, в частности, выяснить природу некоторых функциональных групп, которые ответственны за первую стадию взаимодействия лиганда с акцептором.
Для того чтобы кратко ознакомиться с количественной теорией взаимодействия веществ со своими рецепторами, рассмотрим простейшие условия, когда одна молекула лиганда взаимодействует с одним центром связывания:
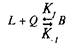
где L — лиганд; Q — центр связывания; В — комплекс лиганда со связывающим центром; К{ и K.j — кинетические константы. При динамическом равновесии скорость реакции образования комплекса В равна его скорости диссоциации, т.е. Vt = V_1? тогда концентрация вычисляется по формуле
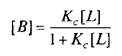
При этом предполагается, что L и Q взаимодействуют между собой по закону действующих масс, т.е. скорости реакций образования комплекса и его диссоциации прямо пропорциональны концентрациям компонентов в системе. Отношение констант прямой и обратной реакции называют константой сродства Кс . Она характеризует соотношение занятых и свободных участков связывания при данной концентрации лиганда. Обычно для описания параметров связывания используют величину, обратную константе сродства,—
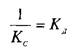
— константу диссоциации. Эта константа соответствует величине, при которой происходит насыщение 50% связывающих участков:
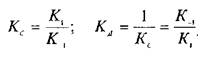
Если вместо константы сродства Кс использовать обратную ей величину Кд, то, подставив это значение в уравнение, характеризующее равновесную реакцию взаимодействия лиганда с рецептором, получим следующее уравнение:
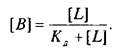
Приняв общее число рецепторов за 1, можно преобразовать уравнение к виду, аналогичному уравнению Михаэлиса, которое используется в энзимологии для описания кинетики обратимых ферментативных реакций:
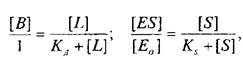
где — концентрация комплекса фермент-субстрат; —
концентрация субстрата и Ks — константа диссоциации комплекса; — исходная концентрация субстрата.
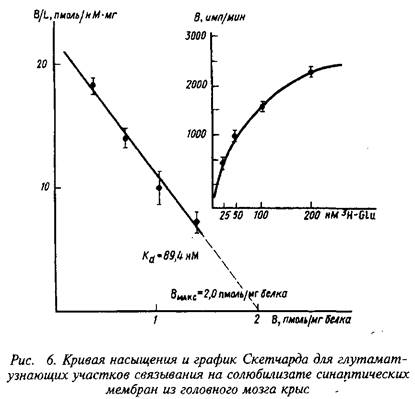
Согласно этим уравнениям зависимость величины эффекта от дозы лиганда или фермента описывается гиперболой. Чаще всего для работы пользуются графическим выражением зависимости эффекта не от концентрации, а от логарифма концентрации лиганда. Графически зависимость результатов может быть представлена разными способами, однако наиболее информативным способом расчета являются координаты Скэтчарда. Действительно, помимо равновесной константы связывания и общей концентрации центров связывания этот метод позволяет определить концентрацию свободного лиганда, соответствующую данной концентрации комплекса В. Константа диссоциации равна котангенсу угла наклона прямой. Отрезок на оси абсцисс от точки пересечения с прямой до начала координат соответствует максимальному уровню насыщения центров связывания.
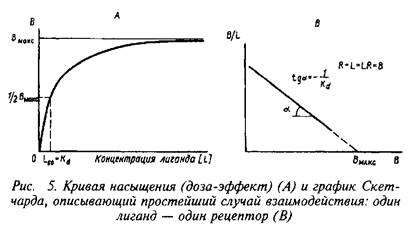
Таким образом, представление результатов равновесного связывания в координатах Скэтчарда дает информацию о характере протекающего процесса и позволяет определить важные параметры лиганд-рецепторного взаимодействия — константу диссоциации и концентрацию центров, способных образовывать комплексы с нейромедиатором.
В качестве примера изучения рецепторного связывания нейромедиатора с белковыми компонентами на мембране нейрона приведем экспериментальные исследования глутаматных рецепторов радиолигандным методом. Так, исследования параметров связывания Н-глутамата с синаптическими мембранами, выделенными из коры больших полушарий головного мозга крыс, показали их зависимость от чистоты материала, способов хранения, условий проведения реакции связывания и др. При стандартизации всех указанных условий зависимость специфического связывания Н-глутамата с синаптическими мембранами имеет насыщающий характер. Представление экспериментальных данных в координатах Скэтчарда свидетельствует о наличии на мембранах однородной популяции участков связывания с Кд - 89,4 нМ и Вмакс = 2,0 пмоль/мг белка.
Значение количества центров связывания, выраженное в СРМ, пересчитывается в фмоль/мг белка по следующей формуле:
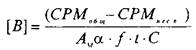 >
>
где А^ — молярная активность радиолиганда, Кю/моль; а — 2,210~ pacn/мин; f — эффективность счета; — разность счета связывания радиолиганда с рецептором в отсутствие и в присутствии немеченого радиолиганда; t — время счета; С — концентрация белка, мг.
Для того чтобы отличить эти параметры связывания от неспецифического связывания и поглощения глутамата другими участками мембраны, существуют дополнительные экспериментальные приемы, в том числе проведение реакции в присутствии разных катионов. Истинное рецепторное связывание глутамата является Na*-независимым процессом, в то время как поглощение и транспорт этого нейромедиатора другими участками синапса происходит в присутствии высоких концентраций ионов Na.
Далее возникает вопрос, соответствуют ли эти независимые участки связывания самого глутамата тем рецепторным компонентам на мембране нейрона, которые способны вызывать физиологический ответ клетки на данный медиатор. Оказалось, что сродство и константа диссоциации, полученные экспериментальным биохимическим методом, находятся в пределах физиологических концентраций действия L-глутамата на нейроны позвоночных. Такие показатели реакции связывания нейромедиатора, как насыщаемость и обратимость, соответствуют аналогичным свойствам глутаматного рецептора, регистрируемым с помощью электрофизиологических методов. Более того, чувствительность к ряду известных агонистов и антагонистов, таких как NMDA, каинат, квисквалат и другие, была сходна с физиологическими ответами. Следует упомянуть, что характер связывания нейромедиатора в присутствии ионов Na существенно отличается от рецепторного взаимодействия и коррелирует с параметрами высокоаффинного поглощения L-глутамата клетками, регистрируемыми физиологически. Все это иллюстрирует пути оценки параметров связывания нейромедиатора и специфические трудности, возникающие при такой оценке.
Одним из основных подходов к изучению молекулярных свойств нейрорецепторов является изолирование индивидуальных рецепторных белков, специфически связывающих нейромедиаторы или необратимо взаимодействующих с их антагонистами или бло-каторами. Так, прогресс в исследовании никотиновых холино-рецепторов был обусловлен обнаружением а-бунгаротоксииа, который оказался специфическим блокатором этого типа рецепторов и позволил выделить мембранные белки и очистить их на основе радиолигандного метода. Наличие таких приемов дает возможность разграничить хеморецепторные процессы от ферментативного и транспортного метаболизма нейромедиато-ров. Особенно это важно для изучения рецепторов аминокислотных медиаторов нервной ткани.
Изучение химической природы мембранных белков включает предварительное выделение, солюбилизацию, очистку и анализ очишенных компонентов. Причем применение классических методов структурного анализа для характеристики мембранных белков имеет свои сложности и особенности. Как правило, они обусловлены свойствами мембран и их компонентов, в частности, наличием липидных и гликолипид-ных структур. Проблемы, связанные с экстракцией белковых компонентов мембран, их очисткой и анализом, составляют специальный раздел мембранологии. Здесь будут рассмотрены лишь самые общие моменты.
Выбор метода солюбилизации зависит от цели исследования и имеет смысл только тогда, когда дает возможность сохранить нативные свойства рецепторного белка и исследовать его с помощью обычных биохимических подходов. Поэтому выбор со-любилизирующего агента на первом этапе может оказаться ключевым для анализа структуры и функции рецептора.
Существует целый ряд самых разнообразных солюбилизи-рующих агентов, пригодных для решения проблем мембранной биохимии. Наиболее надежными среди них являются неионные и ионные детергенты. В основе их действия лежит амфифиль-ная природа этих агентов, позволяющая им взаимодействовать и с гидрофильными, и с гидрофобными участками мембранных белков. Эффект детергента, разрушающего взаимосвязи в мембране, определяется двумя видами взаимодействия: детергент-белок и детергент—детергент. Большое значение имеет последнее взаимодействие, так как чем выше способность молекул детергента взаимодействовать друг с другом, тем меньше будет количество молекул, способных взаимодействовать с белками. Этот критерий мицеллообразования служит характеристикой детергента и его способности растворять те или иные белковые компоненты. Низкий коэффициент мицеллообразования характерен для мягких солюбилизирующих агентов, таких как тритон Х=Ю0, дезоксихолат натрия, дигитонин и другие, которые позволяют выделять нативные мембранные белки с сохранением их биологической активности. В то же время додецилсульфат натрия с высоким коэффициентом мицеллообразования обладает большой связывающей способностью и значительно повреждает нативную конформацию белков. Как правило, этот детергент используется при анализе субъединичной структуры макромолекул, так как легко разрушает межмолекулярные связи. Это свойство нередко применяется для определения молекулярной массы субъединиц белков при электрофорезе в присутствии ДСН.
Перед тем как приступить к дальнейшему выделению и изучению мембранных рецепторных белков, следует по возможности более полно удалить избыток детергента, поскольку он может оказывать нежелательное действие на биологическую активность и последующий физико-химический анализ структуры нейрорецептора.
Классические методы исследования мембранных белков, в том числе нейрорецепторов, включают практически все биохимические методы с учетом присутствия детергентов. Основным приемом специфического выделения ничтожно малых количеств нейрорецепторов является аффинная хроматография, которая позволила добиться впечатляющих успехов в изучении молекулярных свойств самых разнообразных типов нейрорецепторов.
Эффективность аффинной хроматографии зависит преимущественно от выбора лиганда или акцептора, который определяет природу выделяемого мембранного белка. Существенным фактором в этом случае является сродство лиганда к рецептору, и поэтому самыми эффективными лигандами оказываются специфические блокаторы или антагонисты нейрорецепторных белков. Иногда для выделения конкретного белка используют две или три ступени аффинной хроматографии на разных сорбентах и с разными лигандами. Получили широкое распространение методы иммуноаффинной хроматографии, в которых в качестве лиганда используется поликлональные или моноклональные антитела, полученные к компонентам рецептора.
Дальнейшее выделение и разделение фракций обычно осуществляют с помощью высокоэффективной жидкостной хроматографии, которая позволяет очищать индивидуальные компоненты мембранных белков. Причем обратнофазная хроматография дает уникальные возможности по разделению гидрофобных белков и пептидов. Нативность белковых компонентов рецепторов проверяют либо по лигандсвязьшающей функции, либо путем реконструкции их функции в разных модельных системах.
Одной из таких модельных систем, позволяющих контролировать ионтранспортные или ионселективные функции нейрорецепторов, служат липосомы. Способность липосом встраивать белки или целые рецепторные комплексы с сохранением их функциональной активности используется в мембранологии для моделирования функций белков "в чистом виде". В этом случае можно получать информацию о структурной организации компонентов, составляющих макромолекулу рецептора, и их внутренних перестройках в контролируемых условиях эксперимента.
В настоящее время разработано большое количество методов получения липосом, которые могут изменять фосфолипидный состав, заряд, "текучесть" или многослойность их компонентов. Размеры липосом могут варьировать от 25 нм до 100 мкм. Функцию белков, встраиваемых в липосомы, контролируют по динамике транспорта или накопления меченых ионов внутри липосом.
В последние годы исследователи возлагают особые надежды на иммунохимические способы идентификации структурных компонентов нейрорецепторов. Высокая специфичность антител и их способность узнавать разные антигенные детерминанты рецепторных комплексов широко используется для выяснения структурной организации нейрорецепторов и процессов их биосинтеза, включая генно-инженерные исследования. Иными словами, поли- и моноклональные антитела являются важным инструментом для изучения механизмов рецептии и общих вопросов нейробиологии.
Принципиальным решением множества проблем, связанных с применением антител, явилось создание новой гибридомной технологии, которая позволила получить моноклональные антитела. Эта техника была разработана в 1975 г. У.Келлером и А.Милстейном. Получаемые с помощью этого метода гибридные клетки синтезируют и выделяют в культуральную среду антитела, абсолютно одинаковые по своему сродству к той или иной антигенной детерминанте.
Гибридомная техника позволила получать самые разнообразные моноклональные антитела против химически индивидуальных антигенных детерминант на одной молекуле белка. В настоящее время моноклональные антитела широко используют
8-09-2015, 19:29
