Иммунохимический анализ пептидных компонентов глицинового рецептора с помощью моноклональных антител позволил обнаружить существование общих антигенных детерминант этих рецепторных белков, выделенных из разных объектов: головного и спинного мозга мышей, крыс, свиньи и человека. Более того, интересными являются данные о том, что некоторые участки глицинового и ГАМК-рецепторов иммунологиче-ски идентичны. Этот факт хорошо подтвержден генно-инженерными исследованиями.
До недавнего времени предположение о существовании гомологии между нейрорецепторами I класса, т.е. быстродействующих инотропных рецепторов, выдвигалось лишь в качестве гипотезы. В последние годы одновременно в нескольких лабораториях было показано, что гены рецепторов ГАМК и глицина имеют гомологичные последовательности. Так, оказалось, что имеется примерно 50%-ная гомология между аминокислотными последовательностями а-субъединичной структуры глицинового рецептора с Мг = 48 кД и а- и р-субъединицами ГАМКА -рецептора. Обнаружена 25%-ная гомология между нуклеотидными последовательностями всех трех субъединиц н-ХР.
На рис. 9 представлены консервативные участки известных нейрорецепторов, выявленных при анализе нуклеотидных последовательностей. Характерными особенностями являются высокая степень в гомологии аминокислотной последовательности и расположении трансмембранных участков М1-М4. Обязательное присутствие двух цистеинов в районе 140-150 аминокислоты на расстоянии 14 нуклеотидов друг от друга — отличительная черта нейрорецепторов 1-го класса. Возможно, что все эти нейрорецепторы принадлежат одному семейству белков, кодируемых родственными генами.

Глутаматные рецепторы. Наличие глутаматсвязывающей активности, независимой от присутствия в среде ионов Na, обнаружено практически во всех структурах головного мозга. Наибольшее количество этих участков — в коре больших полушарий, гиппокампе, полосатом теле, среднем мозге и гипоталамусе.
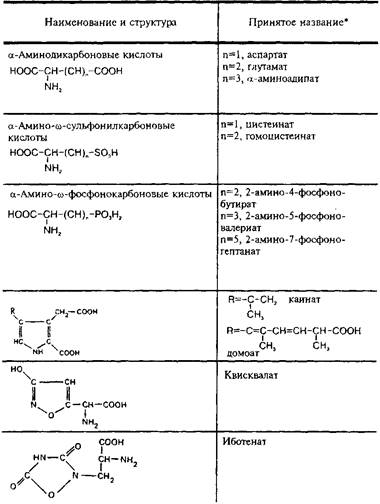
Согласно современным представлениям, существует несколько подтипов глутаматных рецепторов. Их классифицируют прежде всего на основе изучения действия широко известных аналогов глутамата: N-Memn-D-аспартата, а-амино-З-пид-рокси-5-метил-4-изоксазол-пропионовой кислоты, каиновой кислоты, квискваловой кислоты. В табл. 5 представлена структура дикарбоновых возбуждающих аминокислот и некоторых их аналогов. В литературе принято выделять прежде всего два главных подтипа глутаматных рецепторов: NMDA- и не-NMDA-рецепторы. К He-NMDA-рецепторам относятся рецепторы АМРА и каиновой кислоты, сходные по своим физико-химическим свойствам и распространенности в структурах мозга.
Рассмотрим прежде всего NMDA-рецепторы. Они образуют довольно широко распространенный подтип рецепторов глутамата, которые участвуют в разнообразных событиях в ЦНС. В мозге млекопитающих NMDA-связывающие участки локализованы главным образом в кортикальных структурах, базальных ганглиях и сенсорно-ассоциативных системах; наивысшая их плотность обнаружена в гиппокампе. Считают, что они имеют отношение к целому ряду процессов возбуждения, формированию нейрональной пластичности и механизмам памяти, а также к патологическим явлениям нейрональной дегенерации в случае болезни Альцгеймера, церебральной ишемии и др.
Таблица 5
Структура кислых возбуждающих аминокислот и некоторых
их аналогов
NMDA-рецепторы состоят из ряда субъединиц сМг = 40-92 кД и легко олигомеризуются, образуя высокомолекулярные комплексы сМг = 230-270 кД. Эти белки являются гликопротеид-липидными комплексами, формирующими ионные каналы для катионов Na+ , К+ , Са+ . Молекула глугаматного рецептора содержит большое количество гидрофобных аминокислот, которые связаны и с внутренней, и с внешней частью мембраны, организуя взаимодействие с липидами.
Рецептор NMDA имеет несколько участков, взаимодействующих аллостерически. Выделяют пять функционально различных участков, взаимодействие с которыми приводит к изменению активности рецептора:
1) участок связывания нейромедиатора;
2) регуляторный, или коактивирующий, глициновый участок;
3) участок внутри канала, который связывает фенциклидин и родственные соединения;
4) потенциал-зависимый Mg+ - связывающий участок;
5) тормозной участок связывания двухвалентных катионов. Наиболее специфический синтетический агонист этих рецепторов — NMDA — не обнаружен в мозге. Предполагается, что кроме глутамата эндогенными медиаторами в этих рецепторах является L-аспартат и L-гомоцистеинат.
Из наиболее известных антагонистов рецепторов NMDA типа можно назвать 0-2-амино-5-фосфоновалериат' и D-2- ами-но-7-фосфоногептаноат. Более специфичны, однако, новые синтетические антагонисты: 3--пропил-Ь-фосфонат и МК-801.СРРл МК-801 - это неконкурентные ингибиторы NMDA, они не действуют непосредственно на участки связывания глутамата.
Своеобразна роль глицинового участка. Глицин в концентрации ОД мкМ увеличивает ответы NMDA-рецептора, и этот эффект не может быть заблокирован стрихнином /напомним, что последний является блокатором самостоятельных глициновых рецепторов). Сам глицин не вызывает ^ответа, а лишь увеличивает частоту открывания канала, не влияя на амплитуду тока при действии агонистов NMDA. Наличке глицина вообще необходимо, поскольку при полном его отсутствии рецептор не активируется L-глутаматом.
Самой важной функцией, которую осуществляет рецептор NMDA в ЦНС, является управление ионным каналом. Важным свойством является способность канала после связывания аго-ниста пропускать ионы Na+ и К+ , а также ионы Са+ . Предполагают, что внутриклеточный Са+ , концентрация которого возрастает при участии рецепторов NMDA, вовлечен в инициацию процессов пластичности развивающегося и взрослого мозга.
Наибольшие токи при активации агонистами возникают при умеренной деполяризации мембраны: от -30 до -20 мВ и уменьшаются при высокой гиперполяризации или деполяризации; следовательно, ионные каналы NMDA-рецепторов являются в определенной мере потенциалзависимыми. Ионы Mg+ селективно блокируют активность рецепторов при таких сдвигах потенциалов. Ионы цинка также ингибируют ответ, но не имеют потенциалзависимого действия, очевидно влияя на другой участок связывания.
К другому подтипу рецепторов глутамата — не NMDA-pe-цепторам — относятся, в частности, рецепторы квискваловой кислоты. Изучение последних привело к пересмотру представления о том, что действие глутамата как нейромедиатора сводится лишь к деполяризации мембраны. Многие типы глутамат-ных рецепторов, и в особенности рецепторы квисквалата, могут функционировать как медленнодействующие метаботропные.
Они вполне соответствуют общим характеристикам метабо-тропных рецепторов, изложенным выше. Пептидная цепочка, составляющая их основу, содержит от 870 до 1000 аминокислотных остатков.
Часть He-NMDA-рецепторов—mGlnRl—реализует сигнал через О0 -белки и систему внутриклеточных посредников: инози-толтрифосфатов, диацилглицерола, ионов кальция и др.
Другая разновидность метаботропных He-NMDA-рецепторов — mGlnR2 — реализует сигнал, подавляя синтез цАМФ или активируя синтез цГМФ.
Имеются сведения о том, что рецепторы этой категории участвуют в механизмах синаптогенеза и в изменениях, возникающих при деафферентации. В целом этот тип глутаматных рецепторов, как полагают, участвует в механизмах пластичности аналогично рецепторам NMDA. Но при этом активация рецепторов NMDA блокирует механизм инозитолфосфатной регуляции, связанной с He-NMDA-рецепторами, и наоборот: антагонисты NMDA усиливают действие глутамата на не-NMDA-pe-цепторы.
Весьма интересным примером современных методов изучения рецепторов служит цикл работ с кДНК и ^РНК, кодирующими белки глутаматных рецепторов. Существуют библиотеки полноразмерных генов или их фрагментов мозга млекопитающих. Имея поликлональные антитела к самым разнообразным нейрорецепторам, можно выделить с помощью иммунологического скрининга клоны ДНК, способные продуцировать искомые белковые фракции. Так, недавно из библиотеки кДНК были выделены клоны рекомбинантного фага, дающие положительный иммунологический сигнал на антитела, полученные к глутаматсвязывающему мембранному белку с Мг = 60 кД. Анализ ДНК, выделенной из этого фага, позволил обнаружить наличие вставки кДНК размером 500 нлт, которая способна продуцировать белок с Мг = 14 кД и соответствует узнающей субъединице глутаматного рецептора.-^С помощью этой ДНК была выделена фракция мРНК, комплементарная данной последовательности ДНК. Для доказательства, что выделенная фракция мРНК кодирует синтез глутаматных рецепторов, она была инъецирована в ооциты лягушки, которые являются удобным объектом изучения электрофизиологических свойств нейрорецепторов. Ооциты лягушки обладают эффективным белок-синтезирующим аппаратом, но не имеют собственных нейрорецепторов. После инъекции чужеродной мРНК был измерен мембранный потенциал ооцитов в присутствии глутамата и его аналогов. Оказалось, что выделенная фракция мРНК способна кодировать синтез denovoглутаматных рецепторов каинатного типа.
Возможность одновременного синтеза всех подтипов глутаматных рецепторов в ооцитах лягушки была продемонстрирована другими исследователями. Введение тотальной мРНК, выделенной из мозга крыс, приводило к появлению электрофизиологических ответов у ооцитов на аппликацию NMDA, каината и квисквалата. Более того, ионные токи, регистрируемые на мембране, мало отличались от таковвгх:, обнаруженных на мембранах нейронов. Были, таким офазом, представлены убедительные факты в пользу того, что основные компоненты рецепторного комплекса для глутамата синтезируются совместно, причем биосинтез их не зависит от клетки-носителя и типа мембраны, в которую они затем встраиваются.
Перспективными являются исследования шклада глутаматных рецепторов в патохимию ряда заболеваний ЦНС. Полагают, что эти нейрорецепторы могут служить маркерами деструктив
ных повреждений возбуждающих глутаматергических путей головного мозга и участвовать в аутоиммунных реакциях организма человека. Установление роли глутаматных рецепторов в патогенезе нервно-психических заболеваний — это не единственное направление современной медицины. Появились уже конкретные примеры использования разных антагонистов глутаматных рецепторов против явлений укачивания, токсического действия высоких парциальных давлений кислорода, при лечении инсультов и др.. Кроме того, антагонисты глутаматных рецепторов могут составить основу для создания малотоксичных инсектицидных препаратов для сельского хозяйства.
Адренорецепторы История изучения адренорецепторов тесно связана с открытием биологической функции катехолами-нов в клетках надпочечников. Гипотеза о существовании этого вида рецепторов в самых разнообразных клетках наряду с исследованиями ХР оказалась наиболее плодотворной для развития теории взаимодействия физиологически активных веществ с рецепторами. Несмотря на то что адренорецепторы ъ нервной ткани присутствуют в относительно небольшом количестве, они играют важную роль в регуляции психоэмоциональных функций и деятельности всех отделов сердечно-сосудистой системы.
Адренорецепторы подразделяют на два типа:![]() , в зависимости от связывания адренотропных лигандов. Адренорецепторы
, в зависимости от связывания адренотропных лигандов. Адренорецепторы![]() и
и![]() , в свою очередь, могут быть разделены на подклассы
, в свою очередь, могут быть разделены на подклассы ![]() и
и![]() ,
,![]() и
и![]()
Для![]() ,
,![]() ,
,![]() и
и![]() -рецепторов характерна преимущественно постсинаптическая локализация, а для а2
-,, вторичный мессенд-жер, служащий активатором опять-таки протеинкиназ, но другого типа, нежели протеинкиназы, активируемые в результате включения aj-рецепторов.
-рецепторов характерна преимущественно постсинаптическая локализация, а для а2
-,, вторичный мессенд-жер, служащий активатором опять-таки протеинкиназ, но другого типа, нежели протеинкиназы, активируемые в результате включения aj-рецепторов.
G-белки — передатчики и модификаторы сигнала от собственного рецепторного белка — также имеют существенные отличия в разных классах адренергических рецепторов. Важным общим их свойством является взаимодействие х ГТФ и ГДФ. В неактивном состоянии они связаны с ГДФ. При взаимодействии нейромедиатора с рецепторным белком последний вступает в контакт с G-белком и меняет его конформацию так, что на место ГДФ становится ГТФ. С этого момента G-белок приобретает способность воздействовать на активность белка-эффектора. Однако G-белок является ГТФазой, быспро расщепляющей ГТФ до ГДФ. В результате он переходит в исходное состояние.
Заметим, что G-белок а2-адренорецетхиэтав, обозначаемый Gs
, активирует аденилатциклазу, обеспечивая, >в конечном счете, повышение уровня цАМФ и, далее, стимуляцию протеин-киназ. G-белки![]() - и
- и![]() -адренорецепторов — G-белки —обеспечивают, напротив, подавление активности щиклазы, снижение уровня цАМФ и, соответственно, снижение активности определенных протеинкиназ.
-адренорецепторов — G-белки —обеспечивают, напротив, подавление активности щиклазы, снижение уровня цАМФ и, соответственно, снижение активности определенных протеинкиназ.
Собственно рецепторный белок представляет собой пептидную цепочку с Мг порядка 60-80 кД, пронизывающую внешнюю мембрану так, что ее С-конец и ряд петлеобразных участков экспонированы наружу, а N-конец и опять-таки ряд петлеобразных участков обращены внутрь клетки. Нейромедиатор, взаимодействуя с обращенными наружу участками цепи, меняет конформацию всего белка, так что участки, обращенные внутрь, приобретают сродство к Gg-белку, Gj-белку или к О0 -белку. "Выбор" одного из этих белков определяется тонкими особенностями структуры R-бел-ка в области, обращенной внутрь клетки. Заметим также, что участки пептидной цепи, содержат по 20-25 преимущественно гидрофобных аминокислот, а петлевидные участки вне мембраны состоят преимущественно из гидрофильных аминокислот. N-конец полипептида обычно яддикозилирован, а на С-конце есть остатки серина и треонина, wropbie могут фосфорилироваться; последний процесс модулирует активность рецептора.
Практически любое изменение функции![]() и
и![]() -адренорецепторов сопровождается активацией системы внутриклеточных посредников, которые способны избирательно передавать внешний сигнал в цитоплазму и на генетический аппарат клетки. В этом случае геном нейрона может регулировать биосинтез мембранных компонентов или активировать процессы, связанные с их фосфорилированием. Последние реакции приводят к изменению хемочувствительности нервных клеток, иными словами, изменению "информационной емкости" нейронов, и их связывают с механизмом запоминания.
-адренорецепторов сопровождается активацией системы внутриклеточных посредников, которые способны избирательно передавать внешний сигнал в цитоплазму и на генетический аппарат клетки. В этом случае геном нейрона может регулировать биосинтез мембранных компонентов или активировать процессы, связанные с их фосфорилированием. Последние реакции приводят к изменению хемочувствительности нервных клеток, иными словами, изменению "информационной емкости" нейронов, и их связывают с механизмом запоминания.
Дофаминовые рецепторы. Прогресс в изучении структуры и функции дофаминовых рецепторов прежде всего был связан с обнаружением их антагонистов: производных фенотиазепама, галоперидола, спиропервдола и др. Радиолигандные исследования с помощью этих соединений показали, что в головном мозге имеются участки специфического связывания Н-галоперидола, Н-спироперидола и Н-апоморфина с параметрами, колеблющимися в пределах Кд ~7 нМ и Вмакс — 240-400 пмоль/мг белка.
Гетерогенность дофаминовых рецепторов ЦНС подтверждается не только биохимическими и фармакологическими экспериментами invitro. Анализ влияния различных дофаминсодер-жащих препаратов на поведение крыс обнаружил разные стереотипные двигательные реакции. Оказалось, что вращение крыс в ту или иную сторону опосредуется двумя разными классами дофаминовых рецепторов.
Все дофаминергические рецепторы являются метаботропны-ми, сопряженными с аденилатциклазой. Они классифицируются на 4 типа: Д^, Д2 -, Д3 - и Д4 по параметрам связывания их с агонистами и антагонистами и по белковой системе, трансформирующей сигнал. Наиболее изучены Др и Д2 -рецепторы. Д j -рецепторы активируют аденилатциклазу через 6£ -белок, а Д2 -рецепторы, напротив, подавляют аденилатциклазу через Gs -белок. Первые подавляются лишь относительно высокими, микромолярными концентрациями нейролептиков, в то время как для подавления вторых достаточны наномолярные концентрации. Количество и распространение Дри Д2 -рецепторов выше, чем Д3 и Д4 в ткани мозга, Д2 -рецепторы локализованы преимущественно в клетках ниг-ростриарной и мезкортиколимбической систем. Рвотное действие апоморфина — результат его взаимодействия с Д2 -рецепто-рами. Именно нарушение, несбалансированное усиление деятельности систем, связанных с Д2 -рецепторами, ассоциируют с синдромом шизофрении. Подавление Дг - и Д2 -рецепторов индуцирует нарушения различных форм стереотипных двигательных реакций. Одно из их проявлений — болезнь Паркинсона.
Рецепторы серотонина. Описание рецепторов серотонина облегчается их сходством с рецепторами норадреналина и дофамина. Это метаботропные рецепторы, локализованные как в мозге, так и на периферии. Известно несколько подтипов рецепторов серотонина, в частности 5НТ, сопряженный с аде-нилатциклазой, и 5НТ2 , сопряженный с фосфолипазой С. Последний особенно распространен в постсинаптических мембранах мозга. Специфические антагонисты — спиперон и кетансерин. Сложным является отношение этих рецепторов с производными лизергиновой кислоты, в том числе LSD. По отношению к некоторым разновидностям 5НТ2 -рецепторов он является агонистом, а к другим — антагонистом.
Активация 5НТ2 входит в систему реакций, индуцирующих ортодоксальный сон. По-видимому, дефицит или ингибирова-ние 5НТ2 связано с депрессивными состояниями, а активация некоторых из них — с галлюцинациями. Нарушения серотонин-ергической системы связывают и с такой патологией, как тяжелые формы мигрени. Существует характерный двигательный синдром, регулируемый 5НТ2 -рецепторами, — "отряхивание мокрой собаки", используемый нередко в исследованиях серотонинергической системы.
Функции 5НТ2 -рецепторов, также представленных и в мозге, и на периферии, изучены в меньшей мере. Одна из причин этого — отсутствие высокоспецифичных антагонистов.
Многообразными являются периферические эффекты активации рецепторов серотонина всех подтипов. Главные из них состоят в сокращении сосудов, положительных хроно- и инотропных воздействиях на сердце, а также в стимуляции аггрегации тромбоцитов.
Рецепторы гистамина. К настоящему времени выявлены и исследованы три типа рецепторов гистамина: Hjи Н? — постсинаптические и Н3 - пресинаптические. Рецепторы Hiявляются метаботропными, они сопряжены с фосфолипазой С и индуцируют образование инозитол-трифосфата и диацилглицерола. Ингибиторами Я^рецепторов служат димедрол, фенкарол, супрастин и другие соединения, получившие широкое применение в медицине. Метаботропными являются также рецепторы Н2 , однако они сопряжены с аденилатциклазой и индуцируют повышение уровня циклического АМФ. Хорошо изученным ингибитором Н2 -рецепторов является циметидин — известный противоязвенный агент. Пресинаптические рецепторы гистамина Н3 являются ауторецепторами. Они подавляют выход гистамина из нервных окончаний, т.е. осуществляют обратную связь между уровнем гистамина в синапсе и его секрецией.
Рецепторы пуринов. Последнее десятилетие ознаменовалось накоплением данных об обширном семействе рецепторов разнообразных пуринов: аденозина, АТФ, относительно мало изученного макроэргического соединения диаденозинтетрафосфа-та, а также АМФ и АДФ. Рецепторы пуринов делят на две большие группы: рецепторы, преимущественно взаимодействующие с аденозином, и рецепторы, преимущественно взаимодействующие с АТФ и АФА. Рецепторы аденозина Р1 являются медленными метаботропными рецепторами. Среди них есть рецепторы, подавляющие системы синтеза цАМФ, и рецепторы, напротив, активирующие синтез цАМФ.
Особого рассмотрения заслуживают свойства рецепторов А1. Значительная их часть локализована на пресинаптических мембранах. Довольно специфическими ингибиторами рецепторов А1 являются теофилин и кофеин. Иначе говоря, введение этих широко известных психостимулирующих агентов ведет к увеличению уровня цАМФ в некоторых постсинаптических структурах. Заметим, что кофеин и теофилин являются также довольно специфичными ингибиторами фосфодиэстераз, что тоже способствует повышению уровня цАМФ. Такое двустороннее действие этих соединений на уровень цАМФ позволяет понять их особое значение как психостимуляторов.
Рецепторы А1 включаются не только аденозином, но и АМФ, причем последний может происходить не только из нервных окончаний, но и из других образований мозга. Истощение энергетических систем мозга, связанное с образованием АМФ, может служить, таким образом, сигналом для включения рецепторов А1. Это позволяет лучше понять ряд физиологических эффектов, которые наблюдаются при срабатывании рецепторов А1: успокаивающие, седативные, противосудорожные. Иначе говоря, эти рецепторы выступают как защитники энергетических резервов мозга в экстремальных ситуациях. С этим же сопряжены их гипотензивные эффекты. Из периферических реакций на включение рецептора А1 отметим брадикардию и воздействие на автономные проводящие системы сердца. Адено-зин и его производные оказались перспективными средствами для лечения аритмий.
Из общих физиологических эффектов аденозиновых рецепторов А2 отметим стимуляцию глюконеогенеза и подавление агрегации тромбоцитов.
Рецепторы Р2, имеющие наибольшее сродство к АТФ и АФ4 А и наименьшее к аденозину и АМФ, также делятся на несколько подтипов. В отличие от аденозиновых рецепторов среди них есть быстрые, канальные рецепторы заслуживает периферический эффект такого макроэргического соединения, как АДФ —стимуляция тромбоцитов.
Рецепторы нейропептидов. Все рецепторы нейропептидов являются метаботропными, медленными рецепторами.
8-09-2015, 19:29
