Следует подчеркнуть, что изучение структуры и функции нейрорецепторов и других мембранных компонентов нейрона является не самоцелью для нейробиологической науки. Важно понять, как молекулярные процессы, происходящие в нервных клетках, способны интегрировать самую разнообразную информацию и реализовать ее в виде сложных поведенческих, высших психических и эмоциональных реакций. Этот стратегический путь "от простого к сложному" получил в последние годы мощный импульс благодаря разработке принципиально новых способов прижизненной регистрации динамических биохимических реакций, происходящих в клетках головного мозга. Появились методы позитронно-эмиссионной томографии, ядерно-магнитного резонанса, гамма-сцинциграфии и другие, позволяющие прижизненно регистрировать системный метаболизм разных органов и тканей, включая головной мозг млекопитающих. Это создает предпосылки для успешного изучения нейрохимических основ формирования разнообразных функциональных состояний живого мозга человека, его наиболее сложной сферы деятельности —психической.
Одним из информативных методов является позитронно-эмиссионная томография, суть которой сводится к регистрации специальным устройством радионуклидных маркеров — меченых химических соединений, включающихся специфически в тот или иной метаболический процесс. Причем этот процесс может быть воспроизведен в виде томографических, т.е. объемных послойных изображений распределения позитронной метки по структурам и зонам головного мозга. Наиболее точная локализация достигается при использовании одновременно двух противостоящих детекторов, регистрирующих совпадающие лучи. В настоящее время уже существует хорошо разработанные приемы оценки функционального состояния головного мозга с помощью измерения локального метаболизма глюкозы, медиаторов, С02 и кислорода в процессе разнообразной деятельности индивида.
Важной особенностью метода, позволяющей его использовать в прижизненном исследовании деятельности мозга людей, является применение изотопов, излучения которых с учетом сроков распада безвредны для организма.
Сейчас получены четко различающиеся "карты" излучений при различных формах деятельности мозга человека, например восприятия слов, обдумывания слов, воспроизведения энграмм и др. Резкие различия регистрируются при воздействиях на мозг наркотиков и других психотропных агентов.
Естественно, что при дальнейшей разработке метода ПЭТ и его внедрении в клиническую нейробиологию возник вопрос о выборе адекватных маркеров, которые способны выявлять си-наптические реакции в нервной ткани. Ряд исследователей успешно работают с препаратами, которые позволяют визуализировать определенные нейрорецепторы и выявлять конкретные медиаторные пути, включающиеся в выполнение того или иного вида деятельности мозга человека. В клинике этот метод дает возможность проводить раннюю диагностику не только опухолевых новообразований, но и контролировать различные деструктивные процессы. Кроме того, применяя его, можно определять эффективность лечебного воздействия фармакологических средств и их правильный выбор для успешного лечения болезней мозга. В качестве иллюстрации к сказанному следует привести исследования, проводимые Вагнером и его коллегами по изучению вклада дофаминергических путей и их рецепторов в патогенез некоторых заболеваний. Выбор дофаминовых рецепторов был обусловлен их четкой локализацией в некоторых подкорковых экстрапирамидных структурах и известной их дисфункцией при двигательных расстройствах, паркинсонизме и шизофрении.
Предпосылкой для применения в ПЭТ агонистов и антагонистов дофаминовых рецепторов явились результаты радиоли-гандного связывания известных аналогов дофамина с синаптическими мембранами invitro. Параметры связывания, константы диссоциации и количество связывающих участков сопоставляли с данными, полученными при ПЭТ, так как связывание радиофармпрепаратов с мембранами клеток, головного мозга invivoимеет аналогичные закономерности. Расчет прижизненного взаимодействия нейрорецептор-лиганд имеет некоторые особенности, однако они учитываются непосредственно в программах компьютерного обеспечения. Наиболее удачными радио-лигандами для исследования дофаминовых рецепторов оказались антагонисты п С-метилспиперон и л УС-спироперидол. Поглощение и селективная избирательность накопления этих соединений в базальных ганглиях головного мозга коррелировали со степенью деструктивного процесса у больных паркинсонизмом. Эти исследования подтвердили гипотезу о первичной вовлеченности нигро-стриарных структур в регуляцию двигательных функций.
Дальнейшее развитие регистрирующих устройств ПЭТ, увеличение степени разрешения приборов на микроуровне и поиск новых избирательных радиофармпрепаратов могут открыть уникальные перспективы прижизненного изучения динамических биохимических процессов, происходящих в ткани мозга при выполнении сложных видов деятельности.
9. ОБЩИЕ ХАРАКТЕРИСТИКИ СТРУКТУРЫ И ФУНКЦИИ ИОНОТРОПНЫХ РЕЦЕПТОРОВ
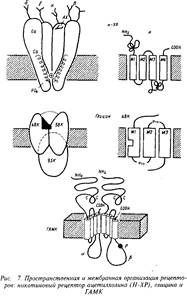
Основой всех ионотропных рецепторов является крупный белок, состоящий из пяти, реже четырех, белковых субъединиц. Молекулярные массы субъединиц варьируют обычно в пределах от 40 до 70 кД. Первичная структура белков различных ионотропных рецепторов обнаруживает высокую степень гомологии — от 20 до 60%, что указывает на общность эволюционного происхождения. Субъединицы рецептора пронизывают толщу клеточной мембраны, образуя ионный канал. Участки полипептидных полей субъединиц, выстоявшие над поверхностью клетки, служат для узнавания и взаимодействия с медиатором. Участки субъединиц, проходящие через толщу фосфолипидной мембраны и образующие собственно канал, характеризуются богатством гидрофобных неполярных аминокислотных остатков, обладающих высоким сродством к липидному окружению рецептора. Участки субъединиц, расположенные на внутренней поверхности мембраны, служат, во-первых, для взаимодействия с клеточными скелетными белками, ограничивающими их подвижность, и, во-вторых, являются мишенью для факторов, регулирующих активность рецептора в зависимости от ряда внутриклеточных процессов. Лучшим примером ионотропного рецептора служит рецептор ацетилхолина, представленный на рис. 7. Выстоящие над мембраной участки ионотропных рецепторов связаны нередко с углеводными компонентами.
Ионотропные рецепторы, например рецепторы гамма-ами-номасляной кислоты типа А, способны образовать большое количество подтипов за счет различного сочетания субъединиц. Существует более двух десятков подтипов ГАМКд-рецепторов благодаря различным комбинациям а-, р-, у- и5~субъединиц. В состоянии покоя каналы ионотропных рецепторов закрыты. При взаимодействии с медиатором происходит конформапионная перестройка субъединиц рецепторов и каналы открываются на несколько миллисекунду.
После активации рецепторные макромолекулы теряют на некоторое время чувствительность к медиатору. Наступает временная десенситизация.
Природа ионов, которые способен пропускать рецептор, определяется диаметром канала и характеристиками боковых радикалов аминокислотных остатков стенки канала. Никотиновые рецепторы ацетилхолина открывают дорогу ионам К* из клетки и ионам Na+ внутрь клетки; NMDA-глутаматные рецепторы наряду с одновалентными ионами, открывают путь внутрь клетки ионам Са+ ; ГАМКА и глициновые рецепторы пропускают внутрь клетки С1-ионы.
10. ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАБОТРОПНЫХ МЕДЛЕННЫХ РЕЦЕПТОРОВ
Метаботропные рецепторы представляют собой сложную систему, состоящую, по крайней мере, из трех белков: 1) собственно рецепторного белка, связывающегося с нейромедиатором; 2) так называемого G-белка, модифицирующего и передающего сигнал с рецепторного белка и 3) белка-эффектора, который является ферментом, катализирующим образование внутриклеточного низкомолекулярного регулятора, так называемого вторичного мессенджера. Пример метаботропного рецептора представлен на рис. 8.
Собственно рецепторный белок — R-белок — представляет собой крупный полипептид, состоящий из 400-2 ООО аминокислотных остатков, N-конец пептида выстоит над поверхностью клетки, С-конец направлен внутрь клетки. Пептидная цепь семь раз пересекает клеточную мембрану, образуя соответственно по три петли над и под поверхностью мембраны. N-концевая последовательность нередко гликозилирована. Те части пептида, которые пронизывают фосфолипидную мембрану, состоят в значительной мере из неполярных аминокислот и как бы плавают в липидном слое. Медиатор, вступая во взаимодействие с внешними участками полипептида, меняет их конформацию и, в свою очередь, меняет положение плавающих внутри мембраны участков пептида. В конечном счете это ведет и к изменению конформации участков пептида, находящихся под мембраной. В этой конформации они приобретают способность контактировать со следующим белком комплекса — G-белком. Заметим, что активированный медиатором R-белок способен контактировать последовательно с многими десятками и сотнями молекул G-белка, переведя их, в свою очередь, в активное состояние. Иначе говоря, уже на этой стадии происходит усиление, амплификация сигнала.
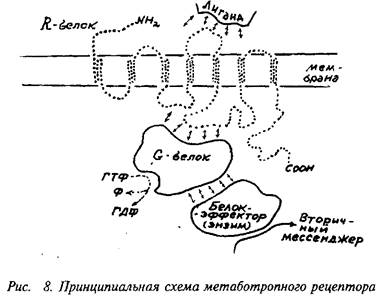
G-белок представляет собой олигомер, состоящий из 2-3 субъединиц с общей молекулярной массой порядка 60-100 кД, В неактивном состоянии G-белок обычно связан с молекулой ГДФ. При взаимодействии с активированным R-белком конфигурация G-белка меняется таким образом, что на место ГДФ становится ГТФ. Именно в состоянии комплекса с ГТФ G-белок способен быть активатором следующего компонента системы — фермента, образующего вторичный мессенджер. Активное состояние белка G-белка ограничено во времени тем, что связанные с ним ГТФ расщепляются до ГДФ, и G-белок при этом возвращается в исходное неактивное состояние. Расщепление ГТФ до ГДФ осуществляется самим G-белком, который является, как бы по совместительству, гуанозинтрифосфотазой.
Будучи в активном состоянии, G-белок активирует фермент. Этим ферментом может быть аденилатциклаза, катализирующая синтез цАМФ из АТФ, гуанилатциклаза, катализирующая синтез цГМФ из ГТФ, фосфолипаза С, отщепляющая фосфои-нозитол от фосфоинозитида мембраны. Активированный G-белок может выступать не только в роли фактора, усиливающего действие циклаз, но и в качестве их специфического ингибитора. Разновидности G-белка, выполняющие одну из этих функций, имеют обозначения: Gg-белок, стимулирующий активность циклаз, Gj-белок, подавляющий активность циклаз, и, наконец, О0 -белок, активирующий фосфолипазу С. Это лишь главные и наиболее изученные разновидности G-белков. Вообще их число значительно больше. Отметим особо разновидности G-белков, которые, получив сигнал от метаботропного рецептора, передают его на тот или иной ионный канал. Строго говоря, это уже не метаботропный путь, а особая форма включения ионного канала. В отличие от ионотропных рецепторов здесь может, по-видимому, быть достигнута большая продолжительность действия и охват большего числа ионных каналов.
Так же как и стадии передачи сигнала с R-белка на G-белок, стадия активации фермента и стадия синтеза ферментом вторичных мессенджеров сопровождается дальнейшим усилением сигнала.
8. ХАРАКТЕРИСТИКИ ОТДЕЛЬНЫХ РЕЦЕПТОРНЫХ СИСТЕМ
Большинство известных в настоящее время нейромедиаторов участвуют в передаче сигнала и через ионотропные, и через метаботропные рецепторы. Это заставляет строить дальнейшее изложение, следуя перечню медиаторов.
Ацетилхолиновые рецепторы. Ацетилхолин как нейромедиатор периферической и центральной нервной системы взаимодействует с двумя видами холинорецепторов: мускариновыми и никотиновыми. Эти подтипы рецепторов отличаются по специфичности взаимодействия с рядом агонистов и антагонистов ацетилхолина. Так, м-ХР избирательно возбуждаются мускарином, а н-ХР.отвечают на аппликацию никотина. Физиологически важным различием между м-ХР и н-ХР является скорость ответа на приходящий сигнал. Считают, что н-ХР предназначены опосредствовать быстрые и непродолжительные эффекты, в то время как м-ХР реагирует более медленно и длительно.
Никотиновые холинорецепторы. н-ХР оказались более изученными биохимически благодаря существованию двух факторов: наличие специфического нейротоксина, способного блокировать функцию рецептора, и обнаружению большого количества этого рецептора в электрических органах рыб. Структура представлена на рис. 7.
Н-ХР содержит 5 субъединиц: две а-субьединицы с Мг = 40 кД, одну р-субъединицу — Мг = 49 кД, одну у-субъединицу — 60 кД и одну 5-субъединицу — Мг = 67 кД. Катионные группы двух молекул ацетилхолина связываются с анионными участками ct-субъединиц. KD взаимодействия АХ с рецептором близко к 10~ М. Открывающийся при контакте с АХ на несколько миллисекунд канал успевает пропустить до 5-Ю ионов К+ и Na+ . АХ, диссоциировавший с рецептором, или "избыточный" АХ в синаптической щели быстро расщепляется ферментом ацетилхолинэстеразой, расположенной на постсинаптической мембране в непосредственной близости от рецептора. Ацетилхолинэстераза является одним из самых быстродействующих, высокооборотных ферментов. Таким образом, сигнал резко ограничен во времени. Образовавшийся холин захватывается белками-транспортерами пресинаптической мембраны и служит далее для ресинтеза АХ в терминал и.
Активность рецептора может модулироваться со стороны клетки фосфорилированием отдельных аминокислотных остатков участка, обращенного внутрь клетки. Подвижность рецептора ограничена связью с цитоскелетными белками через так называемый белок 43К.
По характеру влияния веществ на функцию ХР можно выделить: агонистпы, антагонисты и блокаторы. Наиболее известные из нихпредставлены в табл. 3.
Таблица 8Л
Лиганды холинорецепторов
| Типы лигандов | ||
| никотиновые | мускариновые | |
Агонисты Антагонисты, Блокаторы |
Ацетилхолин, карбахол, никотин, лобелии, 1,1 -диметил-4-фенил-пиперазин Гексаметоний, декамстоний а - Бунгаротоксин 6 - Тубокурарин |
Ацетилхолин, карбахол, метахолин, мускарин, диметил ацетилхолин Атропин, галл амин, платифиллин |
Способность разных соединений взаимодействовать с этими рецепторами имеет не только теоретическое, но и большое практическое значение. Поскольку нарушение холинергической медиации лежит в основе ряда патогенетических механизмов заболеваний нервной, эндокринной, иммунной систем, то поиск лекарственных веществ, непосредственно воздействующих на пострецепторные механизмы, является эффективным. Действительно, как показала практика, многие используемые в клинике н-холинергические фармпрепараты имеют точкой своего приложения периферические моторные синапсы, ганглии и некоторые хемочувствительные структуры висцеральных систем. Часто в клинике применяют блокаторы н-ХР, среди которых выделяют ганглиоблокаторы и миорелаксанты. Нарушение функции никотиновых ХР лежит в основе тяжелого прогрессирующего заболевания — миастении гравис. Болезнь резко снижает эффективность нервно-мышечных соединений и обусловлена появлением аутоантител к ХР. Показательно, что содержание аутоантител к ХР в крови больных коррелирует с клиническим состоянием: более высокие титры аутоантител наблюдаются у тяжелых больных миастенией. Лечение этой категории больных с помощью иммунодепрессантов вызывает длительные положительные сдвиги в клинической картине заболевания.
Мускариновые рецепторы ацетилхолина. Эта категория рецепторов ацетилхолина относится к категории метаботропных. Общие их характеристики уже описаны выше. Структурная модель м-ХР представлена на рис. 8. Пептидная цепь, образующая основу м-ХР, состоит из 800-950 аминокислотных остатков и связана с углеводными компонентами. Существует большое число подтипов м-ХР, связанных с различными физиологическими эффектами. В частности, рецепторы м2 -ХР, локализованные преимущественно в ЦНС и сердце, продуцируют в качестве вторичных мессенджеров цГМФ и подавляют аденилатциклазу. Рецепторы подтипа МрХР, расположенные, в частности, в желудке и симпатических ганглиях, индуцируют образование инозитолфосфатов и диацилглицерола, которые, в свою очередь, ведут к повышению в цитозоле концентрации Са+ и активации протеинкиназы С. Вторичное модулирующее воздействие они оказывают на кальциевые каналы. Различия рецепторов м1 и м2 выражается также в высоком и низком, соответственно, сродстве к ацетилхолину. Последовательность многообразных молекулярных событий, ведущих к ответу клетки на действие лигандов для м-ХР, показана на схеме 1.
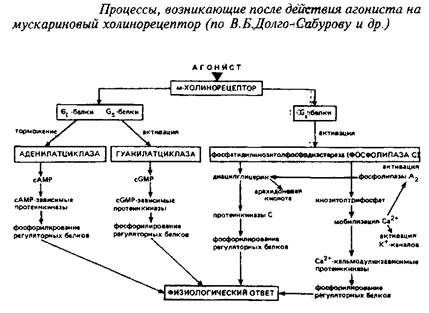
Мускариновые рецепторы АХ связаны с психоэмоциональным восприятием, секрецией слюнных и желудочных желез, функцией сердечно-сосудистой системы и др. Антагонисты м-ХР применяются в клинике в качестве язвазаживляющих, спазмолитических препаратов, а также используются для симптоматического лечения паркинсонизма. В качестве успокаивающих средств, транквилизаторов находят применение в терапии амизил и метамизыл — центральные блсекаторы м-ХР.
Таблица 4.
Специфические агонисты и антагонисты ШМК-рецепторов
| Типы лигандов | Типы ГАМК-рецепторов | |
| ГАМКА | ГАМКВ | |
| Агонисты | Гамма-аминомасляная кислота, мусцимол | .Гамма-аминомасляная кислота, баклофен |
| Антагонисты | Бикукулин, пикротоксин | Дельта-амкно валериановая кислота |
Наконец, мощное влияние на активность холи-нергической передачи оказывают агенты, ингибирующие холи-нестеразу и повышающие тем самым концентрацию АХ в си-наптической щели. Таков механизм действия эзерина и его аналогов, применяемых для снижения внутриглазного давления.
ГАМК-рецепторы. Успехи в идентификации различных типов ГАМК-рецепторов, их биологических и фармакологических характеристик тесно связаны с созданием специфических аго-нистов и антагонистов. По локализации ГАМК-рецепторы подразделяются на центральные и периферические, пре-и постсинаптические. Различают два типа рецепторов ГАМК: бикукулин-чувствительные и баклофен-чувствительные. Наиболее изученным является первый тип рецепторов, который чувствителен также к антагонисту пикротоксинину. Обнаружено, что этот тип рецепторов является быстродействующим и сопряжен с ионными каналами для СР. Другой тип ГАМК-рецепторов относится к медленнодействующим рецепторам, и полагают, что он через G-белок ассоциирован с каналами для ионов К+ и Са+ .
Исследования физико-химических свойств очищенного ГАМКд-белка показали, что Мг его находится в пределах 220-270 кди что он представляет собой пентамер гликопротеидли-пидной природы, образующий каналы для ионов хлора.
Особенностью ГАМКА -рецепторов является то, что они содержат специфические участки связывания не только самой ГАМК, но и других физиологически активных соединений. Наиболее интересными и изученными среди них являются лекарственные соединения, объединенные под названием бензо-диазепины а также эндогенные регуляторы пептидной природы — эндозепины.
Среди лекарственных веществ бензодиазепины занимают особое место в связи с их широким лечебным спектром действия: противосудорожного, снотворного, нейротропного, анти-ксиолитического и др.
Важной особенностью функционирования ГАМК-ергической трансмиссии является система удаления выполнившего свою функцию или избыточного лиганда из синаптической щели. В отличие от многих других синаптических систем ГАМК преимущественно претерпевает обратный захват и возвращается в нервные окончания с помощью белков-транспортеров. Они расположены на пресинаптической мембране и несколько похожи по особенностям структуры на метаботропные рецепторы: пептидная цепь, многократно пересекающая мембрану с образованием системы петель над и под мембраной. Белок-транспортер узнает, захватывает и за счет энергии протонного насоса '.переносит ГАМК внутрь терминали.
Места специфического связывания бензодиазепинов находятся на молекулах белка, входящего в структуру рецептора ГАМК. Активация ГАМКА -рецепторов приводит к открытию ионного канала для хлора, а бензодиазепины.при этом удлиняют продолжительность существования открытых ионных каналов, не влияя на их число и скорость транспорта хлора.
Установлено, что участок связывания бензодиазепинов взаимодействует также с эндогенными пептидными регуляторами — эндозепинами. Последние обладают физиологическими эффектами, противоположными бензодиазепинам, — вызывают возбуждение, тревожность и проконфликтное поведение животных. Они подавляют открытие канала для CP, индуцируемое ГАМК, т.е. являются ее эндогенными функциональными антагонистами. Таким образом, бензодиазепины оказались блокаторами участка связывания эвдозепинов, т.е., так сказать, экзогенными антагонистами эндогенных антагонистов ГАМК. Понятно поэтому, что эндозепины обозначают иногда аббревиатурой DBI.
Имеются указания на существование в ЦНС еще одной категории эндогенных антагонистов ГАМК — производных р-кар-болинов. Они также вызывают тревожность, панические состояния у животных и человека.
Что касается второго типа ГАМК-рецетгоров — ГАМКВ , то кроме отмеченных выше особенностей агонистов и антагонистов они характеризуются преимущественно пресинаптической локализацией и сопряженностью с калиевыми, а не с хлор-каналами; локализованы они главным образом.в периферической нервной системе.
Глициновые рецепторы. Радиолигандные исследования позволили локализовать и изучить особенности распределения в центральной нервной системе участков связывания, которые метятся Н-стрихнином. Эти участки, имеющие Кд = 10~ М, являются рецепторами глицина. Наибольшая плотность глициновых рецепторов обнаружена в области ядер.подъязычного и тройничного нервов, локализованных в продолговатом мозге.
Участки связывания стрихнина найдены также в ретикулярных ядрах продолговатого мозга, моста и среднего мозга. Серое вещество спинного мозга также отличается высокой плотностью глициновых рецепторов как в передних, так и в задних рогах.
Глициновый рецептор спинного мозга млекопитающих был очищен с помощью аффинной хроматографии на аминострих-нин-агарозе. Обнаружено, что он представляет собой гликопро-теид-липидный комплекс с Мг
= 250 кД, состоящий из 3 полипептидов: 48, 58, 93 кД. Стрихнин
8-09-2015, 19:29
