
Рис. Обмен газов через стенку альвеолы
4. Жизненная емкость легких, дыхательный, дополнительный, резервный остаточный воздух. Минутный объем дыхания (МОД). Возрастные особенности внешнего дыхания.
Легкие окружены герметически замкнутой плевральной полостью, в которой содержится 1—5 мл серозной жидкости, распределенной по легочной поверхности тонким слоем (толщина этого слоя 5—10 мкм). Благодаря этому висцеральный и париетальный листки плевры способны скользить относительно друг друга, что позволяет легким следовать за изменениями формы грудной клетки, не деформируясь.
В спокойном состоянии взрослый человек вдыхает и выдыхает в среднем 500 см3 воздуха (от 300 до 600). Этот объем воздуха называется дыхательным. Не весь дыхательный объем поступает в легочные альвеолы. Часть поглощенного воздуха остается в ротовой полости, носоглотке, гортани, трахее и бронхах. Эта часть дыхательных путей, в которых поглощенный воздух не приходит в соприкосновение с кровью, называется мертвым или вредным пространством. Его объем у взрослого человека равен 140-160 см3 и несколько увеличивается при расширении бронхов вследствие расслабления их мускулатуры и , наоборот, уменьшается при сужении бронхов, сокращении их мускулатуры.
Объем легких определяется силой PL , которая равна разности между давлением в альвеолах РА и внутриплевральным (внутригрудным) давлением Ppl RL = РА — Ppl . В нормальных условиях легкие всегда растянуты. На их поверхности создается некоторое напряжение, обусловленное растяжением эластических элементов легочной ткани (так называемая эластическая тяга легких) и силами поверхностного натяжения в стенках альвеол. Эти силы обеспечивают отрицательное давление в плевральной полости (по отношению к давлению в альвеолах). Поэтому Ppl , численно равно эластической тяге легких EL . В конце выдоха внутриплевральное давление ниже атмосферного на 3—5 см вод. ст. (0,3—0,5 кПа), а на высоте вдоха — на 6—8 см вод. ст. (0,6—0,8 кПа).
При спокойном Д. в течение одного вдоха в легкие поступает 400—500 мл воздуха (дыхательный объем — ДО), а при максимально глубоком вдохе — еще примерно 1500 мл воздуха (резервный, или дополнительный, объем вдоха — РОвд. ). После спокойного выдоха человек может дополнительно выдохнуть примерно 1500 мл воздуха (резервный объем выдоха — РОвыд. ), такое же количество воздуха остается в легких после максимального выдоха (остаточный объем легких — ООЛ). Объем воздуха в легких в конце спокойного выдоха называется функциональной остаточной емкостью (ФОЕ), которая представляет собой сумму показателей РОвыд. и ООЛ. Наибольшее количество воздуха, которое можно выдохнуть после максимального вдоха, — это жизненная емкость легких, которая является суммой величин показателей ДО, РОвд. , РОвыд. и в среднем равна 3500 мл. Общая емкость легких (ОЕЛ), т.е. количество воздуха, содержащееся на высоте максимального вдоха, равна сумме показателей жизненной емкости легких (ЖЕЛ) и ООЛ.
Все три объема – дыхательный, резервный объем вдоха и резервный объем выдоха – составляют жизненную емкость легких, сокращенно ЖЕЛ.
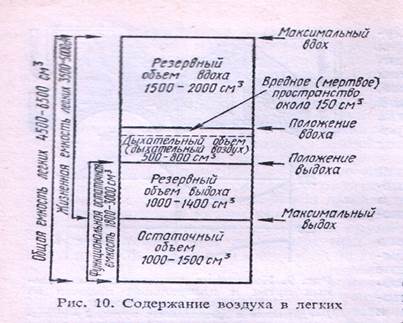
Она представляет собой наибольший объем воздуха в легких, который может быть набран при однократном вдохе.
У человека жизненная емкость легких равна 3-4 дм3 . Жизненная емкость увеличивается с возрастом в связи с ростом грудной клетки и легких. С 18 до 35 лет она максимальна, а после 35-40 лет уменьшается. У женщин жизненная емкость меньше, чем у мужчин. Жизненная емкость возрастает с увеличением длины тела (на каждые 5 см роста она возрастает на 400 см3 ) и объема туловища (который в среднем в 7 раз больше жизненной емкости).
Измерение жизненной емкости легких называется спирометрией. Даже после сильнейшего выдоха в легких человека остается около 1 дм3 воздуха, который не может быть удален. Этот объем воздуха, остающийся в легких и после смерти, называется остаточным. С возрастом у людей остаточный объем возрастает. Общая емкость легких состоит из жизненной емкости и остаточного объема.
Из числа указанных показателей наибольшее практическое значение имеют ДО, ЖЕЛ и ФОЕ. Величина ЖЕЛ зависит от возраста, пола, размеров и положения тела, степени тренированности. У женщин ЖЕЛ в среднем на 25% меньше, чем у мужчин. Благодаря функциональной остаточной емкости поддерживается постоянство содержания кислорода и углекислого газа в альвеолярном воздухе независимо от дыхательных движений. Поскольку ФОЕ в несколько раз больше ДО, изменение состава альвеолярного воздуха при вдохе относительно невелико. В среднем ФОЕ у людей молодого возраста составляет 2,4 л, а в пожилом возрасте — 3,4 л. У женщин ФОЕ примерно на 25% меньше, чем у мужчин.
Минутный объем дыхания (МОД) — объем вдыхаемого или выдыхаемого воздуха за 1 мин — рассчитывается путем умножения величины дыхательного объема на частоту дыхания. В покое МОД равен 6—9 л. Максимальная вентиляция легких колеблется в диапазоне 80—90 л/мин, достигая у тренированных лиц 170 л/мин.
При условии нормальной функции легких только около 2 /3 каждого дыхательного объема достигают альвеол, снабжаемых смешанной венозной кровью, и т.о. принимают участие в газообмене. Этот объем составляет так называемую эффективную, или альвеолярную, вентиляцию. Остающаяся треть, не участвующая в газообмене, — мертвое, или вредное, пространство. Оно включает анатомическое мертвое пространство (объем газа, который вентилирует воздухоносные пути) и альвеолярное мертвое пространство (объем газа, который можно рассматривать как не принимающий участие в газообмене на альвеолярном уровне).
Объем анатомического мертвого пространства зависит от размеров легких и составляет примерно 2,22 мл на 1 кг массы тела. В клинической практике объем анатомического мертвого пространства у взрослого человека принято считать равным 150 мл. Альвеолярное мертвое пространство не имеет четких анатомических границ. У здорового человека в положении лежа на спине анатомическое и альвеолярное мертвое пространство почти равны, при этом альвеолярное мертвое пространство минимально мало. В вертикальном положении, когда в высоко расположенные альвеолы не поступает воздух, оно может возрастать на 60—80 мл. При тяжелых заболеваниях легких с выраженным несоответствием между легочной вентиляцией и кровоснабжением альвеол альвеолярное мертвое пространство может увеличиваться на 100—120 мл.
Часть минутного объема дыхания, достигающая альвеол, называется альвеолярной вентиляцией. Именно от этой величины зависит поддержание газового состава альвеолярного воздуха. Поскольку объем мертвого пространства постоянен, альвеолярная вентиляция тем больше, чем глубже дыхание.
Состав альвеолярного воздуха на относительно постоянном уровне поддерживают механизмы регуляции внешнего Д. Недостаточная вентиляция легких (гиповентиляция) ведет к увеличению в крови напряжения углекислоты (гиперкапния) и уменьшению напряжения кислорода (гипоксемия). Следствием этих изменений является увеличение вентиляции легких (гипервентиляция) за счет как увеличения глубины Д. (гиперпноэ), так и возрастания частоты дыхательных движений (тахипноэ).
Избыток вентиляции легких ведет к снижению напряжения углекислоты в крови (гипокапния) и повышению напряжения кислорода (гипероксия). В результате дыхательные движения ослабевают (брадипноэ) или временно прекращаются (апноэ). Особыми типами вентиляции легких являются диспноэ — одышка, сопровождающаяся неприятным субъективным ощущением недостаточности или затруднения Д., и ортопноэ — выраженная одышка, связанная с застоем крови в легочных капиллярах в результате левожелудочковой сердечной недостаточности.
На вентиляцию легких влияют многие неспецифические факторы. К ним относятся прежде всего колебания температуры окружающей среды. Сильные холодовые или тепловые воздействия на кожу могут приводить к возбуждению дыхательного центра. Кроме того, Д. зависит от изменений температуры тела: как ее повышение (при лихорадочном состоянии), так и незначительное понижение (умеренная гипотермия) сопровождаются увеличением вентиляции легких. Резкое охлаждение (глубокая гипотермия) приводит к угнетению дыхательного центра. К неспецифическим факторам, влияющим на Д., относится также боль.
Величина минутного объема дыхания зависит от напряжения углекислого газа в артериальной крови и цереброспинальной жидкости. Напряжение углекислого газа воспринимается периферическими и центральными хеморецепторами. Периферические рецепторы локализуются в параганглиях каротидных синусов, расположенных у места деления общей сонной артерии на внутреннюю и наружную (каротидные тельца), и параганглиях дуги аорты (аортальные тельца). Хеморецепторы, находящиеся в этих образованиях, возбуждаются при повышении напряжения углекислого газа, уменьшении рН и снижении напряжения кислорода в артериальной крови.
Центральные хеморецепторы, настроенные на содержание в крови СО2 и ионов Н+ , расположены преимущественно на вентральной поверхности продолговатого мозга. Импульсация от хеморецепторов обеспечивает быстрые реакции дыхательного центра. При небольшом понижении напряжения кислорода в крови наблюдается рефлекторное учащение ритма дыхания, а при незначительном повышении напряжения углекислоты в крови происходит рефлекторное углубление дыхательных движений.
Дыхательный центр получает афферентные импульсы не только от хеморецепторов, но и от барорецепторов сосудистых рефлексогенных зон, а также от механорецепторов легких, дыхательных путей и дыхательных мышц. Именно импульсы от механорецепторов легких, поступающие к дыхательному центру по блуждающим нервам, определяют рефлекторную зависимость частоты и глубины Д. от объема легких (рефлексы Брейера и Геринга). У животных после перерезки блуждающих нервов Д. не прекращается, но становится реже и глубже. Жизненно важная функция Д. возможна лишь при ритмическом чередовании вдоха и выдоха и регулируется сложным нервным механизмом.
Газовую смесь в альвеолах, участвующую в газообмене, называют альвеолярным воздухом, или альвеолярной смесью газов. Содержание в ней различных газов относительно постоянно, что обеспечивает заключительный этап внешнего Д. — переход из альвеол в кровь легочных капилляров кислорода и в обратном направлении углекислого газа. Этот процесс представляет собой диффузию, движущей силой его является градиент парциальных давлений кислорода и углекислого газа.
У новорожденных и недоношенных детей отмечается выраженная дыхательная аритмия вследствие незрелости дыхательного центра. В периоде новорожденности частота дыхания оставляет 40—60 в минуту, она увеличивается даже при незначительном возбуждении. Вследствие горизонтального положения ребер и слабого развития дыхательных мышц Д. у новорожденных поверхностное, осуществляется во многом за счет диафрагмы. Метеоризм, аэрофагия, гепатолиенальный синдром способны уменьшать альвеолярную вентиляцию.
Чем меньше возраст ребенка, тем уже дыхательные пути: диаметр долевых бронхов новорожденного — 1,5, в 1 год — 3, в 4 года — 3,5 мм у взрослых — 5—6 мм). Давление в плевральной полости у новорожденных также отличается некоторыми особенностями. Через несколько минут после первого вдоха это давление на высоте вдоха составляет — 10 см вод. ст. — 1 кПа). Однако в конце выдоха разница между внутриплевральным и атмосферным воздухом у новорожденного равно 0. По мере роста организма эластическая тяга легких в конце выдоха постепенно увеличивается. Склонность к обструкции, образованию ателектазов, а также повышенная васкуляризация слизистых оболочек способствуют генерализации воспалительных процессов. Функционально дети первых дней жизни адаптированы к ацидозу и гипоксии. Наличие фетального гемоглобина в крови у новорожденных улучшает связывание кислорода в условиях низкого рН. Отклонения от индивидуальных физиологических норм дети переносят даже несколько лучше, чем взрослые. Однако чем меньше возраст ребенка, тем сильнее воздействие на Д. наркотиков и различных токсических веществ.
При старении организма вследствие изменений костно-мышечного аппарата грудной клетки, воздухоносных путей, легочной паренхимы, сосудов малого круга кровообращения условия легочной вентиляции ухудшаются. Снижается максимальная вентиляция легких — объем воздуха, проходящий через легкие за определенный промежуток времени при Д. с наиболее возможными частотой и глубиной. В результате увеличения физиологического мертвого пространства уменьшается доля альвеолярной вентиляции в минутном объеме Д. Снижение эффективности вентиляции связано с нарушением равномерности распределения вдыхаемого воздуха из-за потери легочной тканью эластичности, наличия ателектатических участков, а также нарушения бронхиальной проходимости. Отмечается несовершенство адаптивных механизмов внешнего Д. Так, у лиц пожилого и старческого возраста МОД увеличивается преимущественно за счет частоты, а не глубины Д., максимум респираторных реакций смещается к концу нагрузки, нарушается четкое соотношение между интенсивностью работы и изменением дыхательной функции, удлиняется период восстановления сдвигов, увеличивается кислородный долг.
5. Зависимость между интенсивностью внешнего дыхания и газовым составом крови. Описание опытов, иллюстрирующих эту зависимость .
Главным фактором, определяющим уровень дыхательных движений в организме, является концентрация СО2 в крови. Повышение его содержания увеличивает возбудимость структур дыхательного и пневмотаксического центров, в результате чего усиливается и учащается дыхание. Первый вдох у новорожденного также связан с увеличением концентрации СО2 в крови ребенка после отделения его от плаценты. Эта концентрация, достигнув порогового значения, активизирует нервные структуры дыхательного центра. Экспериментальными исследованиями показано, что основным фактором, стимулирующим деятельность структур дыхательного центра, является не уменьшение количества О2 , а увеличение СО2 в крови (состояние гиперкапнии). С понижением концентрации СО2 в крови связана задержка вдыхании, наступающая после нескольких глубоких дыхательных движений, так как при этом из крови вымывается большое количество СО2 и концентрация последнего в ней падает ниже порогового (т.е стимулирующего вдох) значения (наступает гипокапния). Стимулирующий эффект повышенного содержания СО2 в крови связан как с прямым действием его на клетки дыхательного центра, так и с опосредованным рефлекторным влиянием на дыхательный ритм через хеморецепторы кровеносных сосудов. Прямые доказательства участия СО2 в генерации нервных импульсов получены на гигантских нервных клетках ганглия моллюска Aplysia. Увеличение СО2 в среде приводило к деполяризации клеточной мембраны и возникновению группы потенциалов действия. (Физиология человека и животных /под ред. Когана А.Б.)
Другим важным фактором регуляции постоянства газового состава крови является рефлекторный механизм регуляции глубины и частоты дыхательных движений путем активации хеморецепторов каротидных синусов. У основания каждой из внутренних сонных артерий расположены каротидные синусы, в которых находятся хеморецепторные клетки, чувствительные к изменениям химического состава крови. Аналогичные хеморецепторные образования расположены в дуге аорты. Понижение напряжения О2 в крови, стимулируя хеморецепторы сосудистых стенок, вызывает рефлекторное учащение дыхания.
В острых и хронических экспериментах показано, что рефлекторное изменение (уселение) дыхательных движений через хеморецепторы каротидных синусов является основным механизмом регуляции дыхания в зависимости от содержания О2 в артериальной крови. О решающей роли каротидных и аортальных рефлексогенных зон в поддержании постоянства напряжения О2 в крови свидетельствует тот факт, что после денервации этих зон реакция дыхания на гипоксию исчезает, в то время как реакция дыхания на гиперкапнию сохраняется. Следовательно, физиологическое значение СО2 в организме определяется не только его участием в механизме рефлекторной саморегуляции дыхания, но и важной ролью в прямой активации структур дыхательного центра. Перерезка обоих блуждающих нервов на шее приводит к резкому замедлению ритма дыхательных движений, движение при этом становится более глубоким. Экспериментально показано, что по блуждающим нервам распространяются центростремительные нервные импульсы, оказывающие постоянное влияние на деятельность нейронов дыхательных центров. Центростремительный характер этой импульсации доказывается тем, что раздражение центрального отрезка перерезанного нерва почти всегда оказывает четкий эффект на дыхательные движения. В составе блуждающего нерва выявлены две группы волокон: одни оказывают влияние, аналогичное раздражению любого сенсорного нерва, другие – являются специфическими афферентными путями дыхательной системы. Перерезка волокон второй группы приводит к длительным изменениям характера дыхательных движений.
Поддержание постоянства газового состава крови по отношению к СО2 обеспечивается в основном прямой реактивностью дыхательного центра на высокое содержание СО2 в крови. При низком напряжении О2 в крови прямая реакция структур дыхательного центра имеет гораздо меньшее значение, чем активация хеморецепторов каротидных и аортальной зон. Хеморецептивные реакции каротидных и аортальной зон сосудистой стенки усиливают прямые гуморальные эффекты на дыхательный центр, так как рефлекторная реакция на гиперкапнию и гипоксемию (уменьшение О2 в крови) качественно протекает так же, как и прямая реакция нейронов дыхательного центра на гуморальные стимулы. Обычно при гиперкапнии наступает углубление дыхания в то время, как гипоксемия вызывает значительное увеличение частоты дыхательных движений.
6. Представление о дыхательном центре. Роль в регуляции дыхания СО2 и О2 .
Понятие о дыхательном центре появилось в 18 в. Современные электрофизиологические методы исследования позволили выявить определенные группы так называемых дыхательных нейронов.
К дыхательным нейронам относят нервные клетки, импульсная активность которых меняется в соответствии с фазами дыхательного цикла. Различают инспираторные нейроны, которые разряжаются в фазу вдоха, экспираторные, активные во время выдоха, и целый ряд нейронных популяций, активность которых или занимает часть определенной фазы дыхательного цикла (ранние, поздние), или включается в моменты перехода инспираторной фазы в экспираторную либо экспираторной в инспираторную.
Центральный дыхательный механизм входит в состав ретикулярной формации ствола мозга. Подавляющая масса дыхательных нейронов сосредоточена в двух группах ядер: дорсальной и вентральной.
Активность центрального дыхательного механизма управляется стимулами, исходящими от хеморецепторов и механорецепторов дыхательной системы. Главная особенность работы этого механизма – линейное нарастание активности инспираторных нейронов на протяжении вдоха и резкий обрыв инспираторной активности, знаменующий окончание вдоха и переход к выходу. Центральный дыхательный механизм продолговатого мозга обладает автоматией, т.е. постоянной ритмической активностью. Важнейшую роль играет импульсация, поступающая от хеморецепторов.
Регуляция Д. осуществляется ЦНС.
8-09-2015, 19:51
