Появились более точные технологии изучения генома бактерий, пределом точности является определение нуклеотидной последовательности, точнее карту построить невозможно. На этой карте расстояние обозначается уже не в минутах, а в парах нуклеотидов.
Метод определения последовательности нуклеотидов, или секвенирование, был разработан в 70-х годах. Две группы ученых независимо друг от друга разрабатывали эти методы. Один из них был разработан Сэнгером, второй – Максамом и Гилбертом, и все они получили в 1980 году Нобелевскую премию. До сих пор созданные ими принципы используются при секвенировании, сейчас уже проводимом не вручную, а автоматами.
В 1995 году был прочтен первый относительно небольшой геном бактерии Haemophilus influenzae . Это было огромным достижением, очень большой сенсацией. До этого удавалось определить полностью только геномы вирусов, которые на порядок меньше геномов бактерий. На настоящий момент полностью прочитаны геномы более 100 видов бактерий.
Что удается узнать о бактериях по их геному?
Состав генома (какие гены присутствуют)
Раньше, чтобы узнать что-то о бактерии, надо было долгие годы исследовать ее способность расщеплять те или иные сахара, другие питательные вещества, установить, какая температура оптимальная для ее роста, получить множество мутантов, для того, чтобы построить генетическую карту генома бактерии. Но сейчас можно очень многое узнать о неизвестной бактерии, если прочесть ее геном. По тому, какие гены входят в состав генома, можно определить, какой образ жизни ведет бактерия. Это важно для возбудителей различных заболеваний – по составу их генов можно установить, к каким веществам они чувствительны, и точно подобрать лекарство или создать новый эффективный препарат для лечения.
К примеру, размер генома паразитической бактерии микоплазмы (Mycoplasma genitalium ) – 580000 пар нуклеотидов. 90% ее генома кодирует белки, 10% содержат регуляторные последовательности белков, т.е. белки не кодирует. У нее 468 генов (это можно с точностью определить по нуклеотидной последовательности генома).
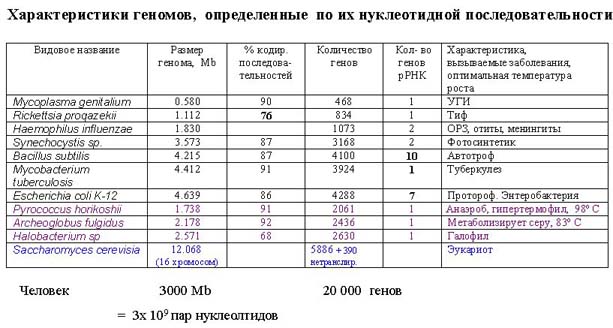
Что означают различия в количестве кластеров рибосомной РНК? Кишечная палочка делится раз в двадцать минут, туберкулезная микобактерия делится раз в сутки. Кстати, это представляет трудности в диагностики туберкулеза (для того, чтобы выделить из мокроты больного эту бактерию, необходимо ее выращивать неделями, чтобы там что-то можно было проанализировать). Из-за того, что она так медленно растет, ей не нужно активно синтезировать рибосомы, поэтому у нее меньше генов, нужных для синтеза рибосом (в 10 раз меньше, чем у свободно живущей и активно растущей Bacillius subtilis ).
Процент кодирующих последовательностей самый высокий у микоплазмы Mycoplasma genitalium . Она живет в постоянных условиях внутри клетки, ей мало что нужно регулировать. У других бактерий большую долю занимают кодирующие белки, а у человека, по сравнению с бактериями, кодирующие белки занимают намного меньшую часть генома (2%). В принципе, это соответствует развитию общества: все меньшую часть занимает производство, и все большую часть занимает сервис и информационные технологии.
Ориентация генов (направление транскрипции)
Когда ДНК реплицируется, одна нить синтезируется непрерывно (ведущая нить), а на второй нити синтезируется фрагменты Оказаки, которые потом сшиваются (запаздывающая нить). Направление транскрипции большинства генов совпадает с направлением синтеза ведущей нити. Репликация ДНК начинается с точки ori, и идет в обе стороны. И соответственно, гены расположены преимущественно в том же направлении, в котором идет репликация. Поэтому при репликации транскрипция не прерывается надолго.
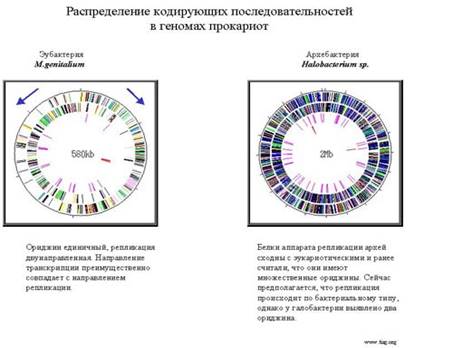
Ниже приведено количество генов по функциям в геноме кишечной палочки.
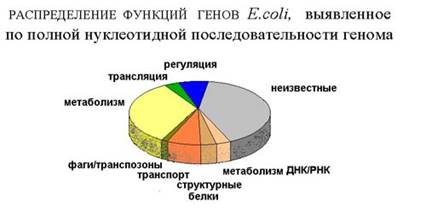
Гомологичные гены и копийность генов
В геноме бактерий могут присутствовать гены, похожие по нуклеотидной последовательности. Такие гены называются гомологичными (гомо - одинаковый). Гомологичные гены могут появиться в геноме в результате удвоения (дупликации) одного гена. В этом случае их называют паралоги. При наличии в геноме нескольких гомологичных генов они могут приобрести разные функции. Если же два вида бактерий, имевших общего предка, разошлись, и у них сохранились гены, похожие по последовательности и часто совпадающие по функциям, то эти гены называются ортологами. Если ген попал в организм при горизонтальном переносе из другого организма в другой, то он называется ксенологом (ксено - чужой).
Некоторые гены, сходные по строению, но немного отличающиеся по функциям, имеют большую копийность в геноме. Ниже представлено количество копий разных генов в геноме свободноживущей бактерии Bacillus subtilis . Копийность генов связана с образом жизни бактерий. Это можно сравнить, к примеру, с языком. Так, у народов, занимающихся скотоводством, лошадь имеет множество названий (не как у нас: лошадь, жеребенок, мерин, а множество названий для лошадей разного назначения и разного возраста); у эскимосов много слов, обозначающих снег. Также, в геноме бактерий многокопийны те гены, которые важны для жизни бактерий. Говорят, это те гены, которые обуславливают экологическую специфичность.
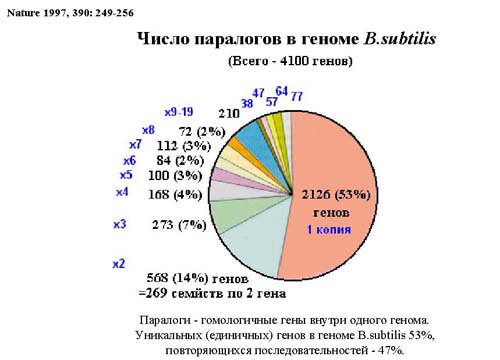
Изменение функции гена в процессе эволюции
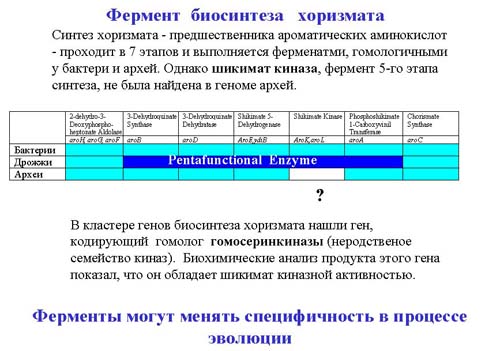
Гены, отвечающие за соседние реакции в метаболической цепи, часто расположены рядом на хромосоме. Например, на рисунке изображены 7 генов, отвечающих за синтез вещества хоризмата. Реакция проходит в 7 этапов. И эти 7 генов кодируют 7 ферментов, проводящие реакцию. В геноме гены расположены в том же порядке, в котором потом работают кодируемые ими ферменты. С этих генов считывается одна мРНК, на которой проходит трансляция. Синтезированные ферменты оказываются в цитоплазме клетки рядом друг с другом и передают субстрат один другому, последовательно проводя реакции.
У дрожжей нашли белок, который объединяет 5 функций. Он состоит из пяти глобул, связанных полипептидной связью, которые выполняют те же функции, что и отдельные белки в других организмах. Это пример того, что белки могут выполнять те же функции, независимо от того, объединены они в одну полипептидную цепь или нет.
Интересным примером являются археи. У них есть белки с аналогичными функциями. Когда посмотрели геном архей, оказалось, что 6 генов у них такие же, то есть эти 6 генов являются ортологами уже известных генов бактерий. Однако один ген здесь стоит совершенно другой, не ортологичный бактериальному, а родственый генам совершенно другого фермента. При биохимической проверке функции этого неортологичного гена оказалось, что она совпадает с функциями того гена, который должен находиться на этом месте.
И хотя новый ген полностью отличается по нуклеотидной последовательности от стоящих рядом, но выполняет он те же функции, что и стоящий на этом месте у бактерий белок. Это явление назвали неортологичеким замещением.
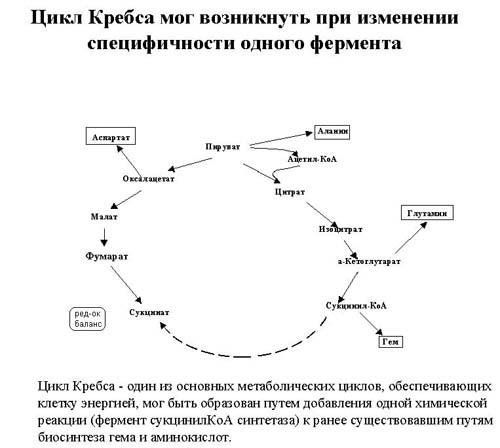
Мы говорили, что цикл Кребса мог возникнуть при замыкании двух реакций при добавлении всего одного фермента, и такие вот примеры показывают, что такой фермент мог быть рекрутирован из фермента с близкой ферментативной активностью.
Каким образом, геномы бактерий меняются в процессе эволюции? Все изменения можно классифицировать на пять групп: точечные замены (замены одной «буквы» на другую), дупликации и амплификации (копирование участков генома), делеции (выпадение участков генома), инверсии и транслокации (перестановка участка гена в другую часть генома или изменение его ориентации в геноме), горизонтальный перенос генов (фрагмент ДНК переносится из одной бактерии в другую).

Исследования генома человека
Как наука генетика возникла на рубеже XIX и XX веков. Многие официальной датой ее рождения считают 1900 год, когда Корренс, Чермак и де Фриз независимо друг от друга обнаружили определенные закономерности в передаче наследственных признаков. Открытие законов наследственности состоялось, по существу, вторично - еще в 1865 году чешский ученый-естествоиспытатель Грегор Мендель получил те же результаты, экспериментируя с садовым горохом. После 1900 года открытия в области генетики следовали одно за другим, исследования, посвященные строению клетки, функциям белков, строению нуклеиновых кислот, открытых Мишером в 1869 году, шаг за шагом приближали человека к разгадке тайн природы, создавались новые научные направления, совершенствовались новые методы. И, наконец, в конце XX века генетика вплотную подошла к решению одного из фундаментальных вопросов биологической науки - вопроса о полной расшифровке наследственной информации о человеке.
В реализации грандиозного проекта по расшифровке генетического кода ДНК, получившего название HUGO (Human Genome Organization) приняли участие 220 ученых из разных стран, в том числе и пять советских биологов. В нашей стране была создана собственная программа «Геном человека», руководителем которой стал академик Александр Александрович Баев.
Впервые идея организации подобной программы была выдвинута в 1986 году. Тогда идея показалась неприемлемой: геном человека, то есть совокупность всех его генов содержит около трех миллиардов нуклеотидов, а в конце 80-х годов затраты на определение одного нуклеотида составляли около 5 долларов США. Кроме того технологии 80-х позволяли одному человеку определять не более 100 000 нуклеотидов в год. Тем не менее, уже в 1988 году Конгресс США одобрил создание американского проекта исследований в этой области, руководитель программы Дж. Уотсон так определил ее перспективы: «Я вижу исключительную возможность для улучшения человечества в ближайшем будущем». Осуществление российской программы началось в 1989 году.
Сейчас определение одного нуклеотида обходится всего в один доллар, созданы аппараты, способные секвенировать (от лат. sequi - следовать) до 35 млн. последовательностей нуклеотидов в год. Одним из важных достижений стало открытие так называемой полимеразной цепной реакции, позволяющей из микроскопических количеств ДНК за несколько часов получить объем ДНК, достаточный для генетического анализа. По оценкам специалистов существует возможность завершения проекта через 15 лет, и уже сейчас программа приносит полезные результаты. Суть работ заключается в следующем: сначала проводится картирование генома (определение положения гена в хромосоме), локализация некоторых генов, а после этого секвенирование (определение точной последовательности нуклеотидов в молекуле ДНК). Первым геном, который удалось локализовать, стал ген дальтонизма, картированный в половой хромосоме в 1911 году. К 1990 году число идентифицированных генов достигло 5000, из них картированных 1825, секвенированных - 460. Удалось локализовать гены, связанные с тяжелейшими наследственными болезнями, такими, как хорея Гентингтона, болезнь Альцгеймера, мышечная дистрофия Дюшена, кистозный фиброз и др.
Таким образом, проект исследования генома человека имеет колоссальное значение для изучения молекулярных основ наследственных болезней, их диагностики, профилактики и лечения. Следует обратить внимание на то, что за последние десятилетия в индустриально развитых странах доля наследственных болезней в общем объеме заболеваний значительно увеличилась. Именно наследственностью обусловлена предрасположенность к раковым и сердечно-сосудистым заболеваниям. В значительной степени это связано с экологической ситуацией, с загрязнением окружающей среды, так как многие отходы промышленности и сельского хозяйства являются мутагенами, то есть изменяют человеческий генофонд. Учитывая современный уровень развития генетики можно предположить, что научные открытия будущего позволят путем изменения генома адаптировать человека к неблагоприятным условиям внешней среды. Что же касается борьбы с наследственными заболеваниями, то их лечение путем замены больных генов на здоровые кажется реальным уже сейчас. Все это означает, что человек получит возможность не только изменять живые организмы, но и конструировать новые формы жизни. В связи с этим возникает целый ряд серьезных вопросов.
На мой взгляд одним из наиболее важных вопросов является вопрос об использовании генетической информации в коммерческих целях. Несмотря на то, что и участники проекта HUGO, и представители международных организаций, в частности ЮНЕСКО, единодушны в том, что любые результаты исследований по картированию и секвенированию генома должны быть доступны всем странам и не могут служить источником прибыли, частный капитал начинает играть все большую роль в генетических исследованиях. Когда появилась программа HUGO, возникли так называемые геномные компании, которые занялись самостоятельно занялись расшифровкой генома. В качестве примера можно привести американскую организацию под названием Institute of Genomic Research (TIGR) или компанию Human Genome Sciences Inc. (HGS). Между крупными фирмами идет ожесточенная борьба за патенты. Так в октябре 1994 Крэк Вентер, глава вышеупомянутой компании TIGR, о том, что в распоряжении его корпорации находится библиотека из 35000 фрагментов ДНК, синтезированных с помощью РНК на генах, полученных лабораторным путем. Эти фрагменты сравнили с 32 известными генами наследственных заболеваний. Оказалось, что 8 из них полностью идентичны, а 19 гомологичны. TIGR оказался обладателем ценнейшей научной информации, но его руководители заявили, что химическое строение всех последовательностей из этой библиотеки засекречено и будет сделано достоянием гласности только в том случае, если за компанией будет признано право собственности на все 35000 фрагментов. Это не единственный случай, а между тем, развитие генетики намного опережает развитие соответствующей законодательной базы. Хотя шаги в этом направлении предпринимаются (в России, например, в конце 1996 года был принят закон "О государственном регулировании в области генно-инженерной деятельности", в1995 был принят закон о биоэтике во Франции, в США Акт о гражданских правах запрещает дискриминацию при найме на работу по расовым, половым, религиозным и национальным признакам, при этом ген серповидноклеточной анемии, в частности у негров, может считаться расовым признаком, другой закон запрещает дискриминацию при найме на работу лиц с пониженной трудоспособностью, а таковыми могут считаться и лица с отягощенной наследственностью, большое значение имеет так называемый принцип Тарасовой, обязывающий врачей нарушать конфиденциальность врачебных сведений с целью предотвращения возможного вреда обществу), международных актов, регулирующих все стороны деятельности, связанной с генетикой, пока не существует.
Эволюция человеческого вида не ограничена прошлым. Механизмы, которые вызывают изменения в частоте генов от поколения к поколению, продолжают работать и в настоящее время. С течением времени биологическая эволюция все в большей и большей степени дополняется культурной эволюцией, которая становится одной из главных сил, вызывающей биологические изменения внутри человеческого вида. Знание этих механизмов должно помочь в определении тенденции развития генетической структуры человеческих популяций в будущем. В большинстве стран за последние несколько поколений условия жизни населения сильно изменились и продолжают меняться в нарастающем темпе. Благодаря успехам гигиены и медицины значительно улучшилось здоровье человека, и возросла продолжительность его жизни. Эти обстоятельства сказываются на репродуктивности и смертности и, следовательно, влияют на генетической структуре будущих поколений.
Прогресс науки и техники подвергает современных людей существенно большим рискам неблагоприятной изменчивости, чем это было на протяжении всего предшествующего периода развития человеческой цивилизации. Физические, химические и, возможно, биологические (вирусные) мутагены могут нести серьезную угрозу для генетической структуры популяции в будущем. Поэтому одной из актуальнейших задач современного естествознания является изучение процессов генетической изменчивости человека и разработка системы мер для предотвращения неблагоприятных тенденций эволюции. В указанном аспекте важное значение имеет развитие генетики человека, особенно в области генетического консультирования и скрининга наследственных аномалий, что может сохранить приемлемый уровень здоровья будущих поколений.
Мутация – это всеобщее свойство живых организмов, лежащее в основе эволюции и селекции всех форм жизни и заключающееся во внезапно возникающем изменении генетической информации. Когда мутация происходит в отдельном гене, то говорят о генных или точковых мутациях. При изменении структуры хромосом или их числа, речь идет о хромосомных мутациях. Все генетическое разнообразие людей так или иначе является следствием мутаций.
С достаточной уверенностью можно утверждать, что многие мутации генов и практически все аберрации хромосом неблагоприятны как для индивида, так и для популяции; большинство хромосомных аберраций губит зиготу в период эмбрионального развития, меньшая часть таких зигот доживает до рождения и продолжает существовать дальше, но пораженные пациенты страдают тяжелыми врожденными пороками. Генные мутации часто ведут к врожденным заболеваниям с простым типом наследования или к дефектам в мультифакториальных генетических системах. Очень большая часть генных мутаций ведет к изменениям аминокислотной последовательности белков и не вызывает явной функциональной недостаточности, примером чему служат варианты гемоглобина. Доля благоприятных мутаций, в лучшем случае, очень незначительна.
Частоты численных аберраций хромосом увеличивается с возрастом матери, поэтому любой сдвиг в материнском возрасте приведет к соответствующему изменению в общей распространенности таких хромосомных мутаций. Во многих современных популяциях существует тенденция к уменьшению числа детей в семье и концентрация деторождения в возрастной группе с наименьшим риском (женщины в возрасте от 20 до 30 лет). Было подсчитано, что в западных странах и в Японии эта тенденция должна была уменьшить число детей с синдромом Дауна на 25...40%. Однако ряд последних исследований показывает, что склонность многих современных женщин откладывать рождение ребенка на несколько более поздний возраст легко может привести к изменению этой тенденции на противоположную. Известно, что самое эффективное средство обнаружения аномалий хромосом – это пренатальная диагностика. Во многих странах эту диагностическую процедуру предлагают проводить всем женщинам старше 35 лет. Если бы все пожилые беременные женщины действительно через нее проходили, частота синдрома Дауна безусловно бы снизилась. Можно предположить, что с увеличением безопасности пренатальной диагностики для матери и ребенка, амниоцентез станет обычным для большинства беременностей в развитых странах. В таких условиях можно будет почти полностью избежать аномалий, обусловленных численными или структурными аберрациями хромосом. Для многих генов частота мутаций увеличивается с возрастом отца, поэтому любой
8-09-2015, 19:54
