В посівних ферментерах міцелій вирощують 12 – 18 год, 12 – 15 % об’єму культуральної рідини використовують для початку основної ферментації. Поживне середовище для вирощування міцелію і біосинтезу пеніциліну готують зазвичай із кукурудзяного екстракту, лактози, глюкози, мінеральних речовин і декількох препаратів фенілоцтової кислоти – попередників антибіотиків [4].
Синтез того чи іншого пеніциліну залежить від наявності специфічної речовини в середовищі, інакше кажучи, попередника, якого мікроорганізм включає в молекулу антибіотика без попереднього розщеплення. Варто відзначити, що попередники біосинтезу пеніциліну (фенілоцтова кислота, фенілацетамід, феноксиоцтова кислота) за визначених концентрацій та значень рН середовища проявляють токсичну дію на продуцента. Фенілоцтова кислота найменш токсична. Додавання її в середовище в концентрації більше 500 мкг/мл пригнічує ріст міцелію, особливо в перші 24 год його розвитку. Фенілоцтова кислота додається в концентрації від 100 до 500мкг/мл через 24 год розвитку продуцента. За таких умов забезпечується найбільший вихід бензилпеніциліну, концентрацію якого через 72 год розвитку може досягнути 500 – 1000 мкг/мл.
Під час розвитку гриба без внесення попередника утворюється близько 45 % бензилпеніциліну (пеніцилін G) і близько 53 % пеніциліну К (радикал п-гептилпеніцилін). У разі додавання в поживне середовище фенілоцтової кислоти змінюється співвідношення утворюваних компонентів в бік різкого збільшення бензилпеніциліну, кількість якого залежно від віку досягає 75 – 95 % від суміші пеніцилінів. В процесі культивування Penicillium chrisogenum в середовищі, що не містить фенілоцтової кислоти, в ньому накопичуються сірковмісні сполуки не β-лактамної природи, наближені до цистеїну та метіоніну. Додавання в середовище фенілоцтової кислоти сприяє більш швидкому метаболізму сірковмісних компонентів та сполуки β-лактамної природи [1].
Склад деяких поживних середовищ, що використовуються у промисловості для основної ферментації пеніциліну, наведено у таблиці 1 [4].
Таблиця 1. Склад ферментаційних середовищ (в %) для отримання пеніциліну
| Компонент | Середовище | ||
| Кукурудзяне | Вичавкове | Жирове | |
Кукурудзяний екстракт Горіхові, соняшникові, соєві вичавки Лактоза Глюкоза або гідрол Кашалотовий жир або рослинні олії Нітрат амонію Сульфат натрію Дигідрофосфат калію Сульфат магнію Тіосульфат натрію Карбонат кальцію (крейда) Попередники бензилпеніциліну |
2,0 – 3,0 – 5,0 1,5 0,5 – 0,1 0,4 0,05 0,4 0,025 0,2 0,5 – 0,1 0,3 – 0,4 |
– 2,0 – 4,0 5,0 1,5 0,5 – 0,1 0,4 0,05 0,4 0,025 0,2 0,5 – 0,1 0,3 – 0,4 |
2,0 – 3,0 – 1,0 1,5 2,5 – 3,5 0,4 0,05 0,4 0,025 0,2 0,5 – 0,1 0,3 – 0,4 |
3.5 Стерилізація поживного середовища
Для кожного продуцента антибіотика розробляється оптимальне живильне середовище. Середовище повинне відповідати певним вимогам:
а) забезпечувати максимальний вихід антибіотика;
б) складатися з відносно дешевих компонентів;
в) мати гарну фільтруючу здатність;
г) забезпечувати застосування найбільш економічних прийомів виділення й очищення антибіотиків.
Стерилізація поживних середовищ у промислових умовах здійснюється двома методами: періодичним і безперервним.
Періодичний метод стерилізації застосовується у разі використання невеликих об'ємів середовища й полягає в тому, що середовище нагрівається до температури 120 – 130 °С безпосередньо у ферментерах або в спеціальних казанах-стерилізаторах, витримується при цій температурі протягом 30 – 60 хвилин (залежно від об'єму середовища і його складу), після чого охолоджується до 27 – 30 °С.
За час, затрачуваний на нагрівання середовища до температури, необхідної для стерилізації, і її охолодження, знищується значне число мікроорганізмів. Ефект стерилізації й збереження термолабільних речовин досягаються в тому випадку, якщо стерилізацію проводять за більш високої температури і за коротший проміжок час. Безперервний метод стерилізації доцільно застосовувати при використанні більших об'ємів середовища. Приготовлене середовище зі спеціальної посудини за допомогою насоса подається в стерилізаційну колону, через яку пропускають гостру пару (тиск пари близько 505 Па). Пару подають зверху по внутрішній трубі, що має щілиноподібні прорізи, завдяки чому він надходить у середовище, швидко її нагріваючи. Середовище в колону подається знизу й рухається по спіралі навколо внутрішньої труби.
Середовище, нагріте в колоні до необхідної для стерилізації температури (~130 °С), надходить у спеціальний апарат, де воно витримується певний час при температурі 125 – 130 °С. Час витримки залежить від складу середовища й триває 5 – 10 хвилин. Звідси стерильне середовище надходить у змієвиковий холодильник, охолоджується до 30 – 35 °С (на виході) і надходить у ферментер.
Безперервний метод стерилізації має ряд переваг: можливість автоматичного регулювання процесу, швидке й рівномірне нагрівання середовища, забезпечення більш повної стерильності середовища й ін.
У процесі підготовки поживного середовища для отримання бензилпеніциліну приготовлене середовище піддають стерилізації. Процес ведуть у колонах безперервної дії. Далі середовище надходить у витримувач, де охолоджується протягом певного часу до температури 23 – 25 °С [2].
3.6 Особливості перебігу процесу ферментації
У сучасних умовах найбільш перспективним методом вирощування мікроорганізмів-продуцентів антибіотиків визнаний метод глибинного культивування. Метод полягає в тому, що мікроорганізми розвиваються в товщі рідкого поживного середовища, через яке безупинно подається стерильне повітря, і за постійного перемішування.
Існує чотири основні модифікації глибинного способу вирощування мікроорганізмів:
1. Періодичне культивування. У цьому способі весь процес розвитку мікроорганізмів повністю завершується в одному ферментері, після чого ферментер звільняється від культуральної рідини, ретельно промивається, стерилізується й знову заповнюється свіжим поживним середовищем. Середовище засівається продуцентом, і процес відновляється.
2. Метод відбору. Культивування мікроорганізмів здійснюється у ферментерах з періодичним відбором частини об'єму культуральної рідини і доведенням свіжим поживним середовищем до попереднього рівня.
3. Батарейний спосіб. Мікроорганізми розвиваються в ряду послідовно з'єднаних ферментерів. Культуральна рідина на певній стадії розвитку мікроорганізму перекачується з першого ферментера в другий, потім із другого в третій і т.д. Звільнений ферментер відразу заповнюється свіжим поживним середовищем, засіяним продуцентом. У цьому способі вирощування мікроорганізмів місткості використовуються більш раціонально.
4. Безперервне культивування. В основі методу лежить принцип безперервного потоку поживного середовища, що дозволяє підтримувати розвиток мікроорганізму на певній стадії його росту. Стадія розвитку мікроорганізму визначається тим, що в цей період відбувається максимальний біосинтез антибіотика або іншої біологічно активної сполуки. Встановлено, що в умовах безперервного процесу біосинтезу деяких антибіотиків можна одержати чудові результати, якщо процес вести у дві стадії. У першому апараті батареї підтримують високу швидкість потоку, що забезпечує більшу швидкість росту продуцента антибіотика, для того, щоб одержати високоактивну біомасу, а в другому апараті – забезпечують низьку швидкість потоку й відповідно невелику швидкість росту. Процес безперервного культивування – перспективний напрямок сучасної біотехнології.
Розвиток мікроорганізму у ферментерах проходить за суворого контролю всіх його стадій і точного виконанням регламенту умов розвитку. Велику увагу приділяють підтримці заданої температури культивування, активної кислотності середовища (рН), ступеня аерації й швидкості роботи мішалки. У процесі розвитку організму здійснюють біологічний контроль, враховують споживання організмом основних компонентів субстрату (джерела вуглецю, азоту, фосфору), уважно стежать за утворенням антибіотика. Проводити біологічний контроль на досить високому рівні дозволяє використання сучасного комп’ютерного забезпечення та автоматизованих систем управління.
Велике значення для утворення пеніциліну має аерація культури. Максимальне накопичення пеніциліну відбувається за інтенсивності аерації, що дорівнює 1 од. об’єму повітря за 1 хв. на 1 од. об’єму середовища. Зменшення інтенсивності аерації або надмірне збільшення призводять до зниження біосинтезу пеніциліну. Важливу роль при цьому відіграє перемішування культури. Так, із збільшенням потужності, що витрачається на обертання мішалки у ферментері об’ємом 7500 л, швидкість споживання лактози збільшується і біосинтез антибіотика зростає (рис. 4). Від способу перемішування культуральної рідини залежить форма і величина глибинних колоній, стан яких визначає міру здатності міцелію до синтезу пеніциліну [6].
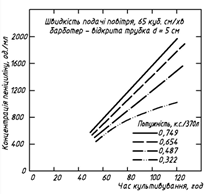
Рис. 4. Графік залежності накопичення пеніциліну від інтенсивності перемішування.
Велику увага в процесі розвитку продуцента у ферментерах звертають на процес піногасіння. Під час продування повітря через культуру мікроорганізму утворюється піна, яка суттєво порушує процес розвитку продуцента антибіотика у ферментері. Поява великої кількості піни обумовлена білковими речовинами, що знаходяться у середовищі, і її високою в'язкістю, що пов'язано з інтенсивним накопиченням біомаси.
Для боротьби з піною у ферментерах використовують поверхнево активні речовини: рослинні олії (соєву, соняшникову), тваринний жир (лярд, китовий жир), а іноді мінеральні олії (вазелінову, парафінову), спирти й вищі жирні кислоти. Нерідко в якості піногасників використовують спеціально синтезовані речовини (силікони, диазобутананкарбаміл та ін.).
Багато речовин (олії, жири, спирти й ін.), використовувані в якості піногасників, споживаються продуцентами антибіотиків як додаткові джерела вуглецевого живлення. При цьому часто спостерігається підвищення виходу антибіотика. Однак внесення піногасника може знижувати швидкість розчинення кисню, що, у свою чергу, негативно позначається на розвитку мікроорганізму і його біосинтетичну активність.
Іноді використовуються механічні способи піногасіння (відсмоктування піни через спеціальні труби, руйнування пухирців піни сильними струменями рідини, пари або газу).
Загальна схема виробництва антибіотиків до стадії виділення й хімічного очищення представлена на рис. 5.
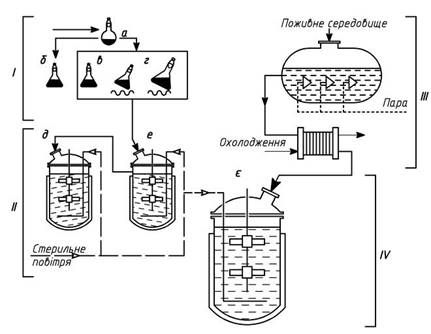
Рис. 5. Схема виробництва антибіотиків: I – приготування посівного матеріалу; II – інокулятори для нарощування посівного матеріалу; III – стерилізатор середовища для великого ферментера; IV – установка для біосинтезу антибіотика; а – стерилізація середовища в колбах; б – охолодження й посів культури продуцента в колбу; в – ріст культури в стані спокою; г – ріст культури в качалці; д – інокулятор зі стерильним середовищем; е – інокулятор із середовищем, засіяним культурою продуцента; є – ферментер;
Перша стадія процесу – вирощування стандартної колонії штамів плісняви Penicillium chrysogenum – проводиться в інокуляторах на поживному середовищі де процес іде ~30 годин. Підготовлений інокулят переносять у посівний апарат, об'єм якого ~ в 10 раз більше об'єму інокулятора. У посівному апараті знаходиться також стерилізоване поживне середовище. Процес росту тут іде ~15 – 20 годин, і далі посівний матеріал подається на ферментацію в більші реактори – ферментери об'ємом до 100 м3 . Процес ферментації триває ~70 годин за температури 23 – 24 °С, рН середовища 6 – 6,5 і за інтенсивної аерації (1 од. об’єму повітря за 1 хв на 1 од. об’єму середовища) [2].
Для стабілізації реакції середовища використовують крейду. Коли кількість пеніциліну досягає максимуму ферментацію припиняють. Динаміка утворення міцелію, біосинтезу пеніциліну і споживання лактози із середовища зображено на рис. 6.
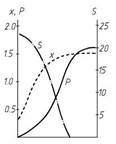
Рис. 6. Динаміка біосинтезу пеніциліну, утворення міцелію і асиміляції лактози: Х – сухий міцелій (мг/100 г), Р – концентрація пеніциліну (1000 од./мл), S – концентрація лактози (мг/мл).
Під час розвитку продуценту пеніцилінів – Penicillium chrisogenum – на кукурудзно-лактозному середовищі виділяють три фази.
Перша фаза – ріст міцелію, вихід антибіотика низький. Завжди присутня в кукурудзяному екстракті молочна кислота споживається продуцентом з максимальною швидкістю, лактоза споживається повільно. Споживання кисню – високе. Посилюється азотний обмін, в результаті чого в середовищі з’являється аміак і різко збільшується значення рН. Температура в період першої фази повинна бути 30 °С, рН в період росту гриба повинен бути нижче 7,0.
Друга фаза – максимальне утворення пеніциліну, це пов’язано із швидким споживанням лактози і амонійного азоту. рН середовища залишається практично без змін, збільшення маси міцелію незначне, споживання кисню знижується. Температура протягом другої фази повинна бути 20 °С,
Третя фаза – зниження концентрації антибіотика в середовищі у зв’язку із початком автолізу міцелію і виділенням в результаті цього процесу аміаку, що супроводжується підвищенням рН середовища.
На сьогоднішній день описано шість умовно виражених вікових фаз продуцента пеніциліну. Помітна кількість пеніциліну починає утворюватися з ІV вікової фази гриба, максимум накопичення припадає на VІ фазу – в період автолізу.
Визначення вікових фаз шляхом мікроскопічного контролю дозволяє встановити:
1. Хід загального темпу розвитку гриба, його стан, контроль за ходом утворення антибіотика.
2. Дефекти розвитку і можливі причини цих дефектів.
3. Момент закінчення розвитку гриба в реакторі.
По мірі розвитку гриба змінюється хімічний склад міцелію. Кількість загального азоту і білку в міцелії зменшується, вміст моноцукрів в період максимального біосинтезу пеніциліну (96 год.) збільшується майже в 6 разів по відношенню до початкового процесу, кількість дисахаридів зменшується. Змінюється кількість окремих амінокислот.
Процес біосинтезу пеніциліну ведеться за найретельнішого дотримання стерильності протягом усіх операцій, оскільки забруднення культури сторонньою мікрофлорою різко знижує накопичення антибіотика. Це пов’язано із тим, що багато бактерій здатні утворювати пеніцилазу.
Механізм біосинтезу пеніциліну зображений на рис. 7.
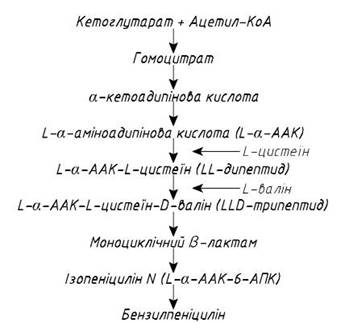
Рис. 7. Біохімія синтезу бензилпеніциліну
Сучасна промислова мікробіологія отримує культуральні рідини, що містять більше 55 тис. од./мл [1].
3.7 Особливості процесу виділення і очистки пеніциліну
Більшість продуцентів у процесі біосинтезу виділяють антибіотик у водну фазу, тому процес виділення антибіотика починається з розділення твердої й рідкої фаз.
Тверда фаза, крім маси міцелію, містить значну кількість колоїдних домішок, що ускладнюють фільтрування, тому культуральну масу попередньо піддають різним типам коагуляції (електролітична, теплова, кислотна і т.д.). Найбільш ефективним методом коагуляції культуральної маси є її обробка флокулянтами (високомолекулярними поліелектролітами), наприклад, полі - (4-вінил) - N-Бензилтриметиламонійхлоридом. Коагульований міцелій відділяють сепарацією або фільтрацією (частіш за все у вакуум-фільтрах циліндричного типу) [2].
Після відділення міцелію в фільтраті міститься 3 – 6 % сухих речовин, із яких 30 – 40 % складають мінеральні речовини, а 15 – 30 % пеніцилін. Вміст редукуючих речовин за Бертраном в нативному розчині зазвичай складає 0,1 – 0,4 %. Крім того, в ньому міститься 50 – 200 мг/100 г, а іноді навіть до 700 мг білку на 100 г розчину, що дуже ускладнює виділення пеніциліну. Білкові домішки видаляють, використовуючи різні методи попередньої обробки, наприклад, осадження солями полівалентних металів (Al, Fe, Zn), коагуляція таніном або високою температурою (60 – 70 °С) за рН середовища 5,5 – 6,0. В цих процесах втрати пеніциліну становлять 5 – 15 %. Після цього пеніцилін екстрагують органічними розчинниками (бутилацетат, амілацетат), які не змішуються із водою. На даному етапі важливо витримати рН середовища в межах 1,9 – 2,0. В результаті екстрагування чистота продукту збільшується в 4 – 6 рази. Потім пеніцилін із бутилацетатного екстракту за допомогою розчину дикарбонату натрію (рН середовища 6,6 – 7,2) розчиняють у воді, отримуючи розчин із 5 – 7 % вмістом сухих речовин і активністю 30000 – 50000 од./мл. Для очищення пеніциліну його знову екстрагують органічним розчинником (бутилацетатом). Під час екстрагування співвідношення фаз 1:0,5 – 1:1, активність екстракту 50000 – 70000 од./мл. Вихід пеніциліну складає приблизно 86 % від його кількості в культуральній рідині [4].
Широко застосовуються сорбційні методи виділення й очищення антибіотиків. У якості сорбентів широко використовуються синтетичні йонообмінні смоли.
Після виділення й хімічного очищення антибіотика його необхідно висушити, тобто вилучити із препарату вільну і зв'язану воду.
Оскільки більшість антибіотиків тією чи іншою мірою термолабільні, для їхнього висушування застосовують методи, що не приводять до втрати біологічної активності та хімічної структури препарату. На сучасному етапі промислового одержання антибіотиків використовують наступні методи зневоднювання. Це:
– ліофілізація антибіотиків – широкопоширений метод, проводиться за порівняно низьких температурах (-8 – -12 °С).
– висушування із застосуванням розпилювальної сушарки – прогресивний метод при роботі з великими кількостями антибіотика. Розчин антибіотика пневматично розпилюється у камері з протитоком нагрітого повітря. Процес висушування антибіотиків триває кілька секунд, при цьому навіть термолабільні препарати не змінюють свої властивості.
– Метод псевдокиплячого шару (або сушіння у вакуум-сушильних шафах) застосовується для висушування зернистих і пастоподібних антибіотичних препаратів.
Розфасовка й пакування антибіотика – завершальний етап роботи. Розфасований і упакований антибіотик із зазначенням показника біологічної активності, дати випуску й терміну придатності надходить у продажу [2].
3.8 Контроль якості отриманого антибіотика
Готовий антибіотик піддається ретельному контролю: біологічному й фармакологічному.
1. Під час біологічного контролю ставиться задача підтвердження стерильності готового препарату. Для цього зазвичай використовують два методи.
Перший пов'язаний з інактивацією антибіотика та висівом його у відповідне поживне середовище Наприклад, біологічний контроль бензилпеніциліну і напівсинтетичних препаратів, отриманих на його основі, проводиться в такий спосіб. У пробірки, що містять тіогліколеве середовище, вносять фермент пеніцилазу в кількості, що здатна повністю інактивовувати пеніцилін. Пробірки з пеніцилазой витримують дві – три доби за температури 37 °С для контролю стерильності ферменту, потім у них вносять розчин пеніциліну. Пробірки розділяють на дві групи: одну витримують за 37 °С, а іншу – за 24 °С протягом п'яти діб. Проводять щоденне спостереження за можливим розвитком мікроорганізму.
Другий метод з'ясування стерильності антибіотиків полягає у тому, що для більшості цих сполук не існує інактиваторів їх біологічної активності. Тому в досліджуваних препаратів виявляють стійкі до них форми мікроорганізмів, а також визначають можливу присутність чутливої мікрофлори. Для визначення можливої присутності в таких препаратах чутливої до них мікрофлори розчин антибіотика пропускають через мембранні фільтри з діаметром пор не більш 0,75 мкм.
2. До антибіотичних речовин, використовуваних у медичній практиці, відповідно до Державної Фармакопії України висуваються дуже суворі вимоги. Кожний новий лікарський препарат, перш ніж
8-09-2015, 20:11
