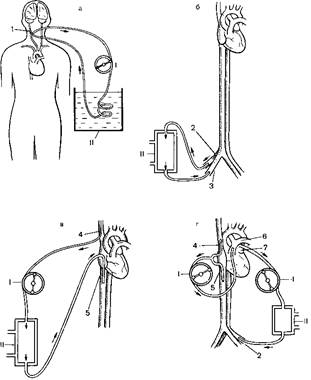
Рис. 3. Схемы экстракорпорального охлаждения крови: артерио-артериального (а), артериовенозного (б), вено-венозного (в), глубокого по методу Дрю (г). I насос, II теплообменник, 1 сонная артерия, 2 бедренная артерия, 3 – большая подкожная вена бедра, 4 верхняя полая вена, 5 нижняя полая вена, 6 легочная артерия, 7 левое предсердие.
Вено-венозное охлаждение
Пионером разработки и клинического применения метода является D. Ross (1954). Верхнюю и нижнюю полые пены канюлируют через ушко правого предсердия. С помощью роликовою насоса кровь из верхней полой вены нагнетается через теплообменник в нижнюю полую вену. (рис 3, в) По сравнению с артериовенозным охлаждением методика имеет дополнительные преимущества в виде возможности контроля минутного объема сердца с помощью роликового насоса и применения гипотермии только после торакотомии и уточнения диагноза. Основными недостатками методики являются возникновение фибрилляции желудочков сердца в связи с быстрым снижением температуры крови, гемолиз, возможность тромбообразования. В рассмотренном варианте в настоящее время метод в клинике не применяется. Общее глубокое охлаждение по Дрю. Методика разработана и внедрена в клиническую практику С. Drew и JAnderson в 1959 г. Канюли вводят в полые вены, легочную артерию, левое предсердие и бедренную артерию (рис. 3, г) Венозная кровь из полых вен поступает в наполнительный сосуд и оттуда насосом перекачивается в легочную артерию. Далее оксигенированная в легких кровь через катетер, введенный в левое предсердие, поступает в другой наполнительный сосуд и оттуда вторым роликовым насосом нагнетается в бедренную артерию. Таким образом, вместо оксигенатора используются легкие больного. Другими особенностями методики являются глубокое охлаждение — до 10—15 °С в пищеводе и полное прекращение кровообращения (до 50—60 мин). По мнению авторов, методика обеспечивает комфорт для хирурга (истинно «сухое» операционное поле). Меньше травмируются форменные элементы крови, меньше требуется донорской крови. Отметим также, что эта методика позволяет оперировать по поводу порока, коррекция которого требует прекращения кровообращения. Недостатков у методики немало: множественная канюляция, трудности, связанные с малым диаметром сосудов у маленьких детей и при таком пороке, как тетрада Фалло, когда наблюдается сужение (вплоть до атрезии) легочной артерии. Серьезным недостатком является отсутствие возможности вскрытия предсердий, так как последние являются коллекторами замкнутой системы. Это существенно осложняет выполнение простых непродолжительных (15—20 мин) операций, когда нет необходимости в глубокой гипотермии и тем более в прекращении кровообращения В 60-х годах, кроме авторов, методику использовали в клинике Т. Shield и F. Lewis (1959), A. Gordon и соавт. (1960). В настоящее время эта методика практически не применяется.
Общая гипотермическая перфузия
Методика получила наибольшее распространение. По сути дела практически все операции на открытом сердце проводятся в условиях умеренной (26—28°С) общей гипотермической перфузии. Канюлируют верхнюю и нижнюю полые вены или правое предсердие, аорту или бедренную артерию (рис 4). На пути артериальной магистрали монтируют теплообменник. Главным преимуществом метода является его управляемость. Больного с помощью теплообменника можно в короткие сроки охладить (согреть) до желаемой температуры, а также поддерживать температурный режим во время ИК. Внедрение методики общей гипотермической перфузии в клиническую практику позволило продлить безопасный период ИК до 3 ч и более благодаря снижению обменных процессов в организме и уменьшению потребления кислорода тканями. Недостатками методики являются необходимость заготовки большого количества (2,5—3 л) донорской крови и гемолиз, прогрессивно нарастающий после 2 ч искусственного кровообращения.
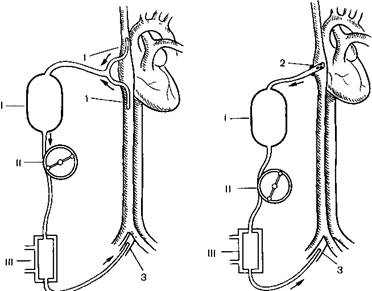
Рис. 4. Схема общей гипотермической перфузии с канюляциеи полых вен (а) и правого предсердия (б) I — оксигенатор II наеое 111 тыообхк нник 1 — почые вены 2 правое предсердие } бедренная артерия
Влияние гипотермии на организм
Для теплокровного организма характерно относительное постоянство температуры. В течение суток она изменяется лишь на + 0,5 град. С. Гипотермия, нарушая это постоянство, вызывает комплекс патофизиологических нарушении в жизненно важных органах и системах. Эти нарушения обусловлены защитно-приспособительными реакциями организма, направленными на восстановление нормальной температуры. Первичной реакцией организма на действие холода является спазм периферических сосудов с целью уменьшения теплоотдачи. По мере охлаждения и возникновения температурного градиента между различными органами и тканями возникает дрожь, которая препятствует дальнейшему падению температуры внутренних органов и способствует повышению температуры поверхностных тканей. Это сопровождается повышением потребления кислорода и усиленным распадом гликогена в мышцах. Первоначальная гипергликемия сменяется гипогликемией и выраженными нарушениями функций жизненно важных органов. Возникает состояние, когда защитные реакции организма переходят грань целесообразности и становятся патологическими [Анохин П.К., 1954).
Из изложенного ясно, что главной задачей анестезиолога при проведении искусственной гипотермии является предупреждение ответных реакций организма на воздействие холода. С этой целью в начале 50-х годов использовали глубокий наркоз и нейроплегию, позднее — тотальную глубокую кураризацию [Дарбинян Т.М., 1958) В настоящее время широко используют комбинированные методы общей анестезии (атаралгезия, нейролептаналгезия) с мышечными релаксантами недеполяризующею действия, которые надежно предупреждают развитие указанных выше реакции организма.
Влияние гипотермии на мозг
Основное назначение гипогермии – снижение температуры и уменьшение потребления кислорода мозгом.
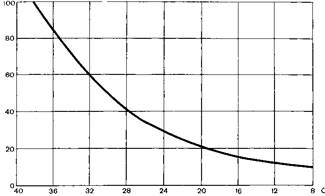
Рис 5 Динамика потребления кислорода организмом при снижении температуры тела. По оси абсцисс – температура в прямой кишке, по оси ординат – общее потребление кислорода.
Согласно данным W. Bigelow и соавт (1950) при снижении температуры тела до 25 °С потребление кислорода мозгом составляет 1 /3 от исходного уровня при 37 С (рис 5). Параллельно уменьшается и мозговой кровоток (на 6-7% при снижении температуры на 1 °С) [RosomoffH. etal., 1954] По мере снижения температуры уменьшаются объем мозга и давление цереброспинальной жидкости. На ЭЭГ влияние холода начинает проявляться с 33—34 С. Уменьшаются частота и амплитуда начинает доминировать дельта и Н ритм. При достижении 14—20 °С биоэлектрическая активность головного мозга начинает исчезать. Сознание утрачивается при температуре 28—30 °С. Влияние гипотермии на сердце проявляется брадикардией и уменьшением коронарного кровотока. По достижении 30 °С возникают различные нарушения ритма сердца а, при температуре ниже 28 C резко возрастает опасность фибрилляции желудочков сердца. При 25 °С частота сердечных сокращений, коронарный кровоток и потребление кислорода сердцем уменьшаются на 50% [Cooper К, 1959] Соответственно снижается и сердечный выброс. На ЭКГ наблюдаются характерные изменения в виде уширения интервала Р — Rи уширения комплекса QRS. Смещение сегмента STвверх свидетельствует об опасности фибрилляции сердца. В условиях гипотермии по мере снижения температуры телa нарушаются функции почек. Так при температуре 25 С клубочковая фильтрация и почечный кровоток уменьшаются на 30% экскреция калия на 63% [Coopei К., 1959]. Нарушается также функция реабсорбции в клубочках с угнетением ферментативных процессов. Действие охлаждения на печень проявляется в ухудшении ее детоксикационных функций. В частности существенно удлиняется период инактивации анестетиков аналгетиков и других лекарственных средств. Гипотермия увеличивает анатомическое и физиологическое мертвые пространства вследствие расширения бронхов. Растворимость углекислого газа в крови повышается, рН артериальной крови падает, развивается дыхательная недостаточность. Однако последнее имеет академический интерес, так как в условиях искусственной гипотермии, как правило, проводится ИВЛ. Вместе с тем следует помнить, что при гипотермии кривая диссоциации оксигемоглобина смещается влево и вверх, связь гемоглобина с кислородом становится более прочной и передача кислорода тканям ухудшается. Это компенсируется за счет увеличения растворимости кислорода в плазме и снижения потребности тканей в кислороде. В вопросе о влиянии гипотермии на железы внутренней секреции нет ясности. Однако установлено, что, если охлаждение проводится без достаточной блокады терморегуляции, то наблюдается их активация. В условиях гипотермии возникают существенные нарушения со стороны крови: удлиняется время свертывания, уменьшается количество тромбоцитов, эозинофилов, лейкоцитов, снижается уровень фибриногена, повышается вязкость крови. Указанные нарушения возникают вследствие активизации антикоагулянтных субстанций, депонирования тромбоцитов в паренхиматозных органах и т д.
Таким образом, гипотермия является патофизиологическим состоянием для теплокровного организма. Однако два превосходных свойства метода — снижение потребления кислорода в организме и повышение устойчивости последнего к кислородному голоданию — сделали его одним из эффективных специальных методов современной анестезиологии и реаниматологии.
Литература
1. Белоярцев Ф.Ф. Фторуглеродные газопереносящие среды. Пущино, 1984.
2. Локшин Л.С., Осипов В.П., Князева Г. Д. Механическая поддержка ослабленного сердца в ближайшем постперфузионном периоде у кардиохирургических больных // Анест. и реаниматол.—1985.—№ 1
3. Мешалкин Е.Н. Гипотермическая защита в кардиохирургии: Сб. науч. трудов. - Новосибирск: Наука, 1980.
4. Михайлов Ю.М., Лепилин М.Г., Бондаренко А.В. и др. Использование внутриаортальной баллонной контрапульсации при лечении острой сердечной недостаточности у кардиохирургических больных // Кардиология.— 1982.— № 10
5. Bardet J., Marquet С., Kahn J.С. Clinical and hemodynamic results of intraaortic balloon conterpulsation and surgery for cardiogenic shock//Amer. Heart J.— 1977.— Vol. 93
6. Birnbaum D., Thorn R., Bucherl E.S. Choice of the most suitable oxygenator for long-term pulmonary support//World J. Surg.— 1979.—Vol. 3
7. Cosgrovz D.M., Loop F.D. Clinical use of Travenol TMO membrane oxygenator //Techniques in extracorporeal circulation / Ed M. Jonescu.— London, 1981
8. Circulation.— 1982. - Vol. 46.
9. Edmund L.H. Pulseless Cardiopulmonary bypass//J. thorac. cardiovasc. Surg. 1982. Vol. 84
10. Gaykowsky R., Olsen D.В., Blalock R.C. Bridging cardiac transplantation with the total artificial heart // Trans. Amer. Soc. Artif. Organs. 1986. Vol. 39
11. Koning H., Koning A., Degauw J. Optimal perfusion during extracorporeal circulation // Scand. J. thorac. cardiovasc. Surg
8-09-2015, 22:10
