Прикрепление лейкоцитов к сосудистой стенке объясняется тем, что ее внутренняя оболочка при воспалении покрывается хлопьевидным слоем, в состав которого входит фибрин, гликозаминогликаны, гликопротеиды, сиаловые кислоты и др. На электрограммах этот слой имеет вид бахромы.
Эмиграция . Выход лейкоцитов из просвета сосудов через сосудистую стенку в окружающую ткань. Этот процесс совершается и в норме, но при воспалении приобретает гораздо большие масштабы. Смысл эмиграции состоит в том, чтобы в очаге воспаления скопилось достаточное число клеток, играющих роль в развитии воспаления (фагоцитоз и т.д.).
В настоящее время механизм эмиграции изучен довольно хорошо. С помощью микроскопа на живом объекте установлено, что лейкоцит пропускает между двумя эндотелиальными клетками свои псевдоподии, а затем и все тело. На электроннограммах видно, что лейкоциты выходят за пределы сосуда на стыке между эндотелиальными клетками. Это объясняется округлением эндотелиоцитов и увеличением интервалов между ними. После выхода лейкоцитов контакты восстанавливаются. Некоторые авторы допускают, что есть и второй путь эмиграции лейкоцитов — трансцеллюлярный, т. е. через цитоплазму эндотелиальных клеток. Однако в последнее время существование этого пути, по крайней мере, в норме, подвергается сомнению. После прохождения через слой эндотелия, лейкоциту предстоит преодолеть еще одно и, по-видимому, более значительное препятствие, а именно базальную мембрану. Она имеет толщину 40 — 60 нм и состоит из коллагеновых волокон и гомогенного вещества, богатого гликозаминогликанами. При прохождении через базальную мембрану полиморфно-ядерный лейкоцит атакует ее своими ферментами (эластаза, коллагеназа, гиалуронидаза). Они влияют на молекулярную структуру базальной мембраны, увеличивая ее проницаемость. Кроме ферментов, в этом случае определенную роль играют и содержащиеся в нейрофильных гранулоцитах катионные белки. Они действуют на коллоидное вещество мембраны, временно переводя его из геля в золь, увеличивая тем самым его проницаемость для клетки.
В эмиграции лейкоцитов в очаг воспаления наблюдается определенная очередность: сначала эмигрируют нейтрофильные гранулоциты, затем — моноциты и, наконец, — лимфоциты. Эту последовательность описал И. И. Мечников. Более позднее проникновение моноцитов объясняется их меньшей хемотаксической чувствительностью. После завершения воспалительного процесса в очаге наблюдается постепенное исчезновение клеток крови, начиная с тех лейкоцитов, которые появились раньше (нейтрофильные гранулоциты). Позже элиминируются лимфоциты и моноциты.
Клеточный состав экссудата в значительной степени зависит от этиологического фактора воспаления. Так, если воспаление вызвано гноеродными микробами (стафилококки, стрептококки), то в вышедшей жидкости преобладают нейтрофильные гранулоциты, если оно протекает на иммунной основе (аллергия) или вызвано паразитами (гельминты), то наблюдается множество эозинофильных гранулоцитов. При хроническом воспалении (туберкулез, сифилис) в экссудате содержится большое число мононуклеаров (лимфоциты, моноциты).
В очаге воспаления осуществляется активное движение лейкоцитов к химическим раздражителям, которыми могут быть продукты протеолиза тканей. Это явление описал И. И. Мечников и назвал его хемотаксис. Хемотаксис имеет значение на всех этапах эмиграции лейкоцитов, особенно во время движения в экстравазальном пространстве и в ткани, в которой отсутствуют сосуды (роговица). Если воспаление вызвано инфекционным агентом, то для хемотаксиса большое значение имеют продукты жизнедеятельности микроорганизмов, а также вещества, образующиеся в результате взаимодействия антигена и антитела.
В хемотаксисе лейкоцитов большое значение имеет система комплемента. Это, прежде всего компоненты комплемента СЗ и С5. Лейкотаксически активные компоненты комплемента СЗ и С5 могут образовываться под влиянием различных ферментов: трипсина, тромбина, плазмина.
Процесс эмиграции может не только стимулироваться, но и подавляться. Ингибиторы хемотаксиса вырабатываются активированными антигеном лимфоцитами. Понятно, что подвижность лейкоцитов будет уменьшаться, если на них подействовать такими ингибиторами обмена, как колхицин, пуромицин, актиномицин D, алкоголь.
В механизме движения лейкоцитов играют роль некоторые физико-химические факторы, например понижение поверхностного натяжения и выпячивание цитоплазмы в сторону раздражителя. Положительно заряженные макромолекулы могут уменьшать отрицательный заряд лейкоцитов и вызывать электростатическую неустойчивость их мембран. Это может привести к движению макромолекул (по типу укорочения — удлинение) как в цитолемме, так и в цитоплазме.
Фагоцитоз . В очаге воспаления главная функция лейкоцитов заключается в том, чтобы поглощать и переваривать инородные частицы (фагоцитоз). У одноклеточных организмов фагоцитоз служит для пищеварения, у высокоорганизованных эту функцию сохранили только некоторые клетки и она приобрела защитный характер. Все фагоцитирующие клетки И. И. Мечников разделил на микро- и макрофаги. Первые (полиморфно-ядерные лейкоциты) фагоцитируют микроорганизмы, вторые (моноциты, гистиоциты) поглощают и более крупные частицы, в том числе клетки и их обломки.
Различают четыре стадии фагоцитоза: приближение (хемотаксис), прилипание , поглощение , переваривание . Первая стадия (хемотаксис) была рассмотрена выше. Вторая стадия фагоцитоза — прилипание объясняется способностью фагоцитов образовывать тонкие цитоплазматические выпячивания, которые выбрасываются по направлению к объекту фагоцитоза и с помощью которых осуществляется прилипание. Определенное значение при этом имеет поверхностный заряд лейкоцитов. Лейкоциты с отрицательным зарядом лучше прилипают к объекту с положительным зарядом. Этому способствует модификация поверхности микроорганизмов, например, при фиксации на их поверхности антител (эффект опсонизации). Описано специальное вещество, которое стимулирует фагоцитоз. Это тафтсин (тетрапептид), который синтезируется в селезенке и активируется на клеточной мембране.
Третья стадия фагоцитоза — поглощение объекта лейкоцитами может происходить двумя способами:
· контактирующий с объектом участок цитоплазмы втягивается внутрь клетки, а вместе с ним втягивается и объект;
· фагоцит прикасается к объекту своими длинными и тонкими псевдоподиями, а потом всем телом подтягивается в сторону объекта и обволакивает его. И в том, и в другом случае инородная частица окружена цитоплазматической мембраной и вовлечена внутрь клетки. В итоге образуется своеобразный мешочек с инородным телом (фагосома).
Четвертая стадия фагоцитоза — переваривание. Лизосома приближается к фагосоме, их мембраны сливаются, образуя единую вакуоль, в которой находятся поглощенная частица и лизосомальные ферменты (фаголизосома). В фаголизосомах устанавливается оптимальная для действия ферментов реакция (рН около 5,0) И начинается переваривание поглощенного объекта. На рис. 12.7 показан весь "арсенал", которым располагает активный микрофаг и который он пускает в ход на разных этапах фагоцитоза. Следует, однако, сказать, что одни ферменты не могут обеспечить достаточного киллерного действия. Эффективность фагоцитоза возрастает, когда в процесс подключается так называемая кислородная система . Как известно, в норме лейкоциты черпают энергию в основном вследствие гликолиза. При фагоцитозе повышается потребление кислорода, причем столь резкое, что его принято называть "респираторным взрывом " (рис.).
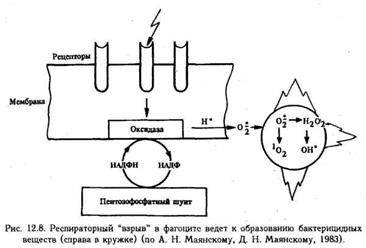
Смысл столь резкого (до 10 раз) повышения потребления кислорода состоит в том, что он используется для борьбы с микроорганизмами. Это происходит следующим образом. Заимствованный из среды, кислород активируется путем частичного восстановления. При этом образуется перекись водорода и так называемые свободные радикалы — супероксидный анион — радикал О2•, синглетный кислород 1О2. Эти высокоактивные соединения вызывают перекисное окисление липидов, белков, нуклеиновых кислот, углеводов и при этом повреждают построенные из этих веществ клеточные структуры микроорганизмов. Особенно легко окисляются ненасыщенные жирные кислоты, входящие в состав клеточных мембран. Кислородный механизм пускается в ход, когда рецептор фагоцита приходит в контакт с объектом фагоцитоза. С этого момента начинается активация ферментов, которые переносят электроны на кислород, заимствуя их у восстанавливаемых молекул. Такими молекулами являются, прежде всего, НАДФН, которые под действием НАДФН-оксидаз окисляются до НАДФ, дефицит же НАДФН восполняется в результате окисления глюкозы в пентозофосфатном шунте. Эффективность действия такого окислителя, как перекись водорода, еще более возрастает, когда оно сочетается с действием миелопероксидазы и одного из галоидов (иона хлора или иода). Взаимодействие Н2О2, миелопероксидазы и хлора приводит к окислению ионов хлора и образованию гипохлорной кислоты, которая разрушает сульфгидрильные группы микробных ферментов, пептидные элементы клеточных мембран. Возможно, что эта реакция приобретает цепной характер, когда при окислении одних веществ образуются другие, сами являющиеся окислителями (например, альдегиды).
Конечно, в этой ситуации фагоцит и сам подвергается агрессивному действию названных веществ, но он обладает мощным механизмом, благодаря которому избыточного накопления активных форм кислорода не происходит. Защитную роль при этом играют, прежде всего, два фермента: глютатионпероксидаза и глютатионредуктаза, роль которых заключается в том, что первый переносит водород на окисленный глютатион, а второй — снимает этот водород и передает его на Н2О2, в результате чего образуются две молекулы воды.
Определенную роль играет каталаза, выводящая из клеток избыток перекиси водорода. Супероксидный анион обезвреживается особым ферментом — супероксиддисмутазой. У фагоцитов имеются и другие, не связанные с кислородом, механизмы борьбы с микроорганизмами. К ним относятся: лизоцим , разрушающий мембраны бактерий; лактоферрин , конкурирующий за ионы железа и, наконец, катионные белки , нарушающие структуру мембран микроорганизмов. Совместное действие механизмов обеих групп приводит к разрушению объекта фагоцитоза. Следует отметить, что фагоциты могут выделять в окружающую среду характерные для них ферментные и неферментные биологически активные вещества и тогда их действие происходит экстрацеллюлярно.
Нарушение обмена веществ в очаге воспаления . Интенсивность обмена веществ при воспалении, особенно в центре очага, повышается. Освобождающиеся из поврежденных лизосом ферменты гидролизуют находящиеся в очаге углеводы, белки, нуклеиновые кислоты, жиры. Продукты гидролиза подвергаются воздействию ферментов гликолиза, активность которых также повышается. Это относится и к ферментам аэробного окисления.
При изучении действия флогогенного агента (кротонового масла) на кожу в эксперименте было установлено, что потребление кислорода при этом повышается на 30 — 35 %. Однако это длится недолго — на протяжении 2 — 3 ч. Дальнейшая альтерация клеток сопровождается повреждением митохондрий — морфологического субстрата, на котором локализуются ферменты цикла Кребса и где осуществляется аэробное окисление и сопряженное с ним окислительное фосфорилирование. В связи с этим окисление еще более нарушается при почти неизменном гликолизе, что приводит к увеличению содержания молочной и трикарбоновых кислот (α-кетоглутаровой, яблочной, янтарной). Окисление при этом не завершается в цикле Кребса, снижается образование углекислоты, уменьшается дыхательный коэффициент.
Для характеристики метаболизма при воспалении издавна применяется термин "пожар обмена". Аналогия состоит не только в том, что обмен веществ в очаге воспаления резко повышен, но и в том, что "горение" происходит не до конца, а с образованием недоокисленных продуктов (полипетиды, жирные кислоты, кетоновые тела).
Следовательно, воспаление всегда начинается с усиления обмена веществ. Этим в значительной степени объясняется один из кардинальных признаков процесса — повышение температуры. В дальнейшем интенсивность метаболизма снижается, а вместе с этим изменяется и его направленность. Если сначала, т. е. в остром периоде воспаления, преобладают процессы распада, то в дальнейшем — процессы синтеза. Разграничить их во времени практически невозможно. Когда преобладают катаболические процессы, наблюдаются деполимеризация белково-гликозаминогликановых комплексов, распад белков, жиров и углеводов, появление свободных аминокислот, полипептидов, аминосахаров, уроновых кислот: Некоторые из образующихся веществ представляют особый интерес (кинины, простагландины), так как, включаясь в динамику воспаления, они придают ему определенный оттенок.
Анаболические процессы появляются очень рано, но преобладают на более поздних стадиях воспаления, когда проявляются восстановительные (репаративные) тенденции. В результате активирования определенных ферментов усиливается синтез ДНК и РНК, повышается активность гистиоцитов и фибробластов. В связи с повышением в них активности ферментов окислительно-восстановительных процессов активируются процессы окисления и окислительного фосфорилирования, увеличивается выход макроэргов.
Физико-химические изменения в очаге воспаления. Вследствие нарушения тканевого окисления и накопления в тканях недоокисленных продуктов развивается ацидоз. Сначала он компенсируется буферными механизмами, а затем становится декомпенсированным, в результате чего рН экссудата снижается. Концентрация ионов водорода тем выше, чем интенсивнее выражено воспаление. При остром абсцессе рН гноя может снизиться до 5,3. Наряду с повышенной кислотностью в воспаленной ткани повышается осмотическое давление, что является результатом усиления катаболических процессов: крупные молекулы расщепляются на более мелкие, их концентрация повышается. Увеличивается также содержание электролитов (ионов Na, К, Са). Концентрация ионов калия, освобождающегося из гибнущих клеток, в гнойном экссудате может достигать 256 — 511 ммоль/л (100 — 200 мг %), тогда как в нормальных тканях она не превышает 51,5 ммоль/л (20 мг %). Определение осмотического давления по снижению показателя точки замерзания экссудата показало, что депрессия составляет 0,6 — 0,8, что в пересчете на единицы измерения давления свидетельствует о повышении с 759 — 800 кПа (7,5 — 7,9 амт) в норме до 810 — 1114 кПа (8—11 атм) при воспалении (Шаде).
Ацидоз обусловливает набухание элементов соединительной ткани.
Повышение осмотического давления усиливает экссудацию и местный отек.
Этим объясняются главные признаки воспаления — появление припухлости и боли, наличие которой тоже в значительной степени объясняется натяжением ткани, возникающим при припухлости.
Пролиферация и завершение процесса. На этой стадии постепенно прекращаются разрушительные процессы и сменяются созидательными процессами. Прежде всего — это размножение клеток и возмещение возникшего ранее дефекта новообразованными клетками. Одновременно с размножением клеток и даже несколько опережая его, идет процесс активного погашения воспалительного процесса, что проявляется ингибицией ферментов, дезактивацией воспаления, расщеплением и выведением токсических продуктов. Активность клеток воспаления тормозится разными механизмами. Что касается ингибиторов, то в этом отношении важнейшую роль играет α2-макроглобулин (α2-М). Этот белок имеет широкий спектр действия. Он является главным ингибитором кининообразующих ферментов крови и таким образом устраняет их влияние: расширение и повышение проницаемости сосудов. Кроме того, он ингибирует большинство протеиназ из лейкоцитов, в том числе коллагеназу и эластазу и тем самым предохраняет от разрушения элементы соединительной ткани. Наконец, макроглобулин α2-М может связываться с мембранами нейтрофилов и таким образом тормозить их реакцию на СЗа и С5а (хемотаксис). В контроль за воспаление включаются и другие ингибиторы, в том числе альфа-антихимотрипсин (α1-АХ), который тормозит катепсин I и химотрипсин. Антитромбин III и α2-антиплазмин ингибируют сериновые ферменты и являются главными ингибиторами системы коагуляции, фибринолиза и комплемента.
В прекращении разрушительных явлений при воспалении важную роль играет устранение свободных радикалов. Внутри клеток свободные радикалы нейтрализует супероксиддисмутаза, а в экстрацеллюлярной фазе — церулоплазмин, катализируя реакцию НО2• + НО2• → Н2О2 + О2 .
Изменяется взаимоотношение между клетками. Они перестают вырабатывать одни медиаторы и начинают синтезировать другие. Теперь на тот же медиатор клетка может дать совсем другой ответ, потому что на ее поверхности появляются совсем другие рецепторы, а прежние проникают внутрь (интернализация).
Гистамин — типичный инициатор воспаления, но его эффект в конце воспаления может стать совсем иным, чем вначале. Оказалось, что это зависит от того, какие рецепторы "выставлены" на эффекторных клетках (например, на эндотелиоцитах) в данный момент. Если это Н1 то действие будет провоспалительное, а если Н2, то — противовоспалительное.
Полиморфно-ядерные нейтрофилы тоже подвергаются регулирующему влиянию тучных клеток. Гистамин, действуя на рецептор Н2, тормозит их хемотаксис, фагоцитарную активность, высвобождение лизосомальных протеаз. О сложных отношениях между клетками воспаления свидетельствует следующий факт. Известно, что тучные клетки при дегрануляции выделяют в среду два медиатора воспаления — гистамин и лейкотриен. В эозинофилах же содержатся два фермента, разрушающие эти медиаторы: гистаминаза и арилсульфатаза. Примечательно и то, что тучные клетки содержат еще одно вещество, привлекающее к ним эозинофилы. Это вещество называется фактором хемотаксиса эозинофилов. В итоге получается так, что эмигрирующие в зону воспаления эозинофилы разрушают медиаторы, выделенные тучными клетками, и тем самым гасят воспаление.
Для завершения процесса воспаления, особенно иммунного, большое значение имеет снижение активности лимфоцитов. В этом отношении гистамин тоже играет свою роль. Через рецепторы Н2 он тормозит секрецию лимфокинов, понижает митотическую активность лимфобластов, ограничивает активность Т-киллеров. Лимфокины инактивируются также и макрофагами через один из монокинов гистамина.
В инактивации клеток воспаления, кроме местных факторов, большую роль играют также и общие факторы, в том числе эндокринные. Гормон коры надпочечников кортизол тормозит синтез вазоактивных веществ в клетках, вызывает лимфопению, уменьшает число базофилов и эозинофилов. Кроме того, он стабилизирует мембраны лизосом.
На этом этапе воспаления меняются также свойства макрофагов: угнетается выработка интерлейкина-1. Что же касается фагоцитарной активности, то она к концу воспаления возрастает. Благодаря этому зона воспаления освобождается от некротизированных клеток, чуждых и токсических веществ.
После обезвреживания или локализации флогогенного фактора дальнейшие события направлены на ограничение зоны воспаления от остального организма, а затем замещения ее новой, здоровой тканью. Это осуществляется путем размножения оставшихся живых клеток (клетки резиденты), а также новых клеток из соседних зон (клетки эмигранты). Как миграция, так и пролиферация осуществляется за счет мезенхимальных клеток стромы. Размножаются стволовые клетки соединительной ткани — полибласты или лимфоидные клетки, адвентициальные и эндотелиальные клетки мелких сосудов, ретикулярные клетки лимфатических узлов. При дифференциации этих клеток образуются зрелые фибробласты, фиброциты, тучные и плазматические клетки, возникают новые капилляры. Все это совершается под контролем общих и местных факторов, которые могут как стимулировать, так и тормозить пролиферацию. К стимуляторам роста
относятся специфические белки или пептиды, источником которых являются тромбоциты (тромбоцитарный фактор роста фибробластов). В лимфоцитах также образуется пептид, стимулирующий соединительную ткань, а в моноцитах — стимулятор роста фибробластов (интерлейкин-1). Ряд веществ с таким же действием образуется не на тканевом,
8-09-2015, 22:14
