Интерфероны. Эти белки обладают противовирусной и иммуномодулирующей активностью. В зависимости от происхождения и соответственно строения молекулы интерферона (ИФН) человека делятся на 3 типа: ИФНa, продуцентами которого преимущественно являются макрофаги и В-клетки, ИФНb, продуцируемый фибробластами, и ИФНg, который синтезируют главным образом активированные Т-хелперы, относящиеся к субпопуляции Th1. Продукция ИФНg Т-клетками происходит в результате стимуляции последних Т-клеточными митогенами, антителами против CD3, специфическими вирусными антигенами, а также аллоантигенами МНС.
ИФНg "придает" клеткам непермиссивность для репликации вируса, проникшего в них путем непосредственного межклеточного транспорта. Кроме того, ИФНg оказывает необратимое цитотоксическое действие на трансформированные клетки, тогда как его цитостатическое влияние на нормальные клетки обратимо. ИФНg усиливает цитотоксические реакции, опосредованные Т-лимфоцитами, К- и NK-клетками. Одновременно ИФНg селективно повышает резистентность нормальных клеток к цитопатическим эффектам NK-клеток. За счет ИФНg возможна индукция цитотоксичности у нормальных макрофагов. Активность ИФНg в 10—300 раз выше, чем активность ИФНa и ИФНb.
ИЛ-10. Этот лимфокин (молекулярная масса 17000—21000), продуцируемый Т-клетками (Th2), может рассматриваться как антагонист ряда цитокинов. Так, ИЛ-10 подавляет продукцию ИФНgTh1-клетками. Кроме того, он тормозит пролиферативный ответ Т-клеток на антигены и митогены, а также подавляет секрецию активированными моноцитами ИЛ-1р, TNF и ИЛ-6. В то же время ИЛ-10 стимулирует секрецию иммуноглобулинов В-клетками. ИЛ-10 предотвращает апоптоз ИЛ-2 зависимых ЦТЛ, лишенных ИЛ-2.
ИЛ-12 человека состоит из двух субъединиц с молекулярной массой 40 000 и 35 000, удерживаемых дисульфидной связью. Субъединица р40 гомологична рецептору для ИЛ-6, а субъединица р35 отдаленно напоминает ИЛ-6 и гранулоцитарный колониестимулирующий фактор. ИЛ-12 повышает литическую активность клеток системы ЛАК, а также специфическую цитотоксичность ЦТЛ. ИЛ-12 действует как ростовой фактор при активации Т- и NK-клеток. При этом он действует в качестве индуктора секреции ИФНg и ингибитора синтеза IgE индуцированного ИЛ-4.
ПРОВОСПАЛИТЕЛЬНЫЕ ЦИТОКИНЫ
В случае несостоятельности местных защитных реакций воспалительная реакция развивается, возрастает синтез цитокинов, они попадают в циркуляцию, и их действие проявляется на системном уровне. Начинается системная воспалительная реакция или острофазовый ответ на уровне организма. При этом провоспалительные цитокины оказывают влияние практически на все органы и системы организма, участвующие в регуляции гомеостаза.
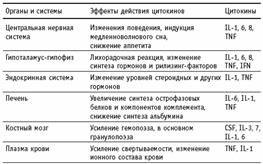
Действие провоспалительных цитокинов на ЦНС приводит к снижению аппетита и изменению всего комплекса поведенческих реакций. Временное прекращение поиска пищи и снижение сексуальной активности выгодно в плане экономии энергии для одной лишь за дачи — борьбы с внедрившимся патогеном. Этот сигнал обеспечивают цитокины, так как их попадание в циркуляцию, безусловно, означает, что местная защита не справилась с патогеном и требуется включение системной воспалительной реакции. Одно из первых проявлений системной воспалительной реакции, связанное с действием цитокинов на терморегуляторный центр гипоталамуса, заключается в подъеме температуры тела. Увеличение температуры является одной из эффективных защитных реакций, так как при повышенной температуре снижается способность ряда бактерий к размножению, и, напротив, возрастает пролиферация лимфоцитов.
В печени под влиянием цитокинов увеличивается синтез острофазовых белков и компонентов системы комплемента, нужных для борьбы с патогеном, но одновременно снижается синтез альбумина. То есть на уровне регуляции экспрессии отдельных генов цитокины направляют энергетические потоки, выбирая только то, что нужно для развития защитных реакций. Видимо, такая система регуляции сформировалась эволюционно и несет безусловные выгоды для наиболее оптимального защитного ответа макроорганизма. Другим примером избирательного действия цитокинов служит изменение ионного состава плазмы крови при развитии системной воспалительной реакции. При этом происходит снижение уровня ионов железа, но повышение уровня ионов цинка, а ведь хорошо известно, что лишить бактериальную клетку ионов железа — значит снизить ее пролиферативный потенциал (на этом основано действие лактоферрина). С другой стороны, увеличение уровня цинка нужно для нормальной работы иммунной системы, в частности, это необходимо для образования биологически активного сывороточного фактора тимуса — одного из основных тимических гормонов, обеспечивающих дифференцировку лимфоцитов. Влияние цитокинов на кроветворную систему связано с существенной активизацией гемопоэза. Увеличение числа лейкоцитов, конечно, необходимо для наращивания количества клеток, непосредственно убивающих патогены, и для восполнения потерь нейтрофильных гранулоцитов в очаге гнойного воспаления. Действие на системусвертывания крови направлено на усиление свертываемости, которое необходимо для остановки кровотечения и для прямого блокирования патогена. Наконец, в рамках иммунной системы цитокины осуществляют взаимосвязь между неспецифическими защитными реакциями и специфическим иммунитетом, действуя в обоих направлениях. Таким образом, на уровне организма цитокины осуществляют связь между иммунной, нервной, эндокринной, кроветворной и другими системами и служат для их вовлечения в организацию и ре гуляцию единой защитной реакции. Цитокины как раз и служат той организующей системой, которая формирует и регулирует весь комплекс защитных реакций организма при внедрении патогенов. Приведенные данные ясно указывают, что нельзя ограничить понятие защитных реакций только участием неспецифических механизмов резистентности и специфического иммунного ответа. В единой защитной реакции участвует весь организм и все системы, на первый взгляд не относящиеся к поддержанию иммунитета. Увеличение уровней цитокинов не может продолжаться бесконтрольно, так как гиперпродукция цитокинов служит причиной развития ряда патологических состояний, в частности, септического шока. Появление цитокинов в кровотоке сразу приводит к увеличению синтеза стероидных гормонов, причем IL-1 и другие провоспалительные цитокины вызывают как усиление синтеза рилизинг-факторов, так и стимуляцию продукции гормонов клетками коры надпочечников. Стероидные гормоны, известные как одни из наиболее мощных иммуносупрессоров, блокируют синтез цитокинов и не позволяют их уровню превысить предельные значения. Это является эффективным механизмом отрицательной обратной связи для контроля гиперпродукции цитокинов. Тем не менее, в ряде случаев уровни цитокинов превышают физиологические концентрации. Цитокины в низких концентрациях нужны для правильного формирования местного воспаления, более высокие дозы вызывают развитие системной воспалительной реакции, но патологически высокие концентрации приводят к состоянию септического шока и гибели организма.
РОЛЬ
Как уже отмечалось, большинство цитокинов не играет никакой роли в нормальной физиологии организма, а синтезируются лишь при развитии защитных реакций. Тем не менее, некоторые цитокины в небольших количествах синтезируются постоянно, регулируя различные этапы нормального гемопоэза, либо только на определенных этапах развития организма. Так, в онтогенезе цитокины группы TNF и ряд хемокинов регулируют нормальное развитие клеток, миграцию лимфоидных предшественников и закладку органов иммунной системы. Не менее важную роль цитокины играют и в регуляции дифференцировки и функциональной активности лимфоцитов, а значит, в регуляции специфического иммунитета. В настоящее время признано, что типы иммунного ответа связаны с одним из вариантов активации лимфоцитов с преимущественным участием клонов Т-лимфоцитов хелперов первого типа (Th1) или второго типа (Th2), которые различаются по паттернам продуцируемых цитокинов и ролью в стимулировании развития иммунного ответа по клеточному или гуморальному типу.
В последние годы активно дискутируется роль цитокинов в патологии, в частности, участие хемокинов в патогенезе СПИДа. Оказалось, что отдельные рецепторы хемокинов могут служить кофакторами для проникновения вируса иммунодефицита человека (ВИЧ) в клетки. Штаммы ВИЧ, тропные к моноцитам, используют рецепторы СС хемокинов, тогда как штаммы ВИЧ, тропные к Т-лимфоцитам и доминирующие на более поздних стадиях прогрессии СПИДа, используют рецепторы СХС хемокинов, в частности, рецептор CXCR4. Такие СС хемокины, как RANTES, MIP-1α и MIP-1β, блокируют вход некоторых штаммов ВИЧ в клетки макрофагального ряда посредством рецептора CCR5, а СХС хемокин SDF-1, взаимодействующий с рецепторомCXCR4, блокирует инфицирование лимфоцитов лимфотропными штаммами ВИЧ. Лица, гомозиготные по делеции определенного участка из 32 пар оснований в аллелях гена рецептора хемокинов CCR5, оказались высокорезистентны к инфицированию ВИЧ, потому что дефектный рецептор не способен экспрессироваться на мембране клетки. Лица, гетерозигот ные по данной делеции, подвержены инфицированию ВИЧ, но СПИД прогрессирует у них значительномедленнее. ВИЧ использует клеточные рецепторы хемокинов для инфицирования клеток, и это лишь один из случаев приспособления микроорганизмов с целью обойти пагубное влияние иммунной системы или, более того, использовать молекулы иммунной системы для своего развития и размножения. Сейчас накоплено достаточно фактов, указывающих на активное использование микроорганизмами рецепторов цитокинов в своих целях и модификацию биологического действия цитокинов, меняющую противоинфекционную направленность их биологической активности. Ряд вирусов, в частности, вирус герпеса и цитомегаловирус, экспрессируют белки, имеющие высокую степень гомологии с рецепторами хемокинов. Вероятно, таким способом вирусы синтезируют белки, служащие ловушками для хемокинов, что ведет к снижению концентрации хемокинов и противодействию развития защитных реакций. Другое предположение заключается в том, что кодируемый вирусным геномом хемокиновый рецептор может экспрессироваться на мембране инфицированной клетки. Активация клетки через данный рецептор может служить дополнительным сигналом для усиления вирусной репликации. Движущей силой интенсивного изучения цитокинов всегда была многообещающая перспектива их клинического использования для лечения широко распространенных заболеваний, в том числе рака. Сейчас многие цитокины применяются в клинической практике в виде лекарственных препаратов. Существует три принципиальных варианта применения цитокинов в клинической практике: 1. Лечение препаратами цитокинов, а именно, усиление действия эндогенных цитокинов путем введения в организм природных или рекомбинантных молекул цитокинов (IL-1, IL-2, CSF, IFN и др.) либо заместительная терапия (эритропоэтин). 2. Цитокиновая генотерапия рака путем введения генов цитокинов в опухолевые клетки для усиления их иммуногенности и повышения воспа лительной реакции в области опухолевого узла и иммунного отторжения опухоли. 3. Антицитокиновая терапия, направленная на удаление или блокирование действия эндогенных цитокинов с использованием специфических ингибиторов (в том числе членов семейства цитокинов, например IL-1Ra для блокирования действия IL-1), моноклональных антител к цитокинам, а также растворимых рецепторов.
В настоящее время цитокины находят все более широкое применение в клинической практике для лечения различных онкологических, инфекционных и иммунодефицитных заболеваний. Этот новый класс регуляторных молекул создан природой в ходе миллионов лет эволюции и обладает неограниченными возможностями для употребления в качестве лекарственных препаратов. Нужно только научиться грамотно использовать эти мощные регуляторы на благо человека.
ЛИТЕРАТУРА
· Atkins E., Wood W. Studies on the pathogenesis of fever // J. Exp. Med. —1955.— Vol. 102. — P. 499–516.
· Baggiolini M., Dewald B., Moser B. Human chemokines: an update // Annu. Rev. Immunol. — 1997. — Vol. 15. — P. 675–705.
· Brightbill H., Modlin R. Toll_like receptors: molecular mechanisms of the mammalian immune response // Immunology. — 2000.
· Cohen S., Bigazzi P., Yoshida T. Similarities of T cell function in cell_mediated immunity and antibody production // Cell. Immunol. — 1974. — Vol. 12. — P. 150–159.
· Dinarello C. The biological properties of interleukin_1 // Eur. Cytokine Netw. — 1994. — Vol. 5. — P. 517–526.
· Fernandez_Botran R., Chilton P., Ma Y. Soluble cytokine receptors: their roles in immunoregulation, disease and therapy // Adv. Immunol. — 1996. —Vol. 63. — P. 269–336.
· Heim M. The Jak_STAT pathway: specific signal transduction from the cell membrane to the nucleus // Eur. J. Clin. Invest. — 1996. — Vol. 26. — P. 1–12.
· Ihle J., Witthuhn B., Quelle F. et al. Signaling through the hematopoietic cytokine receptors // Annu. Rew. Immunol. — 1995. — Vol. 13. — P. 369–398.
· Isaack A., Lindenmann J. Virus interference. I. The Interferon // Proc. Roy. Soc. Series B. — 1957. — Vol. 147. — P. 258–267.
· Lee B., Montaner L. Chemokine immunobiology in HIV_1 pathogenesis //J. Leukocyte Biol. — 1999. — Vol. 65. — P. 552–565.
· Mantovani A., Bussolino F., Introna M. Cytokine regulation of endothelial cell function: from molecular level to the bed side // Immunol. Today. — 1997. —Vol. 18. — P. 231–239.
· Morgan D., Ruscetti F., Gallo R. Selective in vitro growth of T_lymphocytes from normal human bone marrows // Science. — 1976. — Vol. 193. — P. 1007–1008.
· Mosmann T., Cherwinski H., Bond M. et al. Two types of murine helper t cell clone. I. Definition according to profiles of lymphokine activities and secreted proteins // J. Immunol. — 1986. — Vol. 136. — P. 2348–2357.
· Oppenheim J., Feldman M. (Eds) Cytokine Reference. — London: Academic Press, 2000. — 2015 p.
· Romagnani S. The Th1/Th2 paradigm // Immunol. Today. — 1997. — Vol. 18.— P. 263–266.
· Ройт А. Основы иммунологии (пер. с англ.). М.: Мир, 1991. 328 с.
8-09-2015, 22:49
