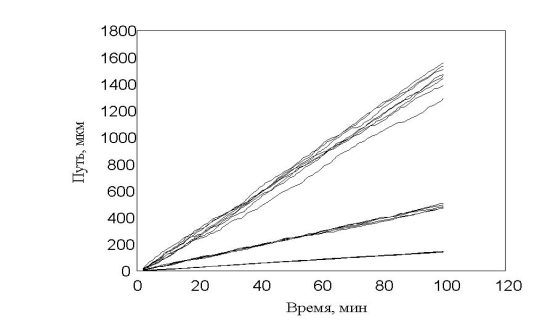
рис. 12 Зависимость пройденного пути от времени. Три группы клеток (max_step: 3, 10, 30 mcm - соотношение 15:30:55)
Показано движение 15 клеток из 30, которые генерировала модель. Наиболее удивительным в эксперименте был факт постоянной скорости движения клеток в течении всего эксперимента, не смотря на случайный характер их движения. Модель хорошо воспроизводит этот факт, при этом случайные колебания скорости практически незаметны. Каждая отдельная кривая представленная на рис. 12 хорошо соответствует экспериментальным данным рис. 13 . Однако из сравнения рис. 12 и рис. 13 видно, что в эксперименте существуют все варианты скоростей движения, а в модельном эксперименте, четко выделяются три группы клеток.
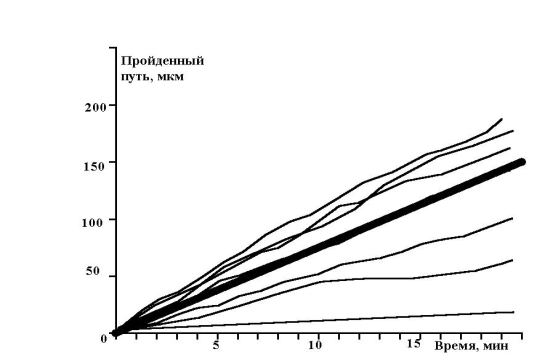
рис. 13 Зависимость пройденного пути от времени (эксперимент)
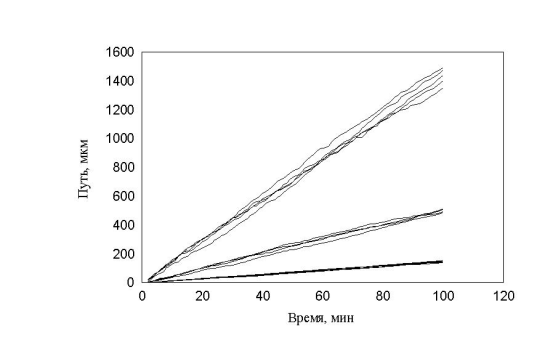
рис. 14 Зависимость пройденного пути от времени. Три группы клеток (max_step: 3, 10, 30 mcm соотношение 1:1:1)
Таким образом, условное деление клеток на группы, введенное экспериментатором не может быть основой для моделирования. При изменении процентного состава клеток в популяции рис. 14 видно, что характер распределения клеток по скоростям не изменяется. В обоих случаях четко выделяются три группы клеток, которые и были заложены в модель.
При моделировании популяции был проведен еще один эксперимент рис. 15 , все параметры движения были такими, как и в предыдущем эксперименте.
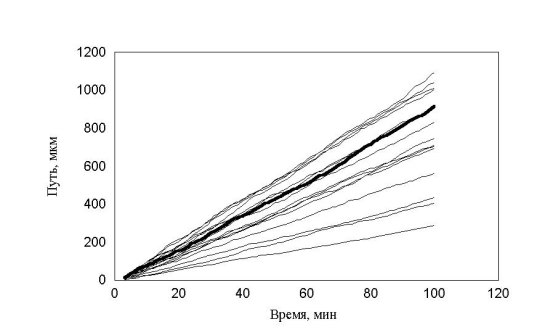
рис. 15 Зависимость пройденного пути от времени. Три группы клеток (max_step: 3, 10, 30 mcm, соотношение 1:1:1 время измерения каждый десятый шаг)
Однако «теоретический наблюдатель» имел возможность регистрировать положение клеток только на каждом 10-м шаге. В этом случае существование трех групп клеток практически не видно. Это связано с тем, что траектория движения клеток запутанная. Часто встречаются случае, когда клетки за 10 шагов успевают повернуть на зад. Таким образом, на каких-то участках траектории «возникает иллюзия» малых шагов у быстрых клеток и возникает картина, похожая на экспериментальную. Интересно отметить, что максимальная скорость измерения упала в 3 раза (приблизительно Ö10) по сравнению с заданной в программе. Последний расчет указывает на то, что выбор интервала времени, для последовательного положения клеток, очень существенен.
В экспериментах положение клетки оценивалось как положение её центра масс. Ясно, что координаты меняются от изменения формы клеток. Из этого следует, что чем меньше интервал времени, между измерениями, тем точнее измерение скорости. Однако смещение центра масс на расстояние меньше размера клеток нельзя считать устойчивым. В результате, для измерения скорости был выбран интервал 1 минута, который примерно соответствует смещению средних клеток на расстояние порядка их размера.
Последний рисунок не смотря с его схожестью с экспериментом не может считаться истинным. Таким образом приходим к выводу, что деление сделанное экспериментатором на быстрые, средние и медленные клетки очень условно и его можно принимать только как некую мнемонику.
Таким образом, было введено принципиальное изменение в модели рис. 1 6 . В популяции присутствовали клетки с непрерывно распределенными скоростями, а не три ярко выраженные группы. Распределение минутных сдвигов для каждой клетки было принципиально таким же, как и в предыдущей модели. Сдвиги распределены от 0 до rmax , а величины rmax в популяции были распределены в соответствии с таким же распределением. Генерировалась случайная популяция клеток, после чего для каждой клетки генерировались сдвиги, и рассчитывалось движение клеток в популяции. Результат расчета, показанный на рис. 1 6 , полностью совпадает с экспериментальным. Мы моделировали не только перемещение, но и процесс измерения перемещений. Процедура измерений перемещений просматривала все движущиеся клетки, не зная к какой группе относится каждая из них.
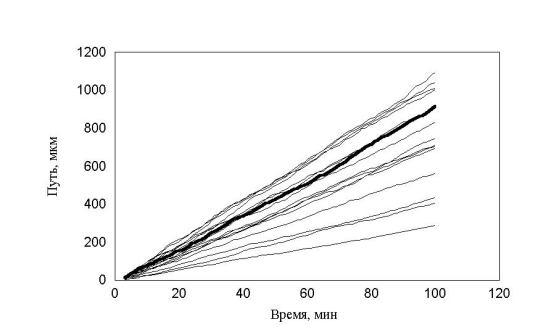
рис. 16 Зависимость пройденного пути от времени. Клетки распределены непрерывно (max_step: 30 mcm, соотношение случайное, время измерения каждый шаг)
В результате она смешивала все клетки и строила гистограмму
рис. 1
7 – 1
9
. Все полученные гистограммы не имели характерных особенностей и были, в принципе, похожи друг на друга. В результате приходим к важному выводу – измерение гистограмм, в эксперименте, не дает существенной информации о характере движения. Такой же вывод будет сделан и в параллельной работе при более детальном анализе каждой отдельной клетки.
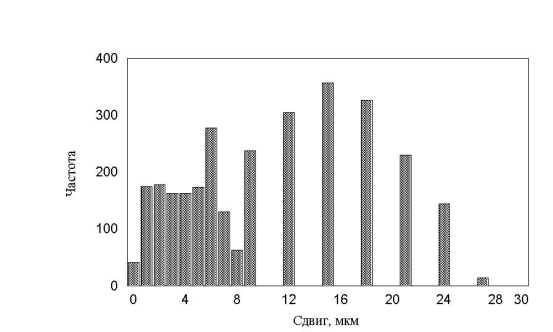
рис. 17 Гистограмма минутных сдвигов. Три группы клеток (max_step 3, 10, 30 соотношение клеток 15:30:55)
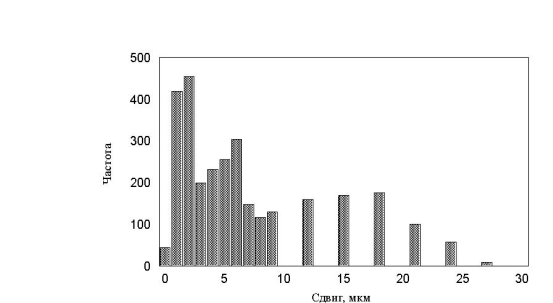
рис. 18 Гистограмма минутных сдвигов. Три группы клеток (max_step 3, 10, 30 соотношение клеток 1:1:1)
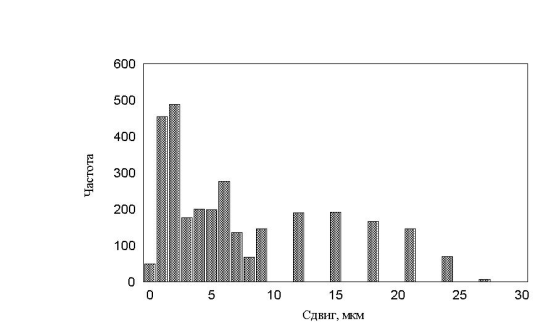
рис. 19 Гистограмма минутных сдвигов. Три группы клеток (max_step 3, 10, 30 соотношение клеток 1:1:1, время измерения каждый десятый шаг)
Исследование зависимости среднеквадратичного отклонения от времени наблюдения
Как известно из теории Броуновского движения, важным показателем случайного блуждания является среднеквадратичное отклонение. Мы использовали этот показатель для движения нейтрофилов. Прежде всего, мы рассматривали частицу, у которой углы поворотов распределены равномерно, т.е. клетка с равной вероятностью может повернуть в любую сторону. Результат показан на рис. 20 .
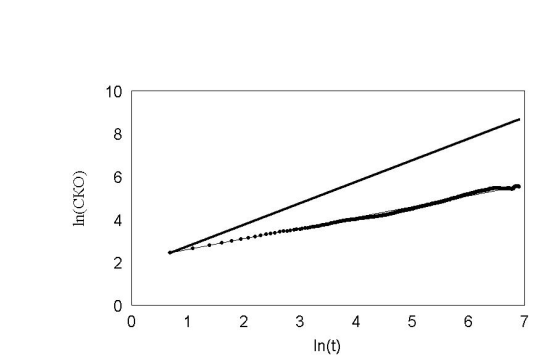
рис. 20 Расномерное распределение углов.
На этом рисунке по оси ординат отложен ln времени. По оси абсцисс отложен ln среднеквадратичного отклонения клетки. Как показано Энштейном и Смолуховским для броуновской частицы, эта зависимость отображается прямой с наклоном 0,5. Как видно, наша кривая хорошо ложится на прямую с наклоном 0,5. Для сравнения, на этом же графике проведена прямая с наклоном 1. Если бы клетка не поворачивалась вообще, то её среднеквадратичное отклонение легло бы на прямую с наклоном 1. Результат показан на рис. 21 .
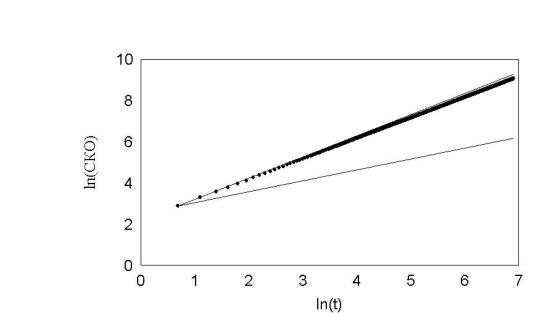
рис. 21 Почти нулевой угол поворотов.
Здесь на всякий случай оставили небольшую вероятность (2%) поворота на 180 . В результате среднеквадратичное отклонение этих клеток слегка отклоняется от прямой.
При задании в модели экспериментально измеренных распределений углов поворотов рис. 22 получили кривые поразительно похожие на эксперимент. В начале, среднеквадратичное отклонение идет вдоль прямой с наклоном 1, затем отклоняется и асимптотически стремиться к наклону 0,5 рис. 23 – 24 . Такой характер зависимости в литературе принято трактовать как клеточную память. В нашей модели процесс был принципиально марковским. В каждый момент времени распределение углов и сдвигов не зависело от предыстории. И тем не менее картина воспроизводилась с точностью до времен. Конечно если трактовать память в бытовом смысле, то элементы памяти в модели есть. Все-таки нулевой угол поворота по отношению к предыдущему шагу является предпочтительным.
рис. 22 Гистограммы углов заданных поворотов.
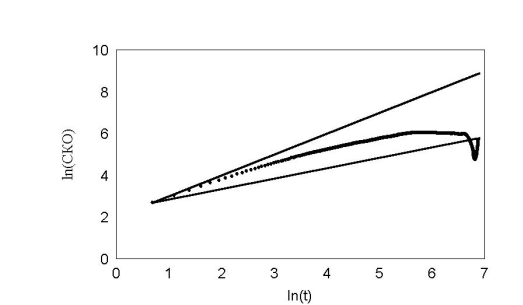
рис. 23 Обычное распределение углов fast.
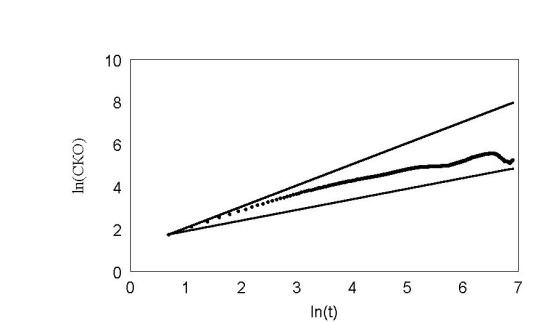
рис. 24 Обычное распределение углов slow.
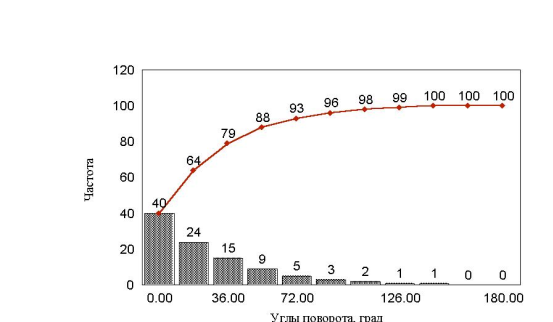
рис. 25 Гистограмма углов заданных поворотов (хемотаксис)
Однако памяти, в математическом смысле, в модели нет.
Если мы сделаем нулевой угол еще более предпочтительным рис. 25 , то естественно получим кривую среднеквадратичного отклонения, очень близкую к кривой, получаемой при хемотаксисе.
Очень важный результат, для нашей экспериментальной группы, можно видеть на рис. 23 . Кривая среднеквадратичного отклонения на больших временах начинает снижаться с отрицательным наклоном. Естественно, что для броуновской частицы это невозможно. Из модели ясно, что это отклонение связано с недостатком статистики для вычисления последних точек. На рис. 26 приведены графики многих клеток.
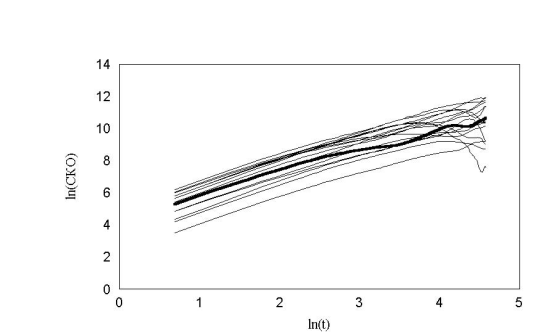
рис. 26 Зависимость среднеквадратичного отклонения. Клетки распределены непрерывно (max_step: 30 mcm соотношение случайное время измерения каждый шаг)
Видно, что в каких-то клетках это явление наблюдается или не наблюдается вообще или загибается «хвостик» вверх. Загибание «хвоста» вниз в эксперименте может означать только одно, клетка закономерно стала возвращаться к исходной точке. В результате стало возникать подозрение, что на экспериментальных стеклышках имеются какие-то условия (например царапины), которые обеспечивают не случайное движение. Такое подозрение ставит под сомнение и все другие результаты.
На модели нам удалось показать, что это, скорее всего, только недостаток статистики для вычисления последних точек. И их не нужно принимать во внимание.
Заключение
В последние годы в литературе наметился быстрый рост количества работ, посвященных движению клеток крови – нейтрофилов. Это связанно с двумя основными факторами: появление новых современных методов изучения движения и бурным нарастанием знаний о внутриклеточной регуляции жизненно важных процессов.
Установлено, что на сегодняшний день объем знаний в медицине нарастает в полтора – два раза быстрее, чем в любой другой науке. Новые методы изучения движения клеток связаны в первую очередь с развитием систем анализа изображения. Ясно, что эти методы имеют большое преимущество над традиционными, которые опирались на изучение «диффузии» популяции. Методы анализа изображения позволяют изучать не только миграцию клеток, но и изменение их формы, связанное с вытягиванием псевдоподии. В настоящее время накоплен очень большой материал по формальному описанию движения клеток, развита теория описания движения, основанная на анализе случайных процессов. Однако многие вопросы остаются до сих пор непонятными. Отчасти это связанно с недостатком знаний и не возможностью провести прямые измерения параметров ряда процессов, определяющих движение клетки. Например, из экспериментальных данных ясно, что движение клеток связано с их прилипанием к стеклу, по которому они движутся. Если клетка не прилипает к стеклу вообще, то она не движется. Если же она прилипает очень сильно, то она опять не в состоянии двигаться. До сих пор не существует методов измерения степени прилипания клетки к стеклу. Разумеется в распоряжении исследователя даже нет средств для измерения многих физических характеристик движения, но он имеет множество возможностей изменять эти характеристики. В этих условиях, важным шагом, который может обеспечить дальнейшие исследования, является математическое моделирование. Математическое моделирование позволяет исследователю упорядочить и систематизировать имеющиеся знания. Проверить непротиворечивость выдвинутых гипотез и выделить существенные и не существенные факторы высказываемых в них.
Модель движения популяции нейтрофилов не учитывала изменение формы отдельных клеток, а ограничивалась результирующими параметрами каждой клетки. Клетка могла переместиться в случайном направлении (распределение углов поворотов задавалось на случайное расстояние), на случайное расстояние (распределение также задавалось). Популяция была разбита на 3 группы: медленные, средние и быстрые. Это распределение было взято из экспериментальной практики, при этом модель учитывала даже процентное соотношение в популяции. В результате моделирования установлено, что первая из зависимостей (зависимость пройденного пути от времени) совершенно не соответствует экспериментальной. Положение не спасало и изменение процентного состава клеток в популяции. Единственный выход, подсказанный моделью, это отказ от деления популяции на группы и введение непрерывно распределенных скоростей.
Моделирование выбора интервала времени для измерений последовательных положений клеток, для измерения скоростей, показало, что не только значения мгновенных скоростей зависит от интервала, что само по себе очевидно. Выбор слишком большого интервала «размазывает» популяционные характеристики движения, приближая модельную картину к экспериментальной. Это очень опасный артифакт. Как и обсуждается в главе результаты исследований, временной интервал для измерения мгновенных скоростей должен быть порядка времени перемещения клетки на расстояние сравнимое с её размером. При этом показано, что даже при «правильном измерении» построение гистограмм элементарных перемещений практически не несет никакой информации ни о характере движения клеток, ни о популяционном составе. Изучение классического параметра случайного движения – среднеквадратического отклонения показало, что на малых временах клетки ведут себя как объекты, движущиеся целенаправленно. На больших временах клетки ведут себя как броуновские частицы.
Применение веществ, которые привлекают клетку к себе (хемоаттрактанты) увеличивают интервал времени, в течении которого клетка движется целенаправленно. Само по себе это не удивительно. Однако в литературе широко принято связывать это явление с клеточной памятью. Наша модель была в принципе марковской. В ней небыло памяти в строгом смысле слова. В не строго смысле некий элемент, который можно трактовать как память был. Нулевой угол поворота был более предпочтителен, а при применении хемоаттрактанта вероятность нулевого угла увеличивалась. Тем не менее модель воспроизводила экспериментальные данные с поразительной точностью. Воспроизводилось даже время с целенаправленным движением. Таким образом попытки интерпретации этого времени как клеточной памяти вызывают серьезные сомнения. Очень важными оказались результаты моделирования среднеквадратичного отклонения на больших временах. График зависимости среднеквадратичного отклонения от времени начинает отклоняться от теоретического в случайном направлении, в плоть до того, что среднеквадратичное отклонение начинает уменьшаться. Эта особенность, полученная в эксперименте, «вызвало панику» у экспериментаторов. Уменьшение среднеквадратичного отклонения можно было интерпретировать только как целенаправленное возвращение клетки обратно. Физически это можно представить себе как возвращение клетки вдоль некоторого дефекта подложки, невидимого в микроскоп. Разумеется, это ставит под сомнение качество всего эксперимента. На модели показано, что это явление связано всего лишь с недостатком статистики для последнего участка кривой.
Выводы
1. Создана популяционная математическая модель случайного блуждания нейтрофилов, которая описывает основные характеристики движения;
2. Широко принятое в литературе деление нейтрофилов на медленные, средние и быстрые следует считать условным. Экспериментальные измерения скоростей нейтрофилов в популяции распределены непрерывно;
3. Модель подвергает сомнению широко принятое мнение о существовании памяти нейтрофилов. Экспериментальные данные хорошо описываются в рамках марковской модели;
4. Наблюдаемое в эксперименте закономерное возвращение некоторых нейтрофилов к начальной точке связано только с недостатком статистики для измерения среднеквадратичного отклонения на больших временах.
Список литературы
1. Boyden S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leukocytes. J. Exp.Med., 1962, v.115, 453-465.
2. Coates T.D. et al. Relationship of F-actin distribution to development of polar shape in human polymorphonuclear neutrophils. J.Cell Biol. 1992, v.117, N4, 765-774.
3. Crawford N., Chahal H., Jackson P. The isolation and characterisation of guineapig polymorphonuclear leucocyte actin and myosin. Biochim. et diophis acta, 1980, v.626, N1, 218-233.
4. Harris H. Chemotaxis of granulocytes. J. Pathol. Bacteriol., 1953, v.66, 135-140.
5. Hartman R.S., Lau K. The fundamental motor of the human neutrophil is not random: Evidence for local non-Markov movement in neutrophils. Biophys. J., 1994, v.67, 2535-2545.
6. King C.A. et al. Cell-substrate interactions during amoeboid locomotion of neutrophyl leukocytes., Exp. Cell Res., 1980, v.126, 453-458.
7. Nelson R.D., Quie P.G. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. J. Immunol., 1975, v.115, 1650-1656.
8. Omann G.M. et al. Signal transduction and cytoskeletal activation in the neutrophil. Physiol. Rev, 1987, v.67, N1, 285-319.
9. Quie P. G., Mills E. L., McPhail L. C., Johnston R. B. Phagocytic Defects Springer Semin. Immunopathol 1978, v. 1, 323-337.
10. Repo H. Defects in fagocytic functions. Annals of Clinical
11. Research. 1987, v.19, 263-279.
12. Senda N., Tamura H., Shibata N. The mechanism of the movement of leucocytes. Exp. Cell Res., 1975, v.91, N2, 393-407.
13. Snyderman R., Goetzl E. J. Molecular and cellular mechnisms of leukocyte chemotaxis. Scince 1981, v.213, 830-837.
14. Springer T. A. Adhesion receptors of the immune system. Nature, 1990, v 346, 425-434.
15. Stossel T.P. On the crawling of animal cells. Science 1993, v.260, 1086-1094.
16. Адо А.Д. Патофизиология фагоцитов. 1961.
17. Васильев Ю.М., Гельфанд И.М. Движение и морфогенетические реакции тканевых клеток в культуре. В сб. Движ.нем.кл.1977г.
18. Галкин А.А. и соавт. 1994
19. Красовская И.Е. Сократительные белки немышечных клеток . I. Актино- и миозиноподобные белки. в сб. Движение немышечных клеток и их компонентов. 1977г.
20. Маянский А.Н., Маянский Д.Н. 1989г.
21. Нерсесова Л.С. Движение немышечных клеток и их компонентов., Ленинград, «Наука» 1977г.
22. Туманов Е.А. и соавт. Бюлл. Эксп. Биол. Мед. 1990, N6, 594-597.
Приложение
Текст программы математического моделирования случайного блуждания популяции нейтровилов
program neutro;
uses dos, crt, graph;
const
uparrow = #72;
leftarrow = #75;
rightarrow = #77;
downarrow = #80;
type
gr_descriptor = record
x_0,y_0 : word;
X_len,y_len : word;
X_scale, Y_scale : real;
end;
prob_mov = record
max_step : real;
cell_name : string;
step, manual : array[0..10] of real;
cent, cummulate : array[0..10] of word;
end;
scr_mod = (name_edit, arg_edit, fun_edit, diag_edit);
cell_typ = (slow, mean, fast);
par_typ = (g_shift, l_shift, angle);
scr_adr=record
x : integer;
y : integer;
end;
cell_descriptor = record
speed : cell_typ;
x, y, angle : array[1..100] of real;
end;
var
cell : array[1..30] of
8-09-2015, 21:04
