11 Общие требования к испытаниям на чистоту
Основное требование к испытаниям на чистоту — достаточная чувствительность, специфичность и воспроизводимость используемой реакции.
Содержание примесей можно установить эталонным и безэталонным путем. Эталонный — основан на сравнении со стандартом (эталонным раствором), содержащим определенное количество открываемой примеси. При этом в одинаковых условиях выполнения реакции наблюдают окраску или помутнение, возникающие при добавлении соответствующего реактива. Безэталонный путь — установление предела содержания примеси по отсутствию положительной реакции. При этом предел содержания примесей не превышает чувствительности реакции.
При выполнении испытаний на чистоту необходимо строго соблюдать общие указания ГФ: достаточная степень чистоты воды и растворов реактивов, точность навесок (до 0,001 г), одинаковые диаметры и цвет стекла посуды, объемы реактивов, последовательность и скорость их прибавления, единообразные условия наблюдения результатов испытаний.
12 Общие испытания на примеси неорганических ионов
Определение примесей и приблизительную оценку их количества осуществляют колориметрическим или нефеломет- рическим методами путем сравнения с эталонными растворами, нормирующими предельное содержание примеси.
Испытание иа хлориды основано на реакции с ионами серебра:
![]()
Возникает белая опалесценция, не исчезающая после добавления азотной кислоты и исчезающая при добавлении раствора аммиака:
![]()
Испытание на сульфаты основано на реакции с ионами бария:
![]()
Образуется белая опалесценция, не исчезающая от добавления хлороводородной кислоты.
Испытание на соли аммония основано на взаимодействии с реактивом Несслера:
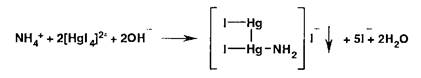
Образуется желтое окрашивание или желто-бурый осадок.
Менее чувствителен (0,003 мг в 1 мл) способ обнаружения примеси солей аммония, основанный на выделении аммиака под действием гидроксида натрия:
![]()
Выделяющийся аммиак обнаруживают по запаху или по посинению красной лакмусовой бумаги.
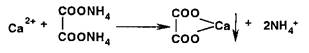
Испытание на соли кальция основано на образовании белого мелкокристаллического осадка при действии оксалатом аммония:
|
Осадок не исчезает при добавлении уксусной кислоты, но легко растворяется в хлороводородной или азотной кислотах:
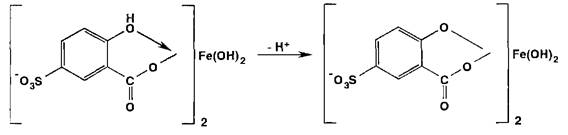
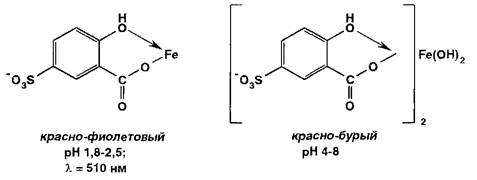
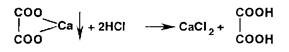
Испытание на соли железа (II) и (III) основано на образовании окрашенных феррилсульфосалицилатных солей или комплексов при взаимодействии с раствором сульфосалициловой кислоты. Окраска и состав комплексов зависят от рН среды:
В щелочных средах рН 9-11,5 образуется комплекс желтого цвета (Х1ШХ 416 нм), а при рН > 12 он разлагается с депрото- нированием анионного бис-комплекса:
Испытание на соли цинка основано на образовании белого осадка при взаимодействии с раствором гексацианоферрата (II) калия:
![]()
Обнаружению мешают ионы железа (III), которые в этих условиях дают синее окрашивание. Поэтому их вначале осаждают раствором аммиака.
Испытание на соли тяжелых металлов основано на образовании в уксуснокислой или нейтральной среде черного осадка или бурой окраски раствора при взаимодействии с сульфид-ионами:
![]()
13 Обнаружение примеси мышьяка
В ГФ приведено два способа определения примеси мышьяка вJIB.
Способ 1 основан на реакции Зангера-Блека и осуществляется путем восстановления соединений мышьяка (III) цинком (в присутствии хлороводородной кислоты) в специальном приборе до арсина:
![]()
Арсин, проходя через слой ваты, пропитанной ацетатом свинца, освобождается от возможной примеси сероводорода:
![]()
Предварительно дихлорид олова восстанавливает соединения мышьяка (V) до (III):
![]()
Затем арсин, соприкасаясь с бумагой, пропитанной раствором дихлорида ртути, окрашивает ее в зависимости от концентрации мышьяка в оранжевый или желтый цвет. Последовательно происходят реакции:
![]()
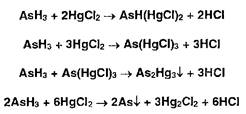
Повысить предел чувствительности реакций с 0,001 мг до 0,0005 мг (0,5 мкг) можно, если обработать бумагу раствором йодида калил. Происходит взаимодействие дихлорида ртути (I) с йодидом калия:
![]()
Окраска усиливается за счет образования металлической ртути:
![]()
Недостаток способа 1 состоит в невозможности обнаружения примеси мышьяка в присутствии соединений сурьмы, фосфора, солей тяжелых металлов, сульфид- и сульфит-ионов.
Способ 2, основанный на реакции Буго-Тиле, не имеет этого недостатка, но реакция менее чувствительна (0,01 мг). Сущность реакции обусловлена восстановительными свойствами натриевой соли фосфорноватистой кислоты (гипофо- сфита натрия), которая восстанавливает соединения мышьяка, окисляясь при этом до фосфористой кислоты. В зависимости от содержания примеси соединений мышьяка появляется бурое окрашивание или бурый осадок:
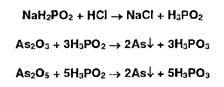
Испытание выполняют в пробирке, в которую вносят навеску испытуемого ЛВ, реактив и нагревают в кипящей водяной бане 15 мин. После охлаждения прибавляют 3 мл воды, 5 мл эфира, тщательно взбалтывают. При наличии примеси соединений мышьяка на границе слоев жидкостей образуется бурая пленка (осадок мышьяка). Этот способ применим также для определения селена и теллура.
14 Определение воды и летучих веществ
В ГФ включены два физических метода (высушивания и дистилляции) и один химический (акваметрия) метод определения воды. Метод высушивания заключается в установлении разности массы ЛВ или лекарственного сырья до и после высушивания (условия высушивания, температура и навеска указываются в ФС). Открытый бюкс вместе с крышкой охлаждают в эксикаторе в течение 50 мин и взвешивают.
Второй метод определения воды основан на свойстве двух несмешивающихся жидкостей (например, воды и толуола) перегоняться при более низкой температуре, чем каждая из этих жидкостей. Определение выполняют в специальном приборе. Затем содержание воды устанавливают по ее объему в приемнике после окончания перегонки и охлаждения.
Акваметрия, или метод титрования реактивом Фишера, состоит в определении в ЛВ как гигроскопической, так и кристаллизационной воды реактивом, включающим раствор диоксида серы, йода и пиридина в метаноле. Определение выполняют в закрытой системе, чтобы исключить влияние атмосферной влаги. Взаимодействие реактива с водой протекает по схеме:
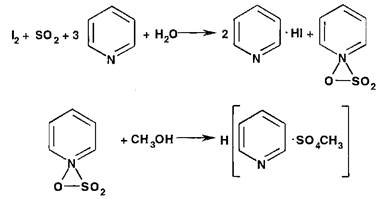
Недостатком метода, кроме необходимости соблюдения герметичности, является невозможность его использования в присутствии веществ, реагирующих с компонентами реактива (альдегиды, кетоны, меркаптаны, сульфиды, оксиды, ги- дроксиды, карбонаты металлов и др.).
Установление рИ среды
Величина рН дает важную информацию о степени чистоты ЛВ (содержании в нем примесей кислотного и основного характера). В ряде ФС рекомендуется устанавливать кислотность или щелочность путем нейтрализации примесей кислот или щелочей в водном растворе или экстракте. Нейтрализацию проводят в присутствии индикаторов (фенолфталеин, ти- молфталеин, метиловый красный и др.). О кислотности или щелочности судят либо по окраске индикатора, либо по ее изменению, либо по количеству кислоты или щелочи, затраченных на нейтрализацию.
В большинстве случаев ФС (ФСП) регламентирует величину рН среды раствора. Это значение, ориентировочно до 0,3 единицы рН, можно установить с помощью индикаторной бумаги или универсального индикатора. Более объективные результаты дают колориметрический и потенциометрический способы. Для колориметрического определения готовят серию буферных растворов, отличающихся друг от друга на величину рН, равную 0,2. К каждому из них добавляют по 2-3 капли индикатора. Аналогично поступают с испытуемым раствором, который готовят в тех же условиях. Затем сравнивают его окраску с приготовленной серией буферных растворов и устанавливают рН среды.
Потенциометрическое определение рН выполняют на потенциометрах или рН-метрах различных марок после предварительной их настройки с помощью буферных растворов. Этот метод отличается более высокой точностью, имеет меньше ограничений, может быть применен в присутствии окислителей, восстановителей, в окрашенных и мутных растворах.
15 Испытания на чистоту по физическим и химическим свойствам
Прозрачность и степень мутности. Прозрачными считают растворы, при освещении которых шаровой электролампой (40 Вт) на черном фоне не наблюдается присутствие нерастворенных частиц. Степень мутности устанавливают путем сравнения в одинаковых пробирках растворов испытуемого вещества с растворителем или с эталонами. Эталонами служат взвеси в воде, полученные смешиванием определенных количеств 1% раствора гидразина сульфата и 10% раствора гекса- метилентетрамина.
Окраску жидкостей по ГФ XI устанавливают, сравнивая испытуемые растворы с равным количеством одного из семи эталонов при дневном освещении на матово-белом фоне. Эталоны готовят, смешивая в различных соотношениях четыре основных раствора, получаемых из исходных растворов хлорида кобальта, дихромата калия, сульфата меди (И) и хлорида железа (III). Растворителем служит раствор серной кислоты (0,1 моль/л). Бесцветными считают растворы, цвет которых не отличается от воды.
Адсорбционную способность и дисперсность устанавливают в соответствии с требованиями ФС (ФСП), Дисперсность можно установить по скорости осаждения водной суспензии испытуемого ЛВ в мерном цилиндре. Адсорбционную способность — по обесцвечиванию окраски индикатора (метиленового синего) в растворе ЛВ с определенной концентрацией и в определенном объеме.
Примесь органических веществ обнаруживают действием концентрированной серной кислоты. При этом образуются окрашенные продукты, интенсивность окраски которых не должна превышать соответствующий эталон цветности.
Примесь восстанавливающих веществ в ЛВ устанавливают по обесцвечиванию растворов перманганата калия (определенного объема и концентрации).
Примесь окрашенных веществ определяют по бесцветности водного извлечения. Обнаруживают также примесь водорастворимых солей в Л В, нерастворимых в воде, и примеси, нерастворимые в воде, в водорастворимых ЛВ (по эталону мутности).
16 Определение золы
Общую золу устанавливают прокаливанием навески ЛВ в фарфоровом (платиновом) тигле при слабом красном калении (около 500°С) до постоянной массы. После окончания прокаливания тигель охлаждают в эксикаторе и взвешивают. При последующем добавлении к остатку 15 мл 10% раствора хлороводородной кислоты и нагревании в течение 10 мин на кипящей водяной бане отфильтрованный осадок вновь сжигают, прокаливают, охлаждают и взвешивают, определяя содержание золы, нерастворимой в хлороводородной кислоте.
Сульфатную золу определяют после нагревания и прокаливания навески ЛВ, смоченной 1 мл концентрированной серной кислоты. Нагревают осторожно на сетке или песчаной бане до удаления паров серной кислоты, а затем прокаливают до постоянной массы, которую устанавливают, охлаждая в эксикаторе и взвешивая тигель. Во многих ФС (ФСП) предус мотрено последующее определение в сульфатной золе примесей тяжелых металлов.
17 Испытание на специфические примеси
К числу специфических примесей относят присущие только определенному ЛВ исходные или промежуточные продукты синтеза, продукты разложения, сопутствующие биологически активные вещества (алкалоиды, гормоны, белки, полисахариды и др.). Они могут влиять на фармакологический эффект или оказывать токсическое действие. Несмотря на многообразие химической структуры специфических примесей, для их обнаружения используют несколько основных способов:
1. Использование специфической примеси в качестве эталона и фотометрическое или нефелометрическое определение ее содержания по отношению к этому эталону.
2. Использование способов, основанных на избирательном взаимодействии примеси с каким-либо реактивом и последующем ее определении.
3. Экстрагирование (отделение) примеси с помощью несмешивающихся растворителей (вода-эфир), отгонка растворителя и гравиметрическое, титриметрическое или фотометрическое ее определение.
4. Разделение и исследование примесей с помощью хроматографических методов (ТСХ, бумажная хроматография).
5. Испытания на чистоту, основанные на использовании ВЭЖХ, ГЖХ и их сочетания с другими методами (спектрофо- тометрия, масс-спектроскопия, полярография).
б.б. Химические методы определения лекарственных веществ
Методики, основанные на использовании химических методов, включены в ОФС и ФС (ФСП). Наиболее широко для количественного определения ЛВ применяют титриметрическис методы анализа. Значительно реже используют гравиметрический метод, газометрический метод и элементный анализ.
Гравиметрический метод основан на измерении массы вещества. Сущность определения состоит в последовательном выполнении реакции осаждения, отделении, высушивании и взвешивании осадка. ГФ рекомендует гравиметрию для количественного определения барбитуратов, солей хинина, других ЛВ в виде органических оснований или нерастворимых в воде продуктов реакции (пикратов, кремниевольфраматов и др.).
Газометрический метод основан на взаимодействии испытуемого ЛВ с поглотительным раствором, содержащим количественно реагирующие с ним компоненты. Применяют для определения газообразных ЛВ (кислород, оксид азота, циклопропан и др.).
18 Осадительное титрование
Аргеитометрия основана на реакциях осаждения галогенидов (Hal-) титрованным раствором нитрата серебра:
![]()
При прямом аргентометрическом титровании используют индикатор хромат калия (метод Мора) или адсорбционные индикаторы (метод Фаянса), При обратном титровании (метод Фольгарда) индикатором служат жслезоаммониевые квасцы, а избыток нитрата серебра определяют роданометрическим (тиоцианатометрическим) методом.
Ъюцианатометрия основана на реакции осаждения иона серебра тиоцианатом аммония (индикатор — железоаммоние- вые квасцы):
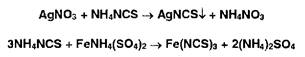
Меркуриметрия основана на образовании малодиссоциированных соединений ртути (II):
![]()
При титровании хлоридов индикатором служит дифенилкарбазид или дифенилкарбазон:
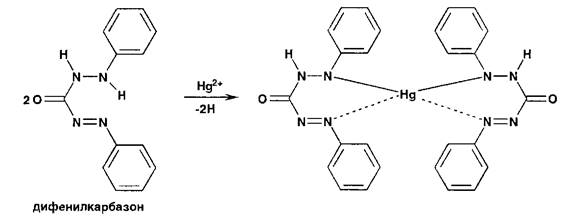
При титровании йодидов конечную точку титрования устанавливают по выпадению красного осадка йодида ртути (II) вследствие разрушения образующегося при титровании тетрайодомеркурат-иона:
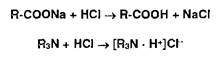
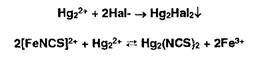
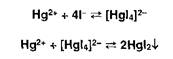
Меркурометрия — метод определения галогенидов, образующих малорастворимые соединения с катионами ртути (I). Титрантом служит раствор Ь^г^Оз):, индикатор — тиоцианат железа, который обесцвечивается в точке эквивалентности вследствие образования тиоцианата ртути (I):
19 Кислотно-основное титрование (метод нейтрализации)
Титрование в водной среде
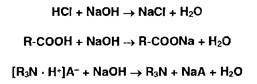
Ациднметрия используется для определения натриевых (калиевых) солей неорганических и органических кислот, а также органических оснований (ИзМ). Титрант— раствор хлороводородной кислоты:
Алкалиметрия используется для определения неорганических и органических кислот, а также солей органических оснований с различными кислотами:
Косвенная (заместительная) нейтрализация основана на реакции осаждения ионами серебра органических оснований, содержащих в молекуле вторичную аминогруппу или меркаптогруппу:
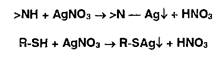
Выделившуюся кислоту титруют алкалиметрическим методом.
Оксимный метод также основан на косвенной нейтрализации эквивалентного количества хлороводородной кислоты, выделившейся при взаимодействии гидроксиламина гидрохлорида с кетопроизводными:
![]()
Этерификация в сочетании с алкалиметрией используется при определении спиртов и фенолов. Их ацетилируют уксусным ангидридом, а его избыток гидролизуют до уксусной кислоты, которую затем оттитровывают раствором гидроксида натрия:
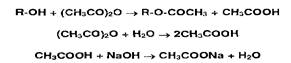
Параллельно выполняют контрольный опыт с тем же количеством уксусного ангидрида.
Гидролиз сложных эфиров в сочетании с ацидиметрией. Сложные эфиры гидролизуют титрованным раствором гидроксида натрия, избыток которого титруют хлороводородной кислотой:
![]()
Пиролиз может быть выполнен в кислой среде:
![]()
Образовавшуюся при гидролизе органическую кислоту можно извлечь эфиром и оттитровать алкалиметрическим методом.
20 Титрование в смешанных растворителях
Используют в тех случаях, когда ЛВ плохо растворяются в воде или водные растворы имеют слабо выраженные кислотные (щелочные) свойства. Они усиливаются в присутствии этанола (ацетона).
Титрование в воде в присутствии несмешивающихся с ней эфира или хлороформа используют для извлечения органического основания или кислоты из водной фазы, что исключает их влияние на результаты титрования.
Титрование н среде неводных растворителей (неводное титрование)
Метод позволяет количественно определить органические вещества, проявляющие в водной среде очень слабые основные или кислотные свойства. В качестве титрантов используют растворы сильных кислот или сильных оснований.
Неводное титрование органических оснований (Яз!4 !) и их солей (ЯзЫ ■ НА) выполняют, используя в качестве растворителей безводные уксусную кислоту, уксусный ангидрид, муравьиную кислоту или их сочетания. Титрантом служит раствор хлорной кислоты, индикаторами — кристаллический фиолетовый, тропсолин 00, метиловый оранжевый.
Титрование слабых органических оснований хлорной кислотой в среде ледяной уксусной кислоты включает несколько этапов:
Растворение НСЮ4 в ледяной СНзСООН:
![]()
2. Растворение основания (Яз1Ч) в ледяной СНзСООН:
![]()
3. Взаимодействие ацетоний- и ацетат-ионов:
![]()
4. Взаимодействие протонированного амина с хлорат-ионом:
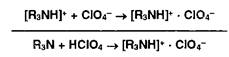
Очень слабые органические основания (рК> 12) необходимо титровать хлорной кислотой в среде уксусного ангидрида £УА), т.к. он более активно (чем ледяная уксусная кислота) усиливает основные свойства аминов.
1. Взаимодействие НСЮ4 с УА:
![]()
2. Растворение амина (ЯзИ) в УА:
![]()
3. Взаимодействие кислоты с основанием:
4. Взаимодействие ацетилий-иона с хлорат-ионом:
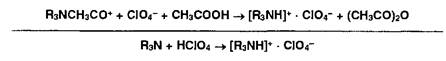
Соли органических оснований с галогеноводородными кислотами (ЯзЫ • НХ) проявляют кислотные свойства даже в неводной среде. Поэтому их титруют в присутствии ацетата ртути (II), который нейтрализует галогенпроизводную кислоту. Малодиссоциированные галогениды ртути (HgX2) и (СНзСОО)г^ не мешают определению. Образующийся ацетат органического основания оттитровывают хлорной кислотой:
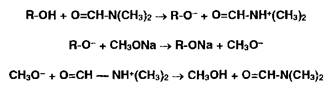
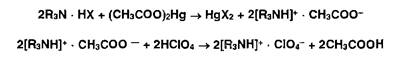
Неводное титрование галогеноводородов может быть выполнено без добавления ацетата ртути, если в качестве прото- генных растворителей использовать безводную муравьиную кислоту в присутствии уксусного ангидрида.
Неводное титрование органических веществ, проявляющих кислотные свойства (фенолы, барбитураты, карбоновые кислоты, сульфаниламиды и др.), выполняют, используя в качестве растворителя диметилформамид или его смесь с бензолом. Титрантом служит раствор гидроксида натрия в смеси метанола и бензола или раствор метилата натрия. В качестве индикатора используют тимоловый синий.
Суммарно процесс нейтрализации фенолов (енолов) можно представить так:
![]()
21 Окислительно-восстановительное титрование
Йодометрия — метод, основанный на окислительных свойствах йода и восстановительных свойствах йодид-ионов:
![]()
Титрант — раствор йода (индикатор — крахмал) используют для прямого титрования неорганических и органических веществ, способных окисляться или образовывать с йодом продукты присоединения или замещения. Используют также обратное йодометрическое титрование. При этом избыток йода титруют 0,1 М раствором тиосульфата натрия:
![]()
Восстановительные свойства йодида калия используют для количественного определения веществ, обладающих окислительными свойствами. Выделившееся эквивалентное количество йода оттитровывают тиосульфатом натрия.
Используют также сочетание реакции замещения (получение нерастворимых в воде моно-, ди- и трийодпроизводных) и обратной йодометрии. Йодпроизводные отфильтровывают, а в фильтрате определяют избыток титрованного раствора йода. Аналогичным образом используют
8-09-2015, 23:04