Прокариоты без клеточной стенки. При воздействии определенными химическими веществами оказалось возможным получать в лаборатории из разных видов эубактерий формы с частично (сферопласты) или полностью (протопласты) отсутствующей клеточной стенкой. Впервые это обнаружили при действии на бактериальные клетки лизоцимом, ферментом из группы гликозидаз, содержащимся в яичном белке, слезной жидкости и выделяемом некоторыми бактериями. Лизоцим разрывает b-1,4-гликозидные связи в гетерополисахаридной цепи (см. рис. 6), что в конечном итоге может привести к полному удалению пептидогликана из клеточной стенки. Полученные под действием лизоцима сферопласты (из грамотрицательных эубактерий) или протопласты (из грамположительных) принимают сферическую форму и очень чувствительны к внешнему осмотическому давлению. Существовать они могут только в условиях, когда осмотическое давление питательной среды сбалансировано с осмотическим давлением внутри клетки. В благоприятных условиях сферопласты и протопласты проявляют определенную метаболическую активность, но утрачивают способность к размножению.
Прокариоты, не содержащие клеточной стенки, обнаружены и в природе. Это группа микоплазм, сапрофитов и внутриклеточных паразитов растений, животных и человека. Формы, сходные с микоплазмами, были получены также опытным путем с помощью пенициллина, лизоцима и других факторов. Это так называемые L-формы. В благоприятных условиях они обладают метаболической активностью и способностью к размножению. Предполагают, что микоплазмы произошли в результате мутации, нарушившей синтез веществ клеточной стенки, от обычных бактериальных форм аналогично тому, как в экспериментальных условиях получают генетически стабильные L-формы.
Уникальность химического состава клеточной стенки прокариот, ее отличие от таковой эукариот сделали возможным создание и применение лекарственных препаратов, специфически действующих только на прокариотную клеточную стенку. На этом основано действие пенициллина и некоторых других антибиотиков, подавляющих разные этапы синтеза пептидогликана. Пенициллин, например, ингибирует образование связей между пептидными хвостами на этапе "сшивания" полимера, происходящего в клеточной стенке в процессе роста прокариотной клетки (см. рис. 7).
Функции клеточной стенки прокариот. Клеточная стенка прокариот выполняет разнообразные функции: механически защищает клетку от воздействий окружающей среды, обеспечивает поддержание ее внешней формы, дает возможность клетке существовать в гипотонических растворах. В первую очередь в этом "заслуга" пептидогликана.
Структурная дифференцировка клеточной стенки у грамотрицательных эубактерий, приведшая к формированию дополнительного слоя в виде наружной мембраны, значительно расширила круг функций клеточной стенки. Прежде всего это связано с проблемами проницаемости и транспорта веществ в клетку. Наружная мембрана имеет специфические и неспецифические каналы (поры) для пассивного транспорта веществ и ионов, необходимых клетке, т. е. осуществляет функции молекулярного "сита". Наружная мембрана также препятствует проникновению в клетку токсических веществ, что находит отражение в большей устойчивости грамотрицательных эубактерий (сравнительно с грамположительными) к действию некоторых ядов, химических веществ, ферментов и антибиотиков.
Появление у грамотрицательных эубактерий дополнительной мембраны в составе клеточной стенки фактически привело к созданию обособленной полости (периплазматического пространства), отграниченной от цитоплазмы и внешней среды специфическими мембранами и несущей важную функциональную нагрузку.
Периплазматическое пространство, куда погружен пептидогликановый слой. заполнено раствором, в состав которого входят специфические белки, олигосахариды и неорганические молекулы. Периплазматические белки представлены двумя типами: транспортными белками и гидролитическими ферментами. Транспортные белки — это переносчики, связывающиеся с соответствующими субстратами внешней среды и транспортирующие их от наружной мембраны к цитоплазматической.
Было обнаружено также, что многие бактерии способны в больших количествах вырабатывать ферменты (гликозидазы, протеазы, липазы и др.), гидролизующие все типы полимерных молекул. Последними могут быть как молекулы, синтезируемые самой клеткой, так и чужеродные, попавшие в клетку извне. Отрицательные последствия гидролиза собственных молекул (самопереваривание) очевидны. В то же время прокариоты нуждаются в гидролитических ферментах, так как это расширяет круг используемых ими веществ, включая в него полимеры разного типа. Становится понятна необходимость изолирования этих ферментов от цитоплазматического содержимого. Грамположительные эубактерий выделяют гидролитические ферменты во внешнюю среду, у грамотрицательных — они локализованы в периплазматическом пространстве.
Разнообразные функции выполняют макромолекулы, локализованные частично или полностью на внешней стороне клеточной стенки, контактирующей с окружающей средой; это специфические рецепторы для фагов и колицинов; антигены (липополисахарид грамотрицательных эубактерий, тейхоевые кислоты грамположительных); макромолекулы, обеспечивающие межклеточные взаимодействия при конъюгации, а также между патогенными бактериями и тканями высших организмов.
Капсулы, слизистые слои и чехлы
Снаружи клеточная стенка прокариот часто бывает окружена слизистым веществом. Такие образования в зависимости от структурных особенностей получили название капсул, слизистых слоев или чехлов. Все они являются результатом биосинтеза прокариотами органических полимеров и отложения их вокруг клеток.
Под капсулой понимают слизистое образование, обволакивающее клетку, сохраняющее связь с клеточной стенкой и имеющее аморфное строение (см. рис. 3, 19 ; 4, 2 ). Если толщина образования меньше 0,2 мкм и, следовательно, оно может быть обнаружено только с помощью электронного микроскопа, говорят о микрокапсуле. Если больше 0,2 мкм, говорят о макрокапсуле. Последнюю можно видеть в обычный световой микроскоп. Для этого препарат просматривают в капле туши, которая не в состоянии проникнуть в капсулу. На темном фоне выделяются клетки, окруженные светлыми зонами. Если же слизистое вещество имеет аморфный, бесструктурный вид и легко отделяется от поверхности прокариотной клетки, говорят о слизистых слоях, окружающих клетку (см. рис. 4, 3 ).
В отличие от капсул чехлы имеют тонкую структуру. Нередко в них обнаруживают несколько слоев с разным строением (см. рис. 4, 4 ). Чехлы ряда бактерий, метаболизм которых связан с окислением восстановленных соединений металлов, часто инкрустированы их окислами. Между этими структурами у прокариот обнаружено много переходных форм, так что иногда нельзя четко отграничивать капсулу от слизистых клеточных выделений или капсулу от чехла.
Наличие капсулы зависит от штамма микроорганизма и условий его культивирования. Бактерии, образующие капсулу, могут легко в результате мутации превращаться в бескапсульные формы, что не приводит к какому-либо нарушению клеточной активности, поэтому капсулы нельзя рассматривать как обязательный структурный компонент прокариотной клетки.
Капсулы, слизистые образования и чехлы могут содержать компоненты, одинаковые с клеточной стенкой, однако их химические составы не идентичны. Как правило, химический состав капсул, образуемых бактериями, родо- или видоспецифичен. Основные химические компоненты большинства капсул прокариот — полисахариды гомо- или гетерополимерной природы. Исключение составляет капсула некоторых видов Bacillus, построенная из полипептида, являющегося полимером D-глутаминовой кислоты. Для ряда бактерий показана способность синтезировать и выделять в окружающую среду волокна целлюлозы.
Чехлы как более сложные структуры имеют обычно и более сложный химический состав. Чехол Sphaerotilus natans , например, содержит 36% сахаров, 11 —гексозамина, 27— белка, 5, 2— липида и 0,5% фосфора.
Хотя капсулы, слизистые вещества и чехлы являются необязательными структурами прокариотной клетки, им приписывают определенные полезные для клетки функции. Вязкость внеклеточной среды, обусловленная наличием слизистых веществ, очевидно, благоприятна для клетки. Они защищают клетку от механических повреждений, высыхания, создают дополнительный осмотический барьер, служат препятствием для проникновения фагов. Иногда слизистые образования могут служить источником запасных питательных веществ. С помощью слизи осуществляется связь между соседними клетками в колонии, а также прикрепление клеток к различным поверхностям. Способность определенных бактерий синтезировать эти своеобразные внеклеточные полимеры находит практическое применение: их используют в качестве заменителя плазмы крови, а также для получения синтетических пленок.
Жгутики и механизмы движения
На клеточной поверхности многих прокариот имеются структуры, определяющие способность клетки к движению в жидкой среде. Это — жгутики. Их число, размеры, расположение, как правило, являются признаками, постоянными для определенного вида, и поэтому учитываются при систематике прокариот. Однако накапливаются данные о том, что количество и расположение жгутиков у одного и того же вида могут в значительной степени определяться условиями культивирования и стадией жизненного цикла, и, следовательно, не стоит переоценивать таксономическое значение этого признака.
Если жгутики находятся у полюсов или в полярной области клетки, говорят об их полярном или субполярном расположении, если — вдоль боковой поверхности, говорят о латеральном расположении. В зависимости от числа жгутиков и их локализации на поверхности клетки различают монополярные монотрихи (один жгутик прикреплен к одному полюсу клетки; см. рис. 3, 8 ), монополярные политрихи (пучок жгутиков расположен на одном полюсе клетки), биполярные политрихи (на каждом полюсе — по пучку жгутиков; см. рис. 3, 17 ) и перитрихи (многочисленные жгутики расположены по всей поверхности клетки или вдоль ее боковой поверхности; см. рис. 3, 18 ). В последнем случае число жгутиков может достигать 1000 на клетку.
 |
| Рис. 11. Строение жгутика грамотрицательных эубактерий: 1 — нить; 2 — крюк; 3 — базальное тело; 4 — стержень; 5 — L-кольцо; 6 — P-кольцо; 7 — S-кольцо; 8 — M-кольцо;9 — ЦПМ; 10 — периплазматическое пространство; 11 — пептидогликановый слой; 12 — наружная мембрана (по De Pamphilis, Adier, 1971) |
Обычная толщина жгутика — 10—20 нм, длина — от 3 до 15 мкм. У некоторых бактерий длина жгутика может на порядок превышать диаметр клетки. Как правило, полярные жгутики более толстые, чем перитрихиальные. Жгутик представляет собой относительную жесткую спираль, обычно закрученную против часовой стрелки. Вращение жгутика также осуществляется против часовой стрелки с частотой от 40 до 60 об/с, что вызывает вращение клетки, но в противоположном направлении. Поскольку клетка намного массивнее жгутика, она вращается со значительно меньшей скоростью — порядка 12—14 об/мин. Вращательное движение жгутика преобразуется также в поступательное движение клетки, скорость которого в жидкой среде для разных видов бактерий составляет от 16 до 100 мкм/с.
Изучение строения жгутика под электронным микроскопом обнаружило, что он состоит из трех частей (рис. 11). Основную массу жгутика составляет длинная спиральная нить (фибрилла), у поверхности клеточной стенки переходящая в утолщенную изогнутую структуру—крюк. Нить с помощью крюка прикреплена к базальному телу, вмонтированному в ЦПМ и клеточную стенку. У большинства прокариот нить состоит только из одного типа белка — флагеллина. Белковые субъединицы уложены в виде спирали, внутри которой проходит полый канал. Наращивание жгутика происходит с дистального конца, куда субъединицы поступают по внутреннему каналу. У некоторых видов жгутик снаружи дополнительно покрыт чехлом особого химического строения или же являющимся продолжением клеточной стенки и, вероятно, построенным из того же материала.
Крюк (толщина 20—45 нм) состоит из белка, отличающегося от флагеллина, и служит для обеспечения гибкого соединения нити с базальным телом. Базальное тело содержит 9—12 различных белков и представляет собой систему из двух или четырех колец, нанизанных на стержень, являющийся продолжением крюка. Два внутренних кольца (M и S) — обязательные составные части базального тела, в то время как наружные кольца (Р и L) отсутствуют у грамположительных эубактерий и, следовательно, не необходимы для движения. M-кольцо локализовано в ЦПМ, S-кольцо располагается в периплазматическом пространстве грамотрицательных или в пептидогликановом мешке грамположительных эубактерий.
 |
| Рис. 12. Клетка Salmonella typhimurium в состоянии покоя (А) и при движении (Б). Стрелками показано направление вращения и движения клетки |
Кольца Р и L, имеющиеся только у грамотрицательных эубактерий, локализованы соответственно в пептидогликановом слое и в наружной мембране. Особенности строения базального тела определяются, таким образом, строением клеточной стенки. Интактность последней необходима для движения жгутиковых бактерий. Обработка клеток лизоцимом, приводящая к удалению пептидогликанового слоя клеточной стенки, вызывает и потерю способности бактерий к движению, хотя жгутики остаются при этом неповрежденными.
Предполагают, что вращение жгутика определяется вращением M-кольца. Другие кольца базального тела неподвижны и служат для крепления стержня, проходящего через клеточную стенку грамотрицательных эубактерий. У грамположительных эубактерий эту функцию в основном выполняет многослойный жесткий пептидогликановый мешок.
Большие успехи достигнуты в расшифровке механизма движения прокариот, имеющих жгутики. Если в клетке много жгутиков. все они при движении собираются в пучок, вращаясь в одном направлении (рис. 12). Вращение жгутиков передается клетке, начинающей вращаться в противоположном направлении, и обеспечивает эффективное движение (плавание) в жидкой среде и более медленное перемещение по поверхности твердых сред.
Для работы двигательного аппарата прокариот необходима энергия. Установлено, что движение жгутиковых прокариот обеспечивается энергией трансмембранного электрохимического потенциала (DmH + ), причем обе его составляющие — электрическая (Dy) и концентрационная (DpH) — поддерживают движение. Скорость вращения жгутиков прямо зависит от величины мембранного потенциала. Таким образом, прокариотная клетка обладает механизмом, позволяющим превращать электрохимическую форму энергии непосредственно в механическую. Молекулярное устройство, обеспечивающее это превращение, к настоящему времени не выяснено, но можно полагать, что оно должно быть весьма эффективным, так как, по проведенным расчетам, энергия, расходуемая на движение, составляет десятые доли процента от общего количества энергетических потребностей клетки.
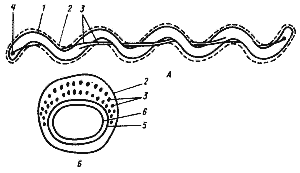 |
| Рис. 13. Клетка спирохеты в продольном (А) и поперечном (Б) разрезе. На рис. А изображена клетка, содержащая по одной аксиальной фибрилле у каждого конца; на рис. Б — поперечный разрез, прошедший через среднюю часть клетки, где показаны два пересекающихся пучка, состоящих из множества аксиальных фибрилл: 1 — протоплазматический цилиндр; 2 — наружный чехол; 3 — аксиальные фибриллы; 4 — место прикрепления аксиальных фибрилл; 5 — пептидогликановый слой клеточной стенки; 6 — ЦПМ |
Необычная локализация структур, ответственных за движение, описана у спирохет (рис. 13). Трехслойная структура, окружающая клетку и называемая у спирохет наружным чехлом, аналогична наружной мембране клеточной стенки грамотрицательных эубактерий. Этот чехол окружает так называемый протоплазматический цилиндр, состоящий из пептидогликанового слоя клеточной стенки, ЦПМ и цитоплазматического содержимого. Протоплазматический цилиндр обвивается пучком нитчатых структур — аксиальных фибрилл. Число их колеблется от 2 до 100. Один конец каждой аксиальной фибриллы прикреплен вблизи полюса протоплазматического цилиндра, другой— свободный. Клетка содержит по два набора фибрилл, прикрепленных субполярно у каждого клеточного конца. Так как каждая аксиальная фибрилла тянется почти вдоль всей длины клетки, пучки фибрилл, прикрепленных у разных полюсов, в центральной части перекрываются.
Изучение строения и химического состава аксиальных фибрилл спирохет обнаружило их близкое сходство с бактериальными жгутиками. Отличие заключается в том, что аксиальные фибриллы спирохет — внутриклеточные структуры, но обеспечивают движение как в жидкой среде, так и по твердому субстрату. Движение спирохет осуществляется за счет вращения фибрилл в периплазматическом пространстве между пептидогликановым слоем и наружной мембраной клеточной стенки, вызывающего эластичную волну на поверхности клеточной стенки. Спирохеты совершают движения трех типов: быстро вращаются вокруг длинной оси спирали, способны к изгибанию клеток и осуществляют передвижение по винтовому или волнообразному пути. Для спирохет (так же как для типичных жгутиковых бактерий) показано, что движение обеспечивается энергией в форме DmH + .
Присущая спирохетам локализация двигательного аппарата интересна тем, что позволяет сделать вывод о возможности его работы в условиях нахождения в "закрытом" клеточными структурами состоянии. Это может служить ключом к пониманию еще одного вида движения, присущего части прокариот, — скольжения. Последнее определяют как способность организма передвигаться по твердому или полужидкому субстрату без помощи наружных локомоторных структур — жгутиков.
Способность к скольжению обнаружена у разных групп прокариот, как одноклеточных, так и многоклеточных, имеющих нитчатое строение: некоторых микоплазм, миксобактерий, цитофаг, нитчатых серобактерий, цианобактерий и др. Скорость этого типа движения невелика: 2–11 мкм/с. Общим для всех скользящих организмов является способность к выделению слизи. Кроме того, у ряда скользящих форм в составе клеточной стенки между пептидогликановым слоем и наружной мембраной обнаружен тонкий слой, состоящий из белковых фибрилл. Например, у нитчатой цианобактерий Oscillatoria к наружной поверхности пептидогликанового слоя примыкают параллельные ряды фибрилл диаметром 5–7 нм: на 1 мкм2 поверхности приходится до 55 таких фибрилл. У нитчатых цианобактерий фибриллы формируют единую систему, непрерывно в виде спирали обволакивающую весь трихом (нить). Скольжение нитчатых форм сопровождается и одновременным их вращением, так что любая точка на поверхности трихома описывает при движении спираль. Направление вращения является видоспецифическим признаком и коррелирует с направлением хода спирали белковых фибрилл.
Механизм скользящего движения не ясен. Согласно гипотезе реактивного движения оно обусловлено выделением слизи через многочисленные слизевые поры в клеточной стенке, в результате чего клетка отталкивается от субстрата в направлении, противоположном направлению выделения слизи. Однако анализ этой модели привел к заключению, что для обеспечения скольжения по "реактивному" механизму клетке необходимо в течение 1 с выделять такой объем слизи, который во много раз превосходит ее цитоплазматическое содержимое.
По другой гипотезе, получившей распространение в последние годы, скользящее движение связано с особенностями строения клеточной стенки подвижных безжгутиковых форм — наличием белкового слоя, состоящего из упорядоченно расположенных фибрилл, аналогичных нитям жгутиков, с той разницей, что находятся фибриллы "внутри" клеточной стенки. У некоторых скользящих бактерий описаны структуры, весьма напоминающие базальные тела жгутиковых форм. Вращательное движение фибрилл, "запускаемое" этими структурами, приводит к появлению на поверхности клетки так называемой "бегущей волны", т. е. движущихся микроскопических выпуклостей клеточной стенки, в результате чего клетка отталкивается от твердого или вязкого субстрата. На скольжение расходуется около 5% энергии от общего объема клеточных энергетических затрат. Скользящее движение в разных группах бактерий обеспечивается энергией в форме АТФ или
29-04-2015, 01:57
